微小RNA-34a在紫草素抑制肺癌H1299细胞增殖和侵袭中的作用及其机制
2023-01-05韩林
韩林
紫草素是传统中药紫草的主要活性成分之一,除了具有抗炎、抗菌和促进伤口愈合等药理活性外,还在结肠癌、食管癌和肺癌等肿瘤中表现出较好的抗肿瘤活性[1-3]。微小RNAs(miRNAs)是一类与肿瘤发生发展关系密切的非编码RNA,可通过与靶基因mRNA的3'非编码区(3'UTR)结合在转录后水平促进靶基因mRNA降解或抑制其翻译,影响肿瘤细胞增殖、侵袭和凋亡等细胞功能[4]。越来越多的研究显示,miRNAs如miR-106b和miR-143等在紫草素抗肿瘤过程中发挥着重要作用[5-6]。miR-34a是miR-34家族成员,位于11q23染色体上,被证实在肺癌组织中异常低表达,而上调其表达具有抑制癌细胞增殖和侵袭的作用[7]。近年来,有报道指出,miR-34a表达上调是紫草素抑制视网膜母细胞瘤增殖的重要机制,但miR-34a是否参与紫草素抗肺癌增殖和侵袭的过程尚不清楚[8]。因此,本研究于2019年9月至2020年3月,通过开展体外细胞实验,观察miR-34a在紫草素抑制肺癌H1299细胞增殖和侵袭中的作用,并探讨其可能的分子机制,以期在临床上为紫草素治疗肺癌提供实验依据。
1 材料与方法
1.1 实验材料
1.1.1 主要试剂RPMI1640培养液购于美国Gibco公司;Yin Yang-1(YY1)和甘油醛-3-磷酸脱氢酶(GAPDH)一抗,辣根过氧化酶标记的二抗均购于美国Abcam公司;pcDNA 3.1-YY1-GFP过表达质粒及其对照pcDNA3.1-GFP空载体质粒购于百奥迈科生物技术有限公司;脂质体2000转染试剂和Trizol试剂盒购于美国Invitrogen公司;反转录试剂盒购于北京天根生化公司;二辛可宁酸(BCA)蛋白定量试剂盒购于美国Thermo公司;紫草素、胰蛋白酶和噻唑蓝(MTT)试剂购于美国Sigma公司;Matrigel胶购于美国BD公司;miR-34a模拟物、miR-34a抑制剂及其相应对照购于上海吉玛生物公司;双萤光素酶报告基因检测试剂盒购于美国Promega公司。
1.1.2 主要仪器细胞培养箱购于美国Thermo Forma公司,凝胶成像分析系统、转染系统和酶标仪购于美国Bio-Rad公司,倒置显微镜购于日本Nikon公司,Transwell小室购于美国Corning公司。
1.2 实验方法
1.2.1 细胞培养和紫草素处理将来自中科院上海细胞库的H1299细胞解冻复苏后,接种至含10%胎牛血清(FBS)的RPMI1640培养液中置于细胞培养箱中常规培养。待细胞融合度达80%左右时按1∶3比例进行传代。将细胞分为对照组(0 μmol∕L),1 μmol∕L、2.5 μmol∕L和5 μmol∕L的紫草素处理组,分别加入终浓度为0、1、2.5和5 μmol∕L紫草素处理。
1.2.2 MTT法检测细胞存活率将各组H1299细胞按照104个∕孔种植于96孔细胞板上,常规培养48 h,另以不含细胞的培养液作为空白组。待紫草素作用48 h后,弃培养液,加入20 μL 5 g∕L的MTT溶液继续培养4 h。弃去MTT液后,每孔加入150 μL二甲基亚枫孵育20 min,采用酶标仪在570 nm处检测吸光度值并计算细胞存活率。细胞存活率(%)=(药物组吸光度值-空白组吸光度值)∕(对照组吸光度值-空白组吸光度值)×100%。
1.2.3 平板克隆实验检测细胞克隆形成能力各组H1299细胞经紫草素处理48 h后制成单细胞悬液。将细胞以800个∕孔接种至6孔板,于细胞培养箱内常规培养10~12 d,待有肉眼可见集落形成时终止培养。弃上清,加入4%多聚甲醛固定15 min,应用结晶紫染液染色20 min。洗去染液,通过倒置显微镜观察并计数各组大于15个细胞的集落形成数量。
1.2.4 Transwell小室检测细胞侵袭能力将Matrigel基质胶与无血清培养液按照1∶4比例混合后,取混合液25 μL平铺于Transwell小室上室,并置于37℃培养箱中至充分融合。将不同浓度的紫草素处理48 h的H1299细胞制成浓度浓度为105个∕毫升,在Transwell小室上室中加入200 μL细胞悬液,小室下室中加入500 μL含10%FBS的RPMI1640细胞培养液,置于细胞培养箱内培养24 h。取出小室,弃上室内培养液后,使用棉签拭去小室膜表面细胞,加入4%多聚甲醛固定15 min后,加入结晶紫染液染色20 min。于倒置显微镜下每组随机选取5个视野观察穿膜细胞数,取平均值。
1.2.5 RT-PCR检测miR-34a表达水平收集紫草素处理48 h后的各组细胞,加胰酶消化后加入Trizol试剂提取细胞总RNA。将RNA逆转录互补DNA(cDNA),以cDNA为模板,根据上海生工生物合成的PCR引物按照94℃、5 min预变性;94℃、30 s变性,60℃、30 s退火,72℃、30 s延伸,共循环38次的反应条件以U6为内参进行PCR扩增。miR-34a正向引物序列为5'-GTGCAGTGGCAGTGTCTTAGC-3',反向引物序列为5'-GTGCAGGGTCCGAGGT-3';U6正向引物序列为5'-CGCTTCACGAATTTGCGTGTCAT-3',反向引物序列为5'-GCTTCGGCAGCACATATACTAAAAT-3'。采用2-ΔΔCt法检测各组细胞中miR-34a的表达水平。
1.2.6 细胞转染将对数生长期H1299细胞按照105个∕孔的密度接种于6孔板,常规条件下孵育过夜。通过脂质体2000转染试剂盒将miR-34a抑制剂及其阴性对照或者pcDNA 3.1-YY1-GFP过表达质粒及pcDNA 3.1-GFP空载体质粒分别转至H1299细胞中,转染48 h后给予浓度为5 μmol∕L紫草素处理48 h,并分别标记为紫草素+anti-miR-34a组和紫草素+anitmiR-NC组或紫草素+pcDNA 3.1-YY1组和紫草素+pcDNA3.1组。另以正常培养的H1299细胞作为正常组,以不做转染只给予5 μmol∕L紫草素处理的H1299细胞作为紫草素组。待处理结束后,收集各组细胞,分别采用MTT法、平板克隆实验、Transwell小室实验检测各组细胞的存活率、克隆形成和侵袭能力。
1.2.7 蛋白质印迹法检测YY1蛋白表达收集紫草素处理48 h的各组H1299细胞提取细胞总蛋白,BCA法检测蛋白的浓度。将蛋白样品与5×十二烷基硫酸钠(SDS)上样缓冲液以4∶1比例混合均匀,沸水浴变性。按照每孔60 μg将蛋白样品电泳分离后,采用湿转法将蛋白样品转至PVDF膜上。经含5%脱脂奶粉的封闭液封膜处理1.5 h后,加入YY1抗体和GAPDH抗体(稀释比1∶1 000)4℃下孵育24 h。次日加入二抗(稀释比1∶2 000)工作液室温孵育1 h后,滴加化学发光剂显影。以GAPDH为管家基因,采用凝胶成像系统分析YY1蛋白的表达水平。
1.2.8 双萤光素酶报告基因实验验证miR-34a与YY1靶向关系运用生物信息学软件TargetScan(https:∕∕www.targetscan.org)、miRBase(https:∕∕microrna.sanger.ac.uk)和MiRanda(https:∕∕www.microrna.org)对miR-34a潜在靶基因进行预测,最终将YY1作为研究对象。将YY1 3’UTR片段克隆并重组于psiCHECK2质粒上,构建psiCHECK2-YY1野生型(YY1-WT)报告基因质粒;同时,利用Takara点突变 试 剂 盒 将YY1 3’UTR与miR-34a结 合 位 点“ACUGCCA”进行突变为“UGACGGU”后,克隆到psiCHECK2质 粒 上,构建psiCHECK2-YY1野生 型(YY1-MUT)报告基因质粒。将质粒分别与miR-34a模拟物、miR-34a抑制剂及其阴性对照参照脂质体2000说明书步骤共转染至H1299细胞中,48 h后根据双萤光素酶报告基因检测试剂盒说明书检测各组细胞萤光素酶活性。
1.3 统计学方法采用SPSS 22.0进行统计学分析。实验数据以表示,多组间比较采用单因素方差分析,组间多重比较采用SNK-q;两组间比较采用独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 紫草素以浓度依赖性抑制肺癌H1299细胞增殖和侵袭以1、2.5和5 μmol∕L紫草素处理后发现,肺癌H1299细胞存活率、克隆细胞数和侵袭细胞数呈浓度依赖性降低,且与对照(0 μmol∕L)组比较,均差异有统计学意义(P<0.05)。见图1,表1。
表1 不同浓度紫草素对H1299细胞增殖、侵袭的影响

表1 不同浓度紫草素对H1299细胞增殖、侵袭的影响
注:①与0 μmol∕L比较,P<0.05。②与1 μmol∕L比较,P<0.05。③与2.5 μmol∕L比较,P<0.05。
浓度0 μmol∕L 1 μmol∕L 2.5 μmol∕L 5 μmol∕L F值P值重复次数3 3 3 3细胞存活率∕%100 82.15±5.02①71.64±4.28①②58.37±2.53①②③33.93<0.001克隆细胞数156.55±9.06 127.63±7.38①108.85±6.34①②91.72±6.15①②③43.11<0.001侵袭细胞数116.00±7.85 93.12±5.56①75.25±4.68①②59.85±3.20①②③56.15<0.001
2.2 紫草素以浓度依赖性上调肺癌H1299细胞中miR-34a表达0、1、2.5和5 μmol∕L紫草素处理后H1299细胞中miR-34a的表达水平分别为1.03±0.08、1.65±0.12、1.65±0.12、5.12±0.50,组间比较差异有 统计学 意义(F=99.27,P<0.001)。与对照(0 μmol∕L)组比较,1、2.5和5 μmol∕L紫草素处理后H1299细胞中miR-34a的表达水平明显升高(P<0.05),且呈浓度依赖性。
2.3 miR-34a与YY1靶向关系验证生物信息学软件预测显示,YY1与miR-34a之间存在互补结合位点,见表2。同时,miR-34a与YY1 3'UTR野生型质粒(YY1-WT)共转染后细胞的萤光素酶活性较对照miR-NC明显降低(P<0.05),而anti-miR-34a与YY1-WT共转染后细胞的萤光素酶活性较对照antimiR-NC明显升高(P<0.05)。但是,miR-34a或者anti-miR-34a与YY1 3'UTR突变型质粒(YY1-MUT)共转染后细胞的萤光素酶活性与相应对照比较,差异无统计学意义(P>0.05)。见表3。

表2 YY1 3'UTR与miR-34a的结合位点
表3 各组细胞萤光素酶活性的对比

表3 各组细胞萤光素酶活性的对比
注:YY1-WT为psiCHECK2-YY1野生型报告基因质粒,YY1-MUT为psiCHECK2-YY1突变型报告基因质粒。①与miR-NC组比较,P<0.05。②与anti-miR-NC组比较,P<0.05。
组别miR-NC miR-34a anti-miR-NC anti-miR-34a F值P值重复次数3 3 3 3萤光素酶活性YY1-WT 0.96±0.05 0.32±0.03①1.01±0.07 3.56±0.21②470.39<0.001 YY1-MUT 1.02±0.07 0.97±0.06 0.96±0.06 1.00±0.08 0.49 0.698
2.4 下调miR-34a逆转紫草素对肺癌H1299细胞增殖、侵袭的抑制作用并促进YY1蛋白表达与正常组比较,紫草素处理后H1299细胞中miR-34a的表达水平明显升高,而YY1蛋白的表达水平、细胞存活率、克隆细胞数和侵袭细胞数均明显降低(P<0.05);与紫草素组比较,转染anti-miR-34a后紫草素对H1299细胞的上述作用得到部分逆转(P<0.05);而转染anti-miR-NC后紫草素对H1299细胞的上述作用未有显著改变(P>0.05)。见图2,表4。
表4 下调miR-34a对肺癌H1299细胞中Yin Yang-1(YY1)蛋白表达及细胞增殖、侵袭的影响
表4 下调miR-34a对肺癌H1299细胞中Yin Yang-1(YY1)蛋白表达及细胞增殖、侵袭的影响
注:①与正常组比较,P<0.05。②与紫草素组比较,P<0.05。
组别正常组紫草素组紫草素+anti-miR-NC组紫草素+anti-miR-34a组F值P值重复次数3 3 3 3 miR-34a 1.00±0.06 4.68±0.35①4.56±0.37①1.25±0.13①②175.11<0.001 YY1蛋白1.32±0.13 0.35±0.03①0.38±0.03①0.76±0.05①②115.64<0.001细胞存活率∕%100 60.15±3.23①61.08±3.35①82.42±5.21①②41.43<0.001克隆细胞数161.35±11.26 82.48±5.35①80.72±5.28①126.51±9.36①②66.35<0.001侵袭细胞数123.48±8.21 57.82±3.52①55.65±3.17①90.35±4.05①②115.55<0.001
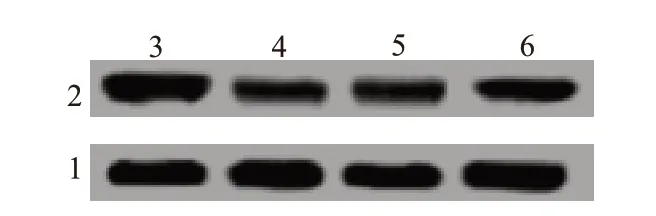
图2 下调miR-34a对紫草素处理的肺癌H1299细胞中YY1蛋白表达的影响
2.5 上调YY1表达逆转紫草素对肺癌H1299细胞增殖和侵袭的抑制作用与正常组比较,紫草素处理后H1299细胞中YY1蛋白的表达水平、细胞存活率、克隆细胞数和侵袭细胞数均明显降低(P<0.05);与紫草素组比较,转染YY1-pcDNA3.1过表达质粒后紫草素对H1299细胞的上述作用明显减弱(P<0.05);而转染pcDNA3.1空载体质粒后显著未影响紫草素对H1299细胞的上述作用(P>0.05)。见图3,表5。
表5 上调Yin Yang-1(YY1)表达对肺癌H1299细胞增殖和侵袭的影响

表5 上调Yin Yang-1(YY1)表达对肺癌H1299细胞增殖和侵袭的影响
注:①与正常组比较,P<0.05。②与紫草素组比较,P<0.05。
组别正常组紫草素组紫草素+pcDNA3.1组紫草素+pcDNA3.1-YY1组F值P值重复次数3 3 3 3 YY1蛋白1.41±0.22 0.32±0.03①0.36±0.03①0.88±0.06①②58.68<0.001细胞存活率∕%100 62.38±3.16①64.15±3.32①79.46±5.85①②31.40<0.001克隆细胞数158.46±10.35 81.72±6.18①83.05±5.96①118.54±8.05①②64.27<0.001侵袭细胞数118.85±7.62 56.46±3.28①58.23±3.36①85.26±5.02①②97.41<0.001

图3 上调YYI对紫草素处理的肺癌H1299细胞中YY1蛋白表达的影响
3 讨论
肺癌是最常见的肺原发性恶性肿瘤,也是导致人类癌症相关死亡的首因。目前手术切除和化疗是肺癌的主要治疗手段,但治疗效果并不理想。随着中药抗肿瘤热度的增加,越来越多的抗肿瘤药物被发现。紫草素是一种从中草药紫草中提取的萘醌类化合物,主要用于静脉炎、肝炎、烧伤和血管性紫癜等疾病的治疗[9],此外,紫草素还在多种肿瘤中表现出较好的抗肿瘤作用。Guo等[10]报道,紫草素可通过CD147抑制胶质瘤细胞的增殖并诱导其凋亡,被认为是一种很有前途的肿瘤治疗药物。Zhang等[11]研究证实,紫草素可通过下调DNMT1表达抑制甲状腺癌TPC-1细胞侵袭和迁移。Shilnikova等[12]研究指出,紫草素可通过诱导耐药的人卵巢癌A2780-CR细胞线粒体介导的凋亡和减弱上皮间充质转化增强顺铂的抗肿瘤作用。本研究1、2.5和5 μmol∕L紫草素处理后发现,紫草素可呈浓度依赖性抑制肺癌H1299细胞增殖和侵袭。该结果与王媛等[13]得到的紫草素抑制肺腺癌H1975细胞增殖以及Hsieh等[14]得到的紫草素可抑制肺癌HCC827细胞侵袭的结果相吻合。
此外,本研究还发现紫草素可呈剂量依赖性上调miR-34a的表达。这提示,miR-34a可能在紫草素抗肺癌H1299细胞增殖和侵袭过程中发挥着重要作用。miR-34a属于miR-34a家族,最早是在秀丽隐杆线虫中被发现的;其上游区域中含有能够与抑癌因子p53结合的位点,受p53的直接调控[15]。多个研究显示,miR-34a异常低表达于肝癌、乳腺癌和前列腺癌等多种恶性肿瘤,可抑制肿瘤细胞增殖和侵袭[16-18]。Wang等[7]研究得出miR-34a具有抑制肺癌细胞增殖和侵袭的作用。本研究通过转染miR-34a抑制剂成功下调miR-34a表达后发现,miR-34a低表达可通过促进肺癌H1299细胞增殖和侵袭,逆转紫草素抗H1299细胞增殖和侵袭的作用。结果提示,紫草素可通过上调miR-34a表达抑制肺癌H1299细胞增殖和侵袭。
为了进一步探讨miR-34a参与紫草素抗肺癌细胞增殖和侵袭的分子机制,本研究运用生物信息学软件对miR-34a的潜在靶基因进行预测发现在YY1与miR-34a之间存在互补的结合位点,最终选用YY1作为研究对象。YY1是锌指类转录因子GLl-Kruppel家族成员,定位于人类14号染色体端粒区,可通过调控不同的蛋白辅助因子影响肿瘤相关基因表达,参与肿瘤的发生、发展[19]。双萤光素酶报告基因实验证实,miR-34a可靶向结合YY1降低细胞的萤光素酶活性;同时,下调miR-34a表达可促进YY1蛋白的表达。这一系列结果显示,YY1是miR-34a的靶基因。Huang等[20]研究证实,YY1异常高表达于肺癌组织和细胞中,通过促进肿瘤细胞的增殖和侵袭过程参与肿瘤的发生、发展。本研究通过转染pcDNA3.1-YY1-GFP过表达质粒成功上调YY1表达后发现,紫草素对肺癌H1299细胞增殖和侵袭的抑制作用明显减弱。结果提示,紫草素可能通过介导miR-34a靶向调控YY1抑制肺癌H1299细胞增殖和侵袭。
综上所述,miR-34a在紫草素抑制肺癌H1299细胞增殖和侵袭过程中发挥着积极作用,其作用机制可能与靶向调控YY1表达有关。
(本文图1见插图1-4)

图1 紫草素对H1299细胞克隆形成和侵袭的影响:A为平板克隆实验结果;B为Transwell实验结果(结晶紫染色×200)
