基于NOD样受体热蛋白结构域3/胱天蛋白酶-1通路探讨鱼腥草注射液缓解脂多糖诱导的小鼠急性肺炎肺损伤的作用机制
2023-01-05简宇范婷代凌云赵春虎
简宇,范婷,代凌云,赵春虎
肺炎是一种常见的呼吸系统疾病,多发病于儿童及年老体弱人群,其发病机制复杂,具有发病迅速、发展速度快、不易治疗等特点,严重者可诱发心血管系统疾病,甚至危及生命[1]。近年来,肺炎发生率逐渐升高,给人们的生活和生命健康带来严重威胁[2]。肺部持续炎性反应和感染是肺炎的主要病理形式之一[3],而NOD样受体热蛋白结构域3(NLRP3)∕胱天蛋白酶-1(caspase-1)通路可促进炎性因子释放,介导炎症反应,并参与肺组织损伤过程[4-5],因此NLRP3∕caspase-1通路分子在组织炎症损伤过程的调控作用,也受到广大学者的关注。中医药在治疗肺炎方面有其独特的优势,鱼腥草注射液(HHI)具有清热、解毒、利湿作用,临床上常用于治疗肺脓疡、痰热咳嗽、尿路感染等症,近来研究发现,其在治疗急性肺炎方面,具有较好的疗效[6],但HHI治疗肺炎的具体分子生物学机制还不甚明确。本研究于2019年7月至2020年6月,用脂多糖(LPS)诱导建立小鼠肺炎模型,探究HHI对肺炎小鼠NLRP3∕caspase-1通路的影响。
1 材料与方法
1.1 实验材料
1.1.1 动物同遗传背景BALB∕c雄性小鼠,清洁级,4~6周龄,体质量20~25 g,购自广东省医学实验动物中心[许可证号SCXK(粤)2018-0002]。本研究符合一般动物实验伦理学原则。。
1.1.2 主要试剂、仪器鱼腥草注射液(河南利欣制药股份有限公司,批号B201658,规格2毫升∕支);苏木精-伊红染色(HE)染色试剂盒(上海联迈生物工程有限公司,货号LMO105);白细胞介素-6(IL-6)ELISA试剂盒(上海康朗生物科技有限公司,货号LS-F37731);肿瘤坏死因子-α(TNF-α)ELISA试剂盒(上海笃玛生物科技有限公司,货号DMM57136);NLRP3激动剂二乙基二硫代氨基甲酸酯(DDC)试剂(美国Sigma公司,货号S-0319);NLRP3抗 体(货 号ab264468)、caspase-1抗 体(货 号ab138483)、凋亡相关斑点样蛋白(ASC)抗体(货号ab155970)、TNF-α抗体(货号ab109322)、IL-6抗体(货号ab229381),均购自美国abcam公司;总RNA轴提取(Trizol)试剂盒(货号T6126)、反转录试剂盒(货号T1597),均购自日本TAKARA;BCA蛋白定量试剂盒(美国Pierce公司,货号P0768)。光学显微镜(货号SMZ745,日本尼康公司);凝胶成像仪(Miulab公司,型号GIS-500);流式细胞分选仪(碧迪医疗器械有限公司,型号ACS AriaⅡ);实时荧光定量PCR仪(德国Eppendorf艾本德,型号Mastercycler nexus X2)等。
1.2 方法
1.2.1 动物分组、肺炎模型构建及给药90只小鼠分为正常对照组、模型组、HHI低(10 mL∕kg)及高(30 mL∕kg)剂量组、NLRP3激动剂(二乙基二硫代氨基甲酸酯,DDC)组(300 mg∕kg)、HHI+DDC组(30 mL∕kg+300 mg∕kg),每组15只。除正常对照组外的各组小鼠均依据文献[7]用雾化吸入LPS法构建肺炎模型:将小鼠装入密闭盒中,用空气压缩机将压缩后的空气送到装有LPS浓度为2.5 g∕L的塑料管中,启动雾化器,将LPS雾化成为雾状液体,并将雾化液体送入密闭盒中,持续雾化30 min即可。正常对照组小鼠仅雾化吸入0.9%的生理盐水。造模后5 h,HHI低、高剂量组静脉注射10 mL∕kg、30 mL∕kg的HHI[8];DDC组灌胃给予10 mL∕kg DDC(用生理盐水稀释成30 g∕L的溶液)[9];HHI+DDC组静脉注射和灌胃给予30 mL∕kg的HHI和300 mg∕kg的DDC;模型组、正常对照组分别灌胃和静脉注射等量生理盐水。各组每天给药1次,连续4 d。给药期间观察小鼠饮食、饮水、活动量等一般行为状况。
1.2.2 标本采集末次给药24 h后,每组按随机数字表法选取5只小鼠,3%戊巴比妥钠麻醉后开胸,对左主支气管进行结扎,取左肺,于颈部分离气管进行插管后,用磷酸盐缓冲液(PBS)灌洗右肺3次,每次1 mL,获得支气管肺泡灌洗液(BALF),将BALF离心分离后得上清液及细胞,备用,处死小鼠。剩余小鼠,麻醉后处死,取完整左右两肺,右肺称重后,置于80℃烘箱内烘烤72 h后,称量干质量,计算湿∕干质量比值。剪取左肺0.5 g组织冻存备用,剩余组织立即于4%多聚甲醛中固定24 h。
1.2.3 BALF中IL-6、TNF-α含量及中性粒细胞数目检测取“1.2.2”中的BALF上清液,按IL-6、TNF-α试剂盒说明书检测IL-6、TNF-α含量。取“1.2.2”中BALF离心后的细胞,参照文献[9]进行混合流式抗体(CD45∕CD11b∕F4∕80∕Gr-1∕CD48)避 光 染 色15 min。用2 mL PBS溶液重悬绝对计数管(内含有已知数目的荧光微球)后,向每个样本管内加入200 μL重悬液体,用流式细胞分选仪检测BALF中中性粒细胞(CD45+CD11bhighGr-1high)及荧光微球百分比进行检测。按公式:中性粒细胞数目=荧光微球数目∕荧光微球百分比×中性粒细胞百分比∕10,计算中性粒细胞数目。
1.2.4 肺组织HE染色对“1.2.2”中固定的肺组织进行常规透明、浸蜡、包埋后,切成5 μm厚的切片,依据HE染色试剂盒说明书处理组织,在光学显微镜下观察组织病理变化。
1.2.5 qRT-PCR检测肺组织NLRP3 mRNA、ASC mRNA表达于4℃冰箱中解冻“1.2.2”中冻存的肺组织后,用Trizol试剂盒抽提取总RNA,按逆转录试剂盒说明书将RNA逆转录互补DNA(cDNA)。然后使用RT-qPCR试剂盒(SYBR Green)和PCR仪进行扩增,共进行40个循环终止反应。NLRP3 mRNA、ASC mRNA以β-actin为内参基因,采用2-ΔΔCt法计算PNLRP3 mRNA、ASC mRNA相对表达量。引物序列见表1。
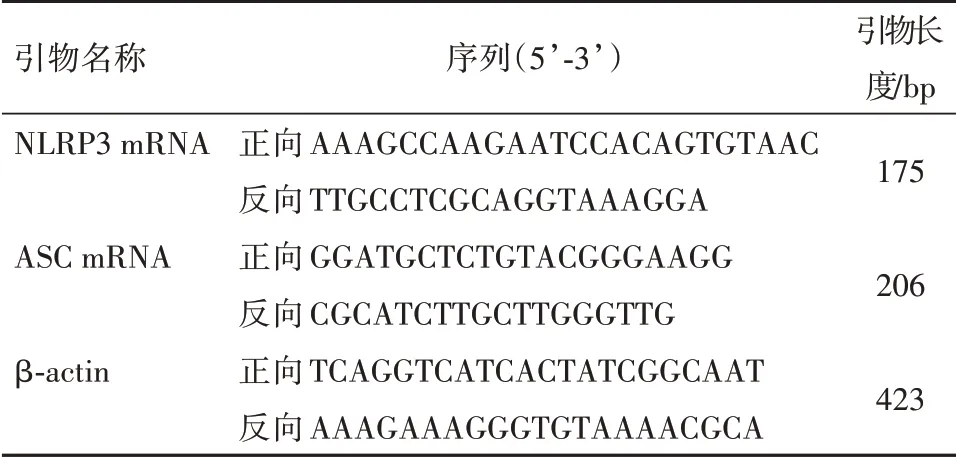
表1 q-RT-PCR引物序列
1.2.6 蛋白质印迹法检测肺组织NLRP3、ASCIL-6、caspase-1、IL-6、TNF-α蛋白相对表达水平用蛋白提取试剂盒提取“1.2.5”中剩余肺组织总蛋白,定量后,取50 μg蛋白上样,进行电泳和转膜,室温下用5%脱脂牛奶封闭1 h,加入NLRP3(1∶1 000)、ASCIL-6(1∶1 000)、caspase-1(1∶1 000)、TNF-α(1∶1 000)、IL-6(1∶1 000)、β-actin(1∶2 000)一抗,4℃孵育过夜,加入HRP羊抗兔二抗(1∶2 000),37℃孵育1 h,采用增强化学发光法显色,以凝胶成像仪观察条带并拍照,并以Image J软件分析蛋白表达。
1.3 统计学方法以SPSS 22.0软件进行统计分析,计量资料以±s表示,多组间比较行单因素方差分析,多组间两两比较行SNK-q检验,P<0.05,表示差异有统计学意义。
2 结果
2.1 各组小鼠一般行为变化正常组小鼠毛色、饮食活动均正常。模型组小鼠毛色失去光泽,饮食活动量均减少,活动后小鼠有喘息声,且小鼠有2只死亡。HHI低、高剂量组小鼠饮食活动量均较模型组有所增加,活动后喘息声有所减少,且试验过程中均无死亡。DDC组小鼠死亡4只,毛色枯槁,饮食活动减少及活动后喘息声最严重。
2.2 各组小鼠肺组织病理损伤检测结果正常对照组小鼠肺组织结构完整;模型组小鼠肺泡壁及间隔水肿、破坏、充血、炎症细胞浸润明显,肺泡腔有红细胞渗出;HHI低、高剂量组小鼠肺泡破坏、充血、炎症细胞浸润等病理损伤减轻,且HH高剂量组缓解效果优于低剂量组;DDC组肺泡破坏、充血、炎性浸润等病理现象最严重;HHI+DDC组肺泡病理损伤与模型组相近,见图1。
2.3 各组小鼠W/D、NLRP3 mRNA、ASCmRNA相对表达水平检测结果模型组与正常对照组相比,右肺组织W∕D、NLRP3 mRNA、ASCmRNA升高(P<0.05);HHI低、高剂量组与模型组相比,W∕D、NLRP3 mRNA、ASCmRNA降低(P<0.05),且有剂量依赖性;DDC组W∕D、NLRP3 mRNA、ASCmRNA升高(P<0.05);模型组与HHI+DDC组相比,W∕D、NLRP3 mRNA、ASCmRNA水平差异无统计学意义(P>0.05),见表2。
表2 各组小鼠W∕D、NLRP3 mRNA、ASCmRNA相对表达水平比较∕
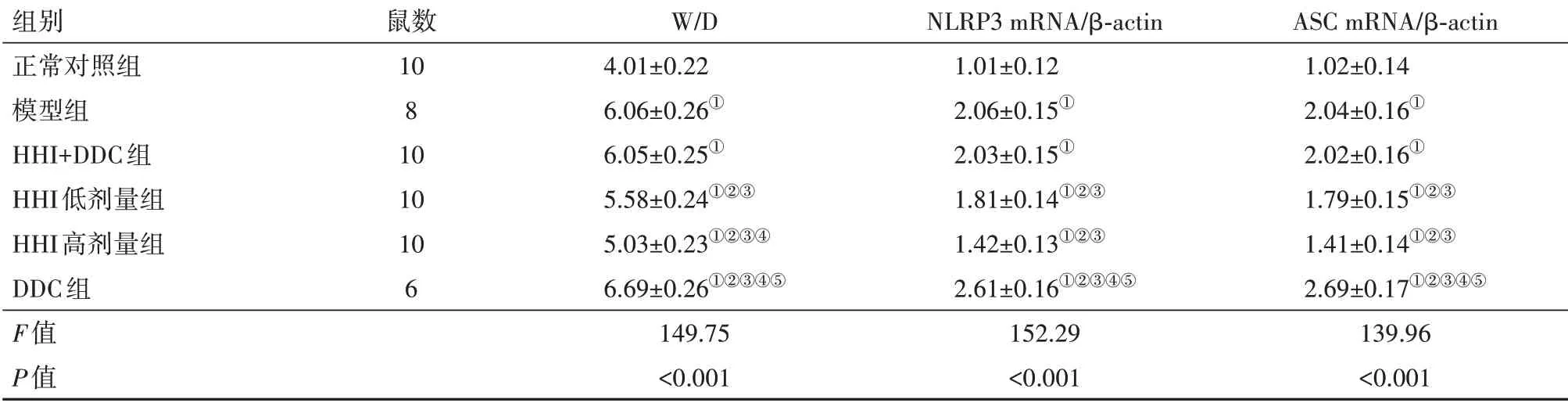
表2 各组小鼠W∕D、NLRP3 mRNA、ASCmRNA相对表达水平比较∕
注:HHI为鱼腥草注射液,DDC为二硫代氨基甲酸酯,W∕D为右肺湿重∕干重,NLRP3为NOD样受体热蛋白结构域3,ASC为凋亡相关斑点样蛋白,β-actin为β肌动蛋白。①与正常对照组比较,P<0.05。②与模型组比较,P<0.05。③与HHI+DDC组比较,P<0.05。④与HHI低剂量组比较,P<0.05。⑤与HHI高剂量组比较,P<0.05。
组别正常对照组模型组HHI+DDC组HHI低剂量组HHI高剂量组DDC组F值P值鼠数10 8 10 10 10 6 W∕D 4.01±0.22 6.06±0.26①6.05±0.25①5.58±0.24①②③5.03±0.23①②③④6.69±0.26①②③④⑤149.75<0.001 NLRP3 mRNA∕β-actin 1.01±0.12 2.06±0.15①2.03±0.15①1.81±0.14①②③1.42±0.13①②③2.61±0.16①②③④⑤152.29<0.001 ASC mRNA∕β-actin 1.02±0.14 2.04±0.16①2.02±0.16①1.79±0.15①②③1.41±0.14①②③2.69±0.17①②③④⑤139.96<0.001
2.4 各组小鼠BALF中IL-6、TNF-α水平及中性粒细胞数目检测结果模型组与正常对照组相比,IL-6、TNF-α水平及中性粒细胞数目增高(P<0.05);HHI低、高剂量组与模型组相比,IL-6、TNF-α水平及中性粒细胞数目下降(P<0.05),且有剂量依赖性;DDC组IL-6、TNF-α水平及中性粒细胞数目升高(P<0.05);HHI+DDC组与模型组相比,IL-6、TNF-α水平及中性粒细胞数目差异无统计学意义(P>0.05),见表3。
表3 各组小鼠BALF中IL-6、TNF-α含量及中性粒细胞数目比较

表3 各组小鼠BALF中IL-6、TNF-α含量及中性粒细胞数目比较
注:HHI为鱼腥草注射液,DDC为二硫代氨基甲酸酯,IL-6为白细胞介素-6,TNF-α为肿瘤坏死因子-α。①与正常对照组比较,P<0.05。②与模型组比较,P<0.05。③与HHI+DDC组比较,P<0.05。④与HHI低剂量组比较,P<0.05。⑤与HHI高剂量组比较,P<0.05。
组别正常对照组模型组HHI+DDC组HHI低剂量组HHI高剂量组DDC组F值P值鼠数5 5 5 5 5 5 IL-6∕(μg∕L)569.91±50.89 1 692.06±95.26①1 690.58±95.04①1 069.13±75.12①②③889.02±65.13①②③1 896.69±99.26①②③④⑤420.69<0.001 TNF-α∕(μg∕L)506.99±55.48 1 846.24±99.26①1 840.18±98.98①1 225.33±84.02①②③806.63±69.12①②③2 296.69±99.26①②③④⑤641.52<0.001中性粒细胞数目∕(×106个∕毫升)5.09±1.98 66.24±2.56①65.18±2.48①45.33±2.22①②③22.63±2.02①②③80.69±2.56①②③④⑤1 561.08<0.001
2.5 各组小鼠肺组织NLRP3、ASC、caspase-1、TNF-α、IL-6蛋白表达结果与正常对照组相比,模型组小鼠肺组织NLRP3、ASC、caspase-1、TNF-α、IL-6蛋白表达升高(P<0.05);与模型组相比,HHI低、高剂量组NLRP3、ASC、caspase-1、TNF-α、IL-6蛋白表达降低(P<0.05),且有剂量依赖性;DDC组小鼠肺组织NLRP3、ASC、caspase-1、TNF-α、IL-6蛋白表达增高(P<0.05);HHI+DDC组与模型组相比,NLRP3、ASC、caspase-1、TNF-α、IL-6蛋白表达差异无统计学意义(P>0.05),见表4,图2。
表4 各组小鼠肺组织NLRP3、ASC、caspase-1、TNF-α、IL-6蛋白表达比较

表4 各组小鼠肺组织NLRP3、ASC、caspase-1、TNF-α、IL-6蛋白表达比较
注:HHI为鱼腥草注射液,DDC为二硫代氨基甲酸酯,NLRP3为NOD样受体热蛋白结构域3,ASC为凋亡相关斑点样蛋白,caspase-1为胱天蛋白酶-1,IL-6为白细胞介素-6,TNF-α为肿瘤坏死因子-α,β-actin为β肌动蛋白。①与正常对照组比较,P<0.05。②与模型组比较,P<0.05。③与HHI+DDC组比较,P<0.05。④与HHI低剂量组比较,P<0.05。⑤与HHI高剂量组比较,P<0.05。
组别正常对照组模型组HHI+DDC组HHI低剂量组HHI高剂量组DDC组F值P值鼠数10 8 10 10 10 6 NLRP3∕β-actin 0.22±0.12 1.01±0.13①1.02±0.13①0.83±0.11①②③0.52±0.12①②③④1.31±0.13①②③④100.39<0.001 ASC∕β-actin 0.29±0.11 1.03±0.13①1.04±0.12①0.82±0.12①②③0.54±0.11①②③④1.39±0.13①②③④106.55<0.001 caspase-1∕β-actin 0.25±0.12 1.06±0.14①1.05±0.14①0.80±0.15①②③0.59±0.12①②③④1.37±0.12①②③④89.75<0.001 TNF-α∕β-actin 0.31±0.13 1.13±0.17①1.14±0.16①0.86±0.15①②③0.61±0.15①②③④1.43±0.13①②③④74.19<0.001 IL-6∕β-actin 0.32±0.13 1.16±0.17①1.15±0.16①0.85±0.15①②③0.62±0.14①②③④1.46±0.12①②③④80.38<0.001

图2 各组小鼠肺组织中NLRP3、ASC、caspase-1、TNF-α、IL-6蛋白表达免疫印迹图
3 讨论
肺炎发病率和死亡率较高,其病原体繁多且以细菌感染最为常见,而LPS是革兰阴性菌主要致病物质,可引起肺部细菌感染,使肺内中性粒细胞聚集和激活并产生炎症级联反应导致肺损伤[10]。雾化吸入LPS所致的动物肺部损伤及病理变化表现稳定,接近于临床急性肺炎发展情况[11]。本研究采用雾化吸入LPS方法建立小鼠急性肺炎模型,发现模型组小鼠毛色失去光泽,活动后喘息声明显且有死亡,肺组织W∕D、BALF中炎性细胞因子IL-6、TNF-α含量及中性粒细胞数目均明显高于正常对照组,HE染色可见肺泡破坏、充血、炎性细胞浸润等病理现象严重,与文献[7]研究模型小鼠吸入LPS 5 h后肺组织病理症状结果一致,提示小鼠急性肺炎模型造模成功。
近年来,由于抗生素、糖皮质激素以及免疫抑制剂的滥用、菌种变异和耐药性的出现,使西医抗生素治疗肺炎疗效变差,肺炎病人病死率逐渐升高[12]。中医认为细菌为“风热之邪”、侵袭人体并首先犯肺,使机体虚邪相合、痰瘀互阻、肺脏宣降功能异常而发病,且认为肺炎病性属热、病位在肺,属“风温””肺热”“咳嗽”等范畴,且用清热入肺药物来清热肃肺、豁痰止咳,达到良好的治疗效果[13-14]。鱼腥草味辛、性寒凉,归经为肺,能清热解毒、消肿疗疮,用治实热、热毒、湿邪、疾热为患的肺痈且为治肺臃要药,现代药理研究发现其具有较好的抗炎效果,有“中药抗生素”之称[15]。近来研究发现,鱼腥草可治疗肺热咳嗽、尿路感染等症,如杨宏志[16]发现鱼腥草为治热痰妙方-复方鲜竹沥的主要成分,能清热解毒,可助鲜竹沥清热,生半夏、枇杷叶化痰,证实鱼腥草清热化痰之功,然而其具体分子机制还不明确;岑凯莹、王海颖[17]发现鱼腥草中药提取物可降低肺炎支原体感染小鼠血清干扰素及炎性因子IL-6表达水平,证实鱼腥草具有较好的抗炎、抗菌效果;陈彤等[18]发现鱼腥草液对大肠埃希菌引起的尿路感染有较好的治疗作用,且对膀胱无过敏性损害,证实鱼腥草具较好的抑菌效果,但其抑菌作用的具体机制仍不明确。基于鱼腥草抗炎、抗菌、清肺热作用,本研究推测其注射液HHI对急性肺炎有较好的保护作用,并给予LPS诱导的急性肺炎小鼠HHI进行干预治疗,发现HHI低、高剂量组小鼠无死亡,活动后喘息声减少,肺泡壁破坏、充血、炎性浸润等病理损伤缓解,W∕D、IL-6、TNF-α含量、中性粒细胞数目均明显低于模型组,且HHI高剂量组上述肺组织炎性损伤指标改善效果优于低剂量组,提示HHI可改善LPS导致的急性肺炎小鼠肺组织炎性损伤,表明HHI对急性肺炎有一定治疗作用。但HHI治疗急性肺炎的具体分子生物学机制还不明确,本研究建立NLRP3炎症通路激动剂进行探究,具有一定的临床意义。
炎症反应是急性肺炎的病理基础,NLRP3、ASC、caspase-1共同组成炎症复合体,ASC可连接NLRP3与caspase-1,并能与NLRP3相互激活,NLRP3活化后可激活效应蛋白caspase-1,影响IL-6、IL-8等炎性因子表达,从而诱发一系列炎症反应,加速疾病的发展[19]。Madouri等[20]发现体内外激活caspase-1,NLRP3和ASC的表达,可有助于过敏性肺部炎性因子的上调,证实NLRP3∕caspase-1通路参与肺组织炎症反应过程。本研究发现模型组小鼠肺组织NLRP3 mRNA及蛋白、ASC mRNA及蛋白、caspase-1、IL-6、TNF-α蛋白表达均高于正常对照组,给予小鼠NLRP3通路激活剂DDC后,小鼠肺组织随着NLRP3、ASC基因及相关蛋白表达进一步增高后,小鼠喘息声加重,死亡只数进一步增加,肺泡破坏、充血、炎性细胞浸润最严重,肺组织炎症损伤相关指标也进一步加重,提示激活NLRP3∕caspase-1通路,可加重肺炎小鼠炎症反应和肺组织损伤。而随着HHI剂量升高,小鼠肺组织NLRP3∕caspase-1炎症通路及相关蛋白表达降低越明显,且HHI与DDC联用后,小鼠肺组织NLRP3∕caspase-1炎症通路及相关蛋白表达与HHI高剂量组相反,肺组炎症损伤增加,提示DDC可激活NLRP3∕caspase-1通路逆转HHI缓解肺炎小鼠肺组织炎性损伤,表明HHI可能通过抑制NLRP3∕caspase-1通路激活改善肺炎小鼠炎症反应,缓解肺损伤。
综上所述,HHI可通过抑制NLRP3∕caspase-1通路激活,改善肺炎小鼠炎症反应,缓解肺损伤,为急性肺炎的临床治疗提供理论依据。然而,NLRP3调控机制复杂,且中医药对肺炎的治疗具有多靶点的作用,HHI治疗急性肺炎的其他分子生物学机制待后续深入研究。
(本文图1见插图1-4)

图1 各组小鼠肺组织染色图(HE染色×200)
