烟酸促进短乳杆菌合成γ-氨基丁酸的机制
2023-01-05张健才恒申振豪刘仲浩赵娟张巧珍高强
张健 才恒 申振豪 刘仲浩 赵娟 张巧珍 高强
(1.天津科技大学生物工程学院,天津 300457;2.天津市工业微生物重点实验室,天津 300457;3.工业发酵微生物教育部重点实验室,天津 300457;4.天津科技大学现代分析技术研究中心,天津 300457;5.天津科技大学理学院,天津 300457)
γ-氨基丁酸(GABA)作为重要的抑制神经讯息传递的物质[1],能够参与人体内多种代谢过程,具有较高的生理活性[2-3]。短乳杆菌在发酵过程中产生乳酸,导致生长环境的pH值降低,从而抑制其生长[4]。为了抵抗酸胁迫,短乳杆菌形成了多种抗酸机制,常见的抗酸机制有谷氨酸脱羧酶(GAD)系统[5]、F0-F1-ATPase质子泵、精氨酸脱亚胺酶途径、生物胺产生系统[6]。GAD系统中,胞外的谷氨酸由转运蛋白GadC转运至胞内,并通过磷酸吡哆醛依赖的谷氨酸脱羧酶GadA或GadB脱羧生成GABA和二氧化碳,生成的GABA可由GadC转运到胞外。该过程消耗胞内H+,外排偏中性的GABA,可有效提高环境的pH值,帮助微生物抵御酸胁迫[7-8]。Lv等[9]通过筛选低F0-F1-ATPase活性的短乳杆菌,来提高GABA的产量,依据是使H+更多的通过GAD系统消耗。受此启发,我们设想抑制短乳杆菌生物胺产生系统,使H+更多的通过GAD系统消耗而提高GABA的产量。酪胺是生物胺的一种,短乳杆菌可以通过酪氨酸脱羧酶将酪氨酸脱羧生成碱性的酪胺来提高环境pH[10-11]。烟酸是酪氨酸脱羧酶的抑制剂[12],故本实验计划添加烟酸来抑制短乳杆菌发酵过程中酪胺的产生,弱化酪胺产生系统,使短乳杆菌更多地通过GAD系统来抵御酸胁迫,从而提高其GABA产量。该思路已经被前期实验验证,即在发酵中添加0.15%的烟酸确实能显著提高GABA的产量。为了阐明烟酸促进短乳杆菌合成GABA的作用机制,本研究采用液相色谱-质谱联用(LC-MS)的方法探究短乳杆菌添加和不添加烟酸发酵时的差异代谢物[13],分析烟酸对短乳杆菌代谢通路的影响,并采用碘化丙啶(PI)单染色法[14]分析了细胞膜的完整性,旨为发酵法生产GABA提供新的思路。
1 材料与方法
1.1 材料
1.1.1 菌种 短乳杆菌(Lactobacillus brevis)CGMCC 3414[15],本实验室分离保藏于中国微生物菌种保藏中心。
1.1.2 仪器与试剂 Agilent1200高效液相色谱仪(Angilent科技有限公司);色谱柱:ZORBAX SBC184.6 mm×250 mm,5 μm;高速台式离心机(上海安亭科学仪器厂);BX53正置荧光显微镜(日本Olympus);320-S型 pH 计(Mettler Toledo);LDZX-75KBS立式压力蒸汽灭菌锅(上海申安医疗器械厂);电子分析天平(Mettler Toledo);生化培养箱(广东省医疗器械厂);SBA-40C生物传感分析仪(山东省科学院生物研究所);AB Triple TOF 6600质谱仪(AB SCIEX);Agilent1290InfinityLC超高压液相色谱仪(Agilent);色谱柱:Waters,ACQUITY UPLC BEH Amide 1.7 μm,2.1 mm×100 mm。
乙腈(色谱纯,天津市科密欧化学试剂有限公司);乙酸铵(Sigma);谷氨酸钠(99%,红玫瑰味精);2,4-二硝基氟苯(DNFB,分析纯,Sigma公司);乙酸钠(分析纯,生工生物工程股份有限公司);酵母粉(分析纯,北京奥博生物技术有限公司);硫酸镁(分析纯,天津市北方天医化学试剂厂);硫酸锰(分析纯,天津市北方天医化学试剂厂);葡萄糖(分析纯,天津市化学试剂一厂);吐温-80(分析纯,天津市江天化工技术有限公司);烟酸(分析纯,天津市北方天医化学试剂厂)。衍生缓冲液:取碳酸钠4.2 g用超纯水定容至100 mL;衍生剂:0.1 mL DNFB用乙腈定容至50 mL;定容缓冲液:取磷酸氢二钾3.4 g溶于145.5 mL的0.1 mol/L的氢氧化钠溶液,超纯水定容至1 000 mL。
1.1.3 培养基 种子培养基:蛋白胨10 g/L,酵母粉5 g/L,葡萄糖10 g/L,乙酸钠2 g/L,硫酸锰0.05 g/L,硫酸镁0.2 g/L,吐温80 1 mL/L。
发酵培养基:葡萄糖30 g/L,酵母粉35 g/L,谷氨酸钠(MSG)50 g/L,硫酸亚铁0.05 g/L,硫酸镁0.2 g/L,硫酸铵2 g/L,pH 5.5。
1.2 方法
1.2.1 发酵过程中菌体生长、葡萄糖消耗和GABA合成 从甘油管中取100 μL菌液接于50 mL种子培养基中,在30℃、摇床转速50 r/min培养24 h 后,以5%(V/V)的接种量转接于下一级种子培养基中,30℃、静置培养12 h。将种子菌液以 5%(V/V)的接种量转接于50 mL发酵培养基中,发酵培养基中添加0.15 %烟酸的为实验组,不含烟酸的为对照组,在30℃静置培养72 h。在发酵过程中每6 h取1 mL菌液,稀释10倍后用分光光度计在600 nm下测定吸光度,计为OD600,反映菌体生长情况;然后将稀释10倍后的菌液8 000 r/min离心10 min取上清液,使用生物传感分析仪测量葡萄糖含量。另外,在发酵24 h、36 h、48 h、60 h和72 h时,各取1 mL发酵液,8 000 r/min离心10 min取上清,蒸馏水稀释10倍后取10 μL于1.5 mL离心管中,依次加入衍生缓冲液100 μL、衍生剂100 μL、定容缓冲液790 μL,振荡混匀,60℃水浴1 h。反应后用0.22 μm醋酸纤维膜过滤,用高效液相色谱仪测定GABA的产量[16]。
1.2.2 代谢组学样品的制备 取对数后期发酵液对照组和实验组各6组平行,通过分光光度计调到相同的OD600值,定容后在4℃下8 000 r/min离心10 min取菌体沉淀,快速用生理盐水在4℃下8 000 r/min离心10 min的条件下洗涤菌体两次得到菌体样本,加入预冷甲醇/乙腈/水溶液(2∶2∶1,V/V/V),涡旋混合,低温超声30 min,-20℃静置10 min,4℃下12 000 r/min离心20 min,取上清真空干燥,质谱分析时加入100 μL乙腈水溶液(乙腈∶水=1∶1,V/V)复溶,涡旋,4℃下12 000 r/min 离心15 min,取上清液进样分析[17]。
1.2.3 LC-MS中液相色谱条件 样品采用超高效液相色谱系统(ultra performance liquid chromatography,UPLC)HILIC色谱柱进行分离;柱温25℃;流速0.5 mL/min;进样量2 μL;流动相组成A:水+25 mmol/L乙酸铵+25 mmol/L氨水,B:乙腈;梯度洗脱程序如下:0-0.5 min,95% B;0.5-7 min,B从95%线性变化至65%;7-8 min,B从65%线性变化至40%;8-9 min,B维持在40%;9-9.1 min,B从40%线性变化至95%;9.1-12 min,B维持在95%;整个分析过程中样品置于4℃自动进样器中。为避免仪器检测信号波动而造成的影响,采用随机顺序进行样本的连续分析。样本队列中插入QC样品,用于监测和评价系统的稳定性及实验数据的可靠性[18]。
1.2.4 质谱条件 分别采用电喷雾电离正离子和负离子模式进行检测。ESI源条件如下:离子源温度600℃,喷雾电压(ion sapary voltage floating,ISVF)±5 500 V(正负两种模式);TOF MS扫描范围(m/z):60-1 000 Da,产物离子扫描范围(m/z):25-1 000 Da,TOF MS 扫描累积时间 0.20 s/spectra,产物离子扫描累积时间0.05 s/spectra;二级质谱采用information dependent acquisition(IDA)获得,并且采用高灵敏模式,Declustering potential(DP):±60 V(正负两种模式),碰撞能量Collision Energy:(35±15)eV。
1.2.5 数据分析 质谱结果通过标准品数据库(inhouse database(Shanghai Applied Protein Technology))中代谢物的保留时间、分子质量等信息进行匹配,对样本中的代谢物进行结构鉴定,并对鉴定结果进行严格核对。对实验检测到的代谢物结果进行预处理后,使用SIMCA软件(V15.0.2)进行数据分析。数据分析内容包括正交偏最小二乘判别分析(OPLSDA)等分析,在最大程度保留原始信息的基础上对采集的多维数据进行降维分析,然后进行差异代谢物筛选、差异代谢物相关性分析、KEGG 通路分析等内容[19]。
1.2.6 碘化丙啶单染色 细菌的细胞膜不完整时,碘化丙啶(propidium iodide,PI)能够通过细胞膜进入细胞与DNA结合,并且发出更亮的红色荧光,PI不能进入拥有完整细胞膜的胞内,用来检测细胞膜的完整性[20]。将发酵对数生长前期的实验组和对照组菌液的OD600调至0.8,PBS溶液清洗菌体3次并用PBS溶液悬浮菌体,加入PI使其终浓度为5 μg/mL,轻轻摇匀菌液在黑暗下静置15 min,最后吸取合适的菌液滴于载玻片上通过正置荧光显微镜观察来判定细胞膜的通透性和完整性。
2 结果
2.1 发酵过程中菌体生长、葡萄糖消耗和GABA合成
短乳杆菌发酵过程中的GABA产量如图1-A所示,培养48 h后,实验组(experimental group,EG)的GABA产量开始显著高于对照组(control group,CG),至72 h时实验组比对照组的GABA产量提高44%。发酵过程中菌体OD值(OD600)和葡萄糖含量的变化如图1-B所示,添加0.15%烟酸的实验组中菌体生长较之对照组明显减缓,相应的,发酵前24 h实验组中的葡萄糖消耗也更慢,但发酵30-42 h,实验组的葡萄糖消耗比对照组更多,此后实验组和对照组的葡萄糖消耗趋于一致。
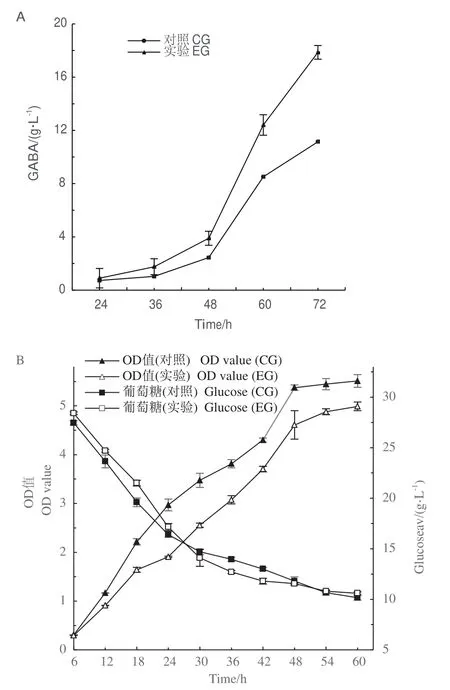
图1 实验组(烟酸)和对照组在不同发酵时间下的GABA产量、OD值和葡萄糖的变化Fig.1 Changes in GABA yield,OD and glucose in experimental groups(nicotinic acid)and control groups at different fermentation times
2.2 多变量统计分析
根据 OPLS-DA方法对数据进行分析,OPLS-DA是一种多因变量对多自变量的回归建模方法,最大特点是可以去除自变量和分类变量无关的异常值,根据得分图可以揭示数据离散程度,发现异常值。图2-A和图2-B显示的得分图上对照组和实验组的组间分别位于两侧,则两组间的代谢轮廓具有显著差异或者是差异代谢物物的含量具有显著性变化。
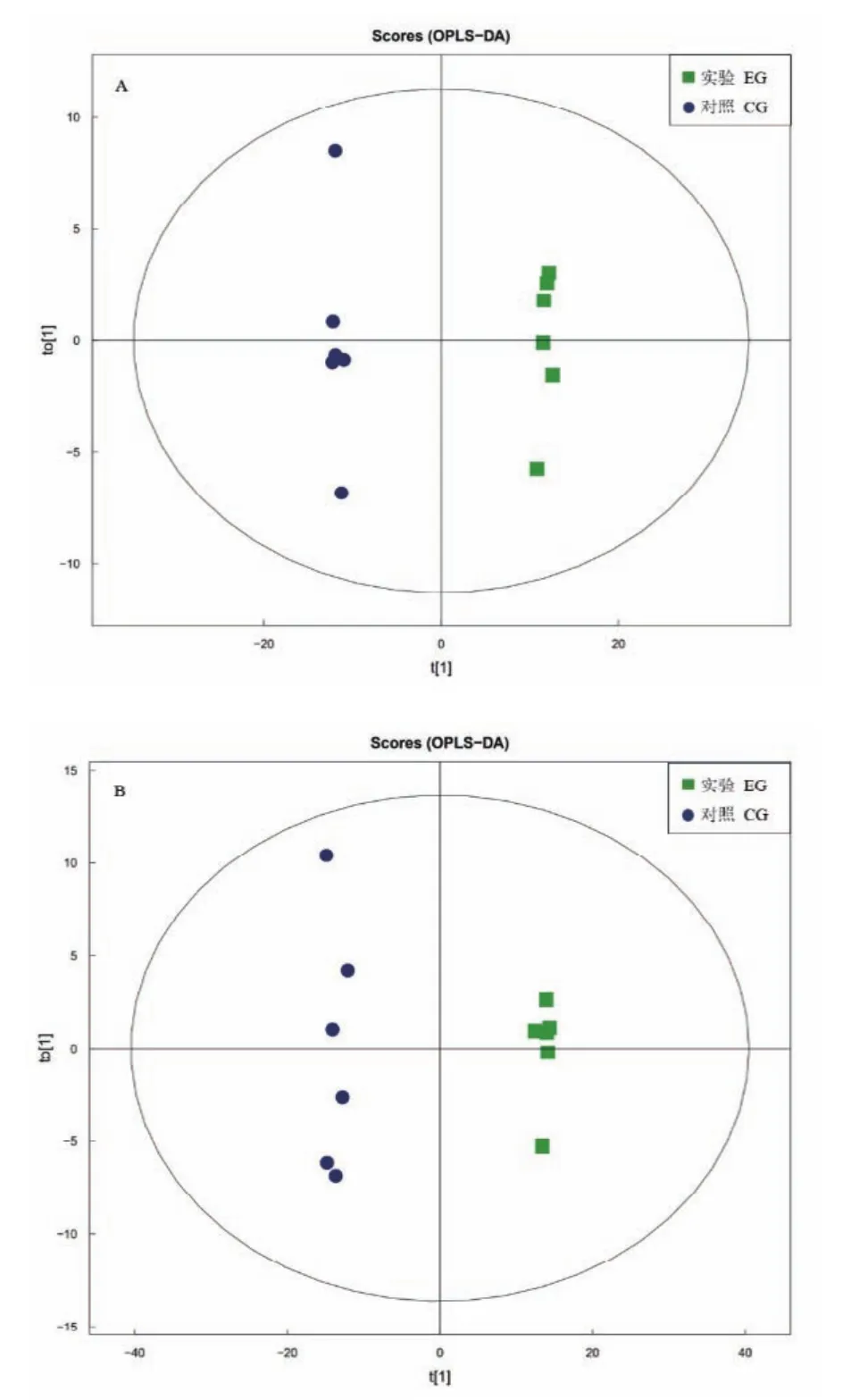
图2 正(A)负(B)离子模式OPLS-DA得分图Fig.2 OPLS-DA score of positive(A)and negative(B)ion mode
2.3 差异代谢物的筛选
正离子模式下鉴定的代谢物数量为204种,负离子模式下鉴定出120种代谢物,其中主要为氨基酸、脂质、有机酸及其衍生物,大量且丰富的代谢物数据有利于全面检测出代谢通路的变化。基于OPLS-DA模式下VIP>1筛选两组间差异代谢物,筛出两组间具有显著性的变量(P<0.05),通过HMDB和KEGG数据库比对,筛选出33个显著性差异代谢物如表1所示,其中调节趋势是根据实验组与对照组的差异代谢物含量的比值为依据(↑*:1-2;↑ **:2-5;↑ ***:>5;↓ *:0.6-0.9;↓ **:0.3-0.6;↓***:<0.3)。结果显示实验组中酪氨酸脱羧酶的产物酪胺含量显著降低,有关脂质代谢的十八碳二烯酸、二十二碳一烯酸、二十二碳二烯酸、20-羟二十烷四烯酸和棕榈油酰磷脂酰甘油等不饱和脂肪酸的含量均显著高于对照组,而对应的饱和脂肪酸中单棕榈酰甘油含量降低;氨基酸代谢中组脯氨酸、谷氨酸、组氨酸、天冬氨酸、丝氨酸和鸟氨酸的含量都是实验组显著高于对照组;实验组中与能量代谢有关的AMP和2-磷酸甘油酸含量均显著下降,证明了烟酸对菌体生长的抑制。
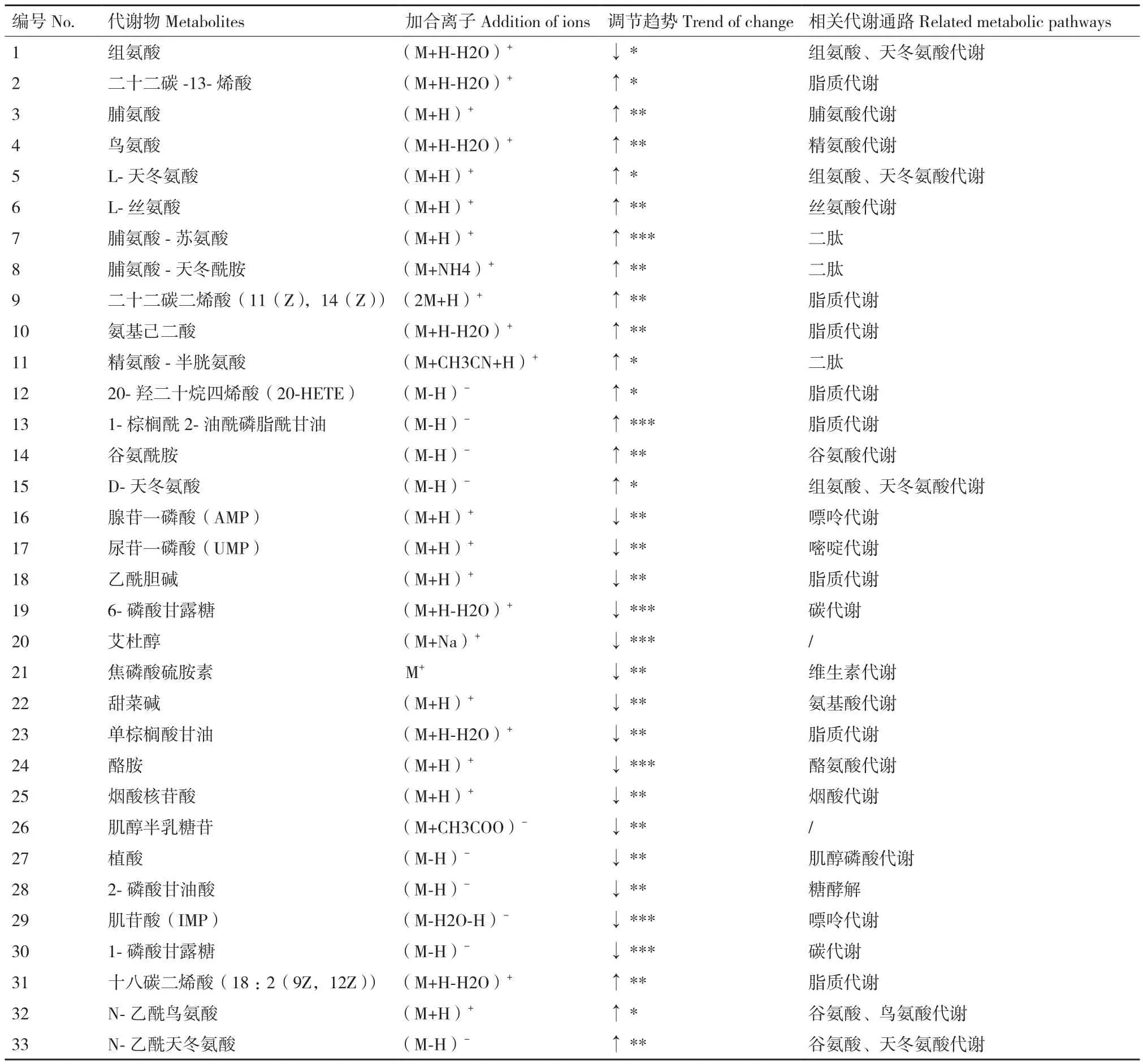
表1 正负离子模式下显著性差异代谢物物Table 1 Significant difference metabolites in positive and negative ion mode
2.4 碘化丙啶(PI)单染色结果
实验组和对照组对数生长前期的PI染色结果如图3所示,实验组中具有红色荧光的短乳杆菌细胞明显多于空白实验组中的细胞,说明实验组中短乳杆菌细胞膜的通透性显著高于对照组细胞。

图3 烟酸对短乳杆菌的细胞膜通透性和完整性影响Fig.3 Effect of nicotinic acid on cell membrane permeability and integrity of L.brevis
3 讨论
3.1 脂质代谢
脂质不仅是能量代谢产物,还是细胞膜的重要组成成分。细胞在经受环境胁迫时会调节饱和脂肪酸和不饱和脂肪酸的比例,来影响细胞膜通透性,当不饱和脂肪酸含量增多时细胞膜的通透性会加大[21-22]。代谢组学结果表明,实验组不饱和脂肪酸含量增加且饱和脂肪酸含量减少,暗示实验组细胞膜通透性增加,后续的PI染色结果证实了这一点。细胞膜的通透性增加,使得底物谷氨酸更容易进入胞内进行脱羧反应,同时生成的GABA也更易排出细胞。
3.2 氨基酸代谢
由于乳酸菌缺乏必要的生物代谢途径,不能合成生长所必需的氨基酸,乳酸菌必须从培养基中获得这些生物活性物质才能满足其快速生长需要。乳酸菌依靠胞外蛋白酶水解培养基中的蛋白质形成寡肽和氨基酸,这些水解产物通过转运系统进入细胞,最后由细胞内的各种肽酶裂解形成游离氨基酸供细胞合成代谢[23]。脯氨酸、谷氨酸、组氨酸、丝氨酸均是短乳杆菌的必需氨基酸,鸟氨酸和天冬氨酸能够通过谷氨酸代谢合成,属于短乳杆菌的非必需氨基酸。实验组中上述氨基酸含量均高于对照组,证明实验组中肽转运蛋白活性更强,或者胞内肽酶活性更强,或者细胞通透性增加导致胞内必需氨基酸含量增加。虽然胞内必需氨基酸增加,但是实验组的菌体生长更慢,显然是其它原因抑制了实验组菌体的生长。另外,实验组中酪胺含量的显著下降,证明胞内酪胺的合成受到抑制,烟酸对酪氨酸脱羧酶的抑制是有效的。
3.3 碳代谢
短乳杆菌是典型的兼性厌氧菌且进行异型乳酸发酵。1-磷酸甘露糖和6-磷酸甘露糖是核苷酸糖的主要来源,而核苷酸糖主要应用于细胞结构物质的合成,本研究中1-磷酸甘露糖和6-磷酸甘露糖的含量在添加烟酸后显著降低,说明在实验组代谢过程中核苷酸糖类合成较少,不利于细胞生长繁殖。焦磷酸硫胺素是丙酮酸脱氢酶的辅因子,在实验组中含量显著降低,可能会使丙酮酸脱氢酶的活性变低,减少乙酰CoA生成从而不利于脂肪酸的合成而影响细胞膜的形成。
3.4 其他差异代谢物
氨基己二酸是不饱和脂肪酸的氧化产物,实验组中其含量上升意味着细胞膜完整性遭到破坏。肌醇半乳糖苷是典型的抗逆物质与多种耐逆响应有关[24],甜菜碱是一种生物碱化学名称为N,N,N-三甲基甘氨酸,艾杜醇作为一种糖醇类物质,其两者作用与脯氨酸相似都能起到维持细胞渗透压的作用,甜菜碱和艾杜醇含量降低的原因是在生长过程中微生物会优先从外界转运能够维持渗透压的溶质[25];通过代谢通路分析发现烟酰胺只会单向合成烟酸,烟酸含量的增加可能会抑制烟酰胺产物的生成,从而抑制NAD+(烟酰胺腺嘌呤二核苷酸)的合成,导致烟酸核苷酸的含量降低,抑制多种脱氢酶的活性,进而抑制脂肪酸合成和菌体生长。植酸是一种非离子表面活性剂,当积累在细胞膜表面可以改善通透性[26],实验组中植酸含量降低可能是因为细胞膜的完整性受到破坏。
短乳杆菌发酵中添加烟酸能显著提高GABA的产量,但烟酸促进短乳杆菌GABA合成的机制未知。利用非靶标代谢组学可以无偏向性地分析短乳杆菌发酵后尽可能多的代谢产物,通过分析添加烟酸与不添加烟酸发酵后的差异代谢物,可能从全局角度理解烟酸促进短乳杆菌GABA合成机制,将会对GABA的生物合成提供理论基础和新的思路。
4 结论
本研究利用LC-MS非靶向代谢组学方法分析了添加烟酸和不添加烟酸时,短乳杆菌细胞内的差异代谢物。得到的33种具有显著性差异的代谢物能够看出添加烟酸后,酪胺和核苷酸糖的含量减少的同时,不饱和脂肪酸含量增加。通过PI单染色实验,发现添加烟酸后的短乳杆菌细胞膜的通透性显著高于不添加烟酸的对照组。