大麦Thionin-like基因家族基因表达谱分析
2023-01-05杨宏亮袁桢钱徐佳志徐大伟
杨宏亮 袁桢 钱徐佳志 徐大伟
(安徽农业大学农学院,合肥 230036)
大麦(Hordeum vulgare L.)是世界上第四大禾谷类作物,具有如食用、饲用、酿造、药用等广泛的用途[1]。大麦是一种抗逆性较强的作物,生长环境很广,而且具有春、冬生长习性,中国南北各地都有栽培,是世界上最古老的种植作物之一[2-4]。当植物自然抵抗病原体时,它们会产生小的富含半胱氨酸的抗菌肽 AMP(antimicrobial peptides)[5]。它们是植物先天防御系统的重要组成部分,可在植物受到害虫侵袭时保护植物以将其损害降至最低[6-7],这些抗菌肽里面就包括硫素。硫素是一类分子量比较小,富含硫的蛋白,一般为5 000 Da,所有的硫素在其氨基端的第三、四位置的残基都是由两个保守的半胱氨酸组成[8]。
硫素广泛存在于各种植物中,例如在禾本科、桑寄生科和十字花科植物包括拟南芥等[8]。类硫素基因的发现源于对拟南芥基因组序列的检测。在拟南芥中发现,除了4个硫素基因外,还有一些类硫素基因,这些基因在其他物种中也有发现[9]。这些基因因其基因组较小而未被注释,大部分也未在基因芯片中富集到,所以关于其表达和在植物中的功能尚不清楚。前人研究发现,类硫素蛋白更类似于硫素蛋白的酸性结构域,而不是硫素结构域[9]。类硫素基因可以诱导甜菜孢囊线虫合胞体的表达,调节其他基因的表达,并增强植物对疾病的抗性[10]。Thil肽可以在辣椒果实中表达,对细菌、酵母菌和丝状真菌具有很强的抗菌活性,并诱导程序性死亡[11-12]。
为了研究大麦中类硫素的生物学功能、表达模式和蛋白结构,通过比较单、双子叶模式植物水稻和拟南芥基因组的类硫素来鉴定大麦中的类硫素基因组成,通过生物信息学预测他们在植物生长发育和逆境响应中的作用。本研究共鉴定出7个大麦类硫素基因,进化树分析其与其它物种中的类硫素基因都非常保守,进一步研究其在大麦中的序列组成及基因结构、染色体分布、蛋白保守结构域、系统进化树和表达谱分析,为后续分析类硫素基因的生物学功能提供理论依据。
1 材料与方法
1.1 材料
Golden Promise大麦品种在安徽省合肥市安徽农业大学(31.85°N,117.26°E)室外常温(15-25℃)下栽培。2021年3月初种子发芽于培养箱,随后将幼苗转移到盆中。从大麦的成熟根、茎、叶、幼苗以及穗部采集的组织样品用铝箔包裹并浸入液氮中,所有收获的样品都储存在-80℃冰箱。
1.2 方法
1.2.1 大麦Thil家族候选基因的筛选及理化性质分析 从拟南芥信息资源数据库TAIR(http://www.aabidopsis.org/)下载了 9 个拟南芥Thil蛋白的序列,从水稻基因组注释项目RGAP(http://rice.plantbiology.msu.edu/index.shtml)下载了 10 个水稻Thil 蛋白的序列。利用大麦Morex的基因组鉴定了大麦Thil假释基因,基因组注释文件Morex.v1来源于 phytozome(https://phytozome-next.jgi.doe.gov/)。使用 HMMER(https://www.ebi.ac.uk/Tools/hmmer/) 网站将拟南芥和水稻Thil基因与大麦基因组进行比对,并设定阈值E-value < 10-5,筛选得到大麦基因组中Thil家族候选基因。利用ExPASy(https://web.expasy.org/protparam/)在线软件对大麦类硫素蛋白的分子质量、氨基酸长度和等电点进行分析。
1.2.2 系统进化树的构建、基因结构及保守结构域序列分析 将拟南芥、水稻和大麦的蛋白质序列进行整合,进行多重序列比对,使用MEGA-X(https://www.megasoftware.net/)软件,采用邻位相连方法(neighbor-joining method),Bootstrap值设置为500,构建基因家族系统进化树。使用MEME工具(https://meme-suite.org/meme/tools/meme)预测大麦的Thil蛋白质序列中的保守功能结构域。根据Thil基因的CDS序列和DNA基因组序列,利用TBtools v1.082(https://doi.org/10.1016/j.molp.2020.06.009)软件[9]分析其基因结构并进行结果可视化处理。
1.2.3 Thil基因在大麦染色体上的分布 从 Ensembl Plants(https://plants.ensembl.org/index.html) 数 据 库中获取基因在染色体上的位点信息,利用TBtools绘制染色体定位图。
1.2.4 RNA提取和RT-qPCR(quantitative real-time PCR)分析 使用RNA提取试剂盒TRNzol(美国Invitrogen公司)提取根、叶、茎、幼叶和种子的RNA,通过琼脂糖凝胶电泳和 NanoDrop 1000 分光光度计(美国Thermo Fisher Scientific公司)分析 RNA的质量和浓度。反转录时利用RNase-free DNase I(大连宝生物工程有限责任公司)去除DNA污染,使用 M-MLV 逆转录酶(莫纳生物科技有限公司)从1 μg 总 RNA 生成第一链 cDNA。根据每个基因的序列设计跨内含子的引物,使用Primer 5 软件生成得分最高的,靠近基因上游的正反向引物用于荧光定量PCR扩增实验。用于RT-qPCR分析的特异性引物列于表1中。反应在含有SYBR mix(翌圣生物科技股份有限公司)10 μL、cDNA 2 μL、特异性PCR引物 2 μL、超纯水6 μL的 20 μL反应体系中进行。使用荧光定量PCR仪(瑞士罗氏公司LightCycler 96)进行荧光定量PCR实验。运行方案如下,94℃3 min,94℃ 30 s、58℃ 30 s、72℃ 30 s 40 个循环,72℃ 5 min。Ct 值由 Roche软件以默认设置确定。使用2-ΔΔCt方法确定Thils基因的相对表达水平。每个样品用3个生物学重复与3个统计学重复进行PCR。

表1 qRT-PCR引物序列Table 1 Sequences of qRT-PCR primers
1.2.5 基因克隆与亚细胞定位实验 Thil基因的引物对是根据蛋白质编码区CDS(coding sequence)序列设计的(表2),引物两端分别加上Bgl II和Spe I酶切位点。大麦的 cDNA 用作每个基因的模板。PCR扩增采用Vazyme Super-Fidelity DNA Polymerase(南京诺唯赞生物科技股份有限公司)的高保真酶。PCR实验步骤如下,98℃ 5 min;98℃ 30 s,55℃15 s,58℃ 30 s共36个循环;72℃ 10 min。PCR程序完成后,将PCR产物纯化,送公司测序(生工生物工程股份有限公司)。载体pCAMBIA1301-eGFP用限制性内切酶Bgl II和Spe I(纽英伦生物技术北京有限公司)。In-Fusion Cloning 使用 Monad Single Assembly Cloning Mix(莫纳生物科技有限公司)进行,将Thil基因与双酶切空质粒连接,转入大肠杆菌DH5α感受态细胞中(上海唯地生物有限公司)进行阳性克隆鉴定,得到阳性菌落质粒,转入农杆菌GV3101感受态细胞中(生工生物工程股份有限公司)。引物由生工生物技术公司合成(表2),成功构建的载体转化农杆菌。烟草在培养箱中培养到3-4片叶子时期,进行烟草叶片侵染48 h后,在共聚物激光显微镜下观察亚细胞定位结果。

表2 Thil基因克隆引物序列Table 2 Primer sequences for Thil gene cloning
2 结果
2.1 大麦Thil基因家族成员的鉴定
经过比对筛选,最终获得了7个Thil基因。根据该基因家族理化性质的预测结果,分析了它们的理化性质,如表3所示,ThiL基因编码蛋白长度从227(ThiL2)到414(ThiL5)个氨基酸,蛋白分子量在18.53 kD(Thil2)-34.23 kD(Thil5),等电点为5.20(Thil4)-5.31(Thil3)。
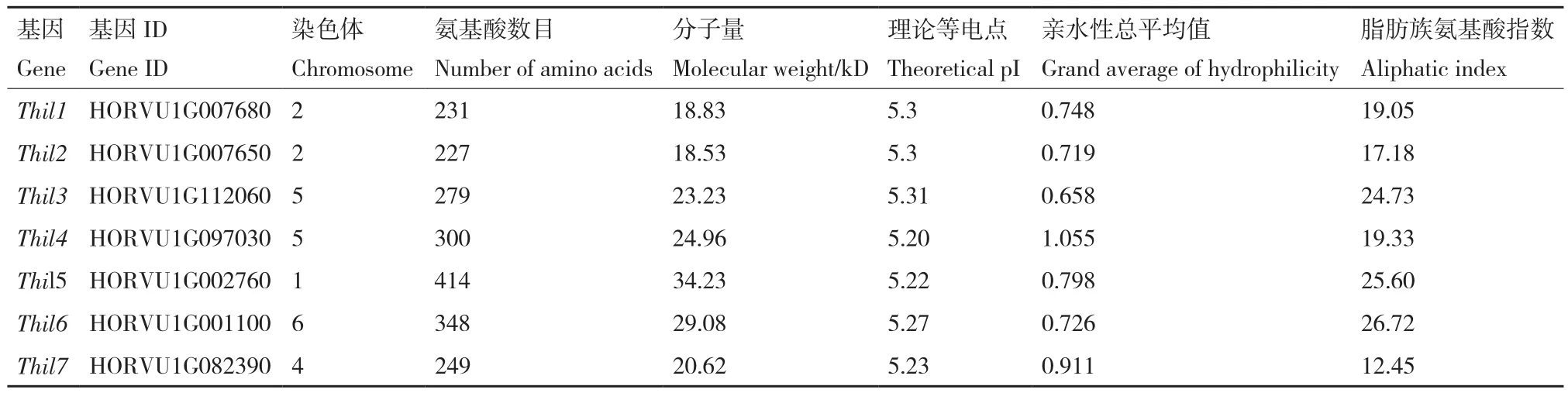
表3 大麦类硫素基因家族成员的基因信息Table 3 Basic information of Thil family genes from barley
2.2 系统进化树的构建、基因结构及保守结构域序列分析
为了研究Thil基因家族成员之间的进化关系,通过比较分析了Thil基因的结构,预测了Thil蛋白结构多样性,进一步构建系统发育树和内含子/外显子结构图。Thil家族的保守结构与序列分析结果显示,相同分支的基因结构相似性高,而不同的分支的基因结构相似性低。如图1所示,Thil1、Thil2、Thil4和Thil5有1-3个内含子和外显子,但Thil6和Thil7只有一个外显子和一个非翻译区(UTR),而Thil3只有一个外显子。在图1中可以看到Thil1、Thil2、Thil7位于同一支,基本上两端都是非翻译区,中间包含一个或两个编码区,Thil3和Thil6都是编码区在前,Thil4的非编码区是所有基因里总和最长的,Thil5与Thil1、Thil2、Thil7类似,但是它在非编码区中包含了3个编码区。

图1 大麦Thil家族基因结构和基因蛋白保守基序的预测Fig.1 Prediction of gene structure and protein conservative motifs of Thil family in barley
MEME分析结果(图2)显示,大麦Thil基因家族基序的结构,从上到下依次为motif 1、motif 2、motif 3、motif 4,motif 3是大麦Thil家族最保守的基序,除Thil4外,所有的基因都含有同一个motif3。以上结果表明,Thil基因家族主要是以LLLL*LV(*指一个或多个随机的氨基酸)为特征结构域。

图2 大麦Thil基因家族基序的结构Fig.2 Motif structure of the Thil gene family in barley
此外,为了探讨不同物种Thil基因之间的进化关系,对不同植物(包括拟南芥、大麦和水稻)的Thil蛋白进行了系统进化树分析。其中使用9条拟南芥的氨基酸序列、10条水稻的氨基酸序列和7条大麦的氨基酸序列构建进化树,进行亚家族的分类。系统分析Thil基因家族,可以分为四大类,即I-IV组(图3)。I组是最大的亚家族,由ThiL1、ThiL2、ThiL4、ThiL7组成,它们中ThiL4可以被单独拿出来分为一组,因为它的内含子和外显子结构与基序和另外3个并不一样,但是它与其他3个的位置较为靠近,所以划分为一组,另外的3个基因,在基因结构上表现最为一致,都有motif 2和motif 3基序,可能功能作用也比较相近。II组中仅存在双子叶植物拟南芥,没有另外两个物种的,这可能与该家族进化过程中的功能分化有关。III组中有ThiL3和ThiL6两个基因,它们共同含有motif 1、motif 3、motif 4三个保守基序,motif 4也只出现在这一组中,其功能可能与其他基因有所不同。IV组中只有一个大麦ThiL5基因,他的基因结构中表现出与其他基因不同的现象,它的外显子区域更多,而保守基序只有一个最保守的motif 3。
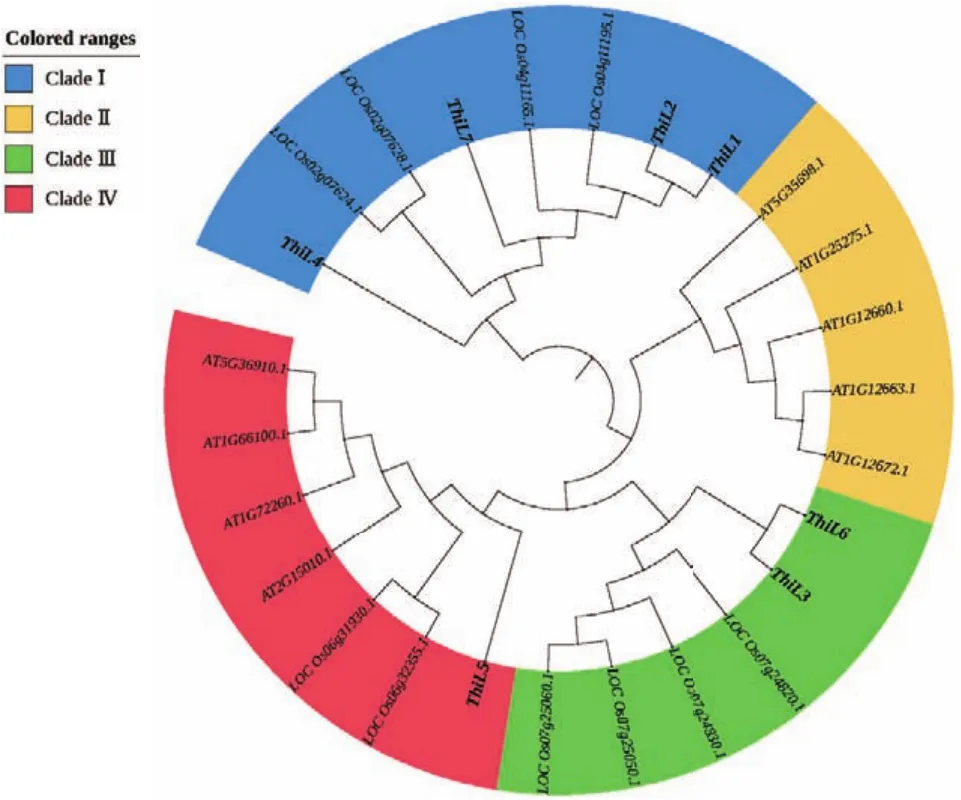
图3 Thil基因家族的系统进化树Fig.3 Phylogenetic tree of Thil gene family
2.3 基因在染色体上的位置
根据大麦基因组提供的染色体位置信息,绘制其染色体定位模式图,结果(图4)表明,7个Thils定位到大麦的5条染色体上且分布不均,其中2号染色体和5号染色体的Thil基因数量最多,而1号染色体、4号染色体和6号染色体的Thil基因数量均只有1个。

图4 Thil基因在染色体上的的分布Fig.4 Chromosome distribution of Thil genes
2.4 Thil家族基因启动子元件分析
利用Tbtools软件提取大麦Thil基因结构上游2 000 bp启动子序列,Plant Cis-Acting Regulatory Element在线网站中进行顺式作用元件预测(https://bioinformatics.psb.ugent.be/webtools/plantcare/html/)。结果(图5)显示,大麦7个Thil基因,家族成员含有丰富的顺式作用元件种类,图5中颜色越深表示响应程度越来越高,主要包括生长素(TGA-element和 GARE-motif)、赤霉素(TATC-box)、水杨酸(TCA-element)、脱落酸(ABRE)、茉莉酸甲酯(CGTCA-motif和TGACG-motif)、玉米醇溶蛋白(O2-site)等激素响应相关的调控元件,以及厌氧(ARE)、光 响 应(ATC-motif、TCT-motif、G-box、GT1-motif、Sp1、MRE和 Box 4)、低温(LTR)、干旱(MBS)等胁迫相应相关的调控元件,可能与参与大麦抗逆有关。

图5 Thil基因顺式作用元件Fig.5 Cis-acting element analysis of Thil genes
2.5 大麦Thil基因的表达模式分析
本研究检测了Thil基因在大麦的根、叶、茎、幼叶和种子中的表达水平(图6)。qPCR结果可以看出,Thil3基因在叶中高表达,Thil1在茎中高度表达,Thil2在幼苗中高度表达,其他基因的表达量相对较低。
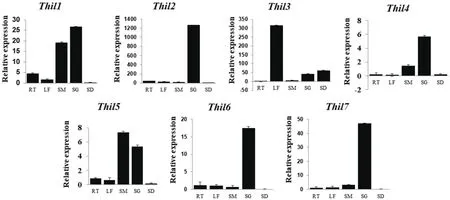
图6 不同组织中Thil基因的表达水平Fig.6 Expression levels of Thil gene in different barley tissues
2.6 Thil基因在大麦中的亚细胞定位
为了分析大麦中不同Thil蛋白之间的功能是否存在差异,我们利用Thil融合蛋白在烟草异源表达,并利用共聚焦显微镜观察Thil蛋白在烟草中的亚细胞定位。其中Thil1和Thil2定位于烟草的细胞膜和细胞核上,Thil3和Thil7定位于细胞膜上,Thil6定位于叶绿体中(图7)。
图7 Thil在亚细烟草中的亚细胞定位分析Fig.7 Subcellular localization of Thil in barley
3 讨论
Thil基因是一类分子量较小并且富含半胱氨酸的蛋白,它可能参与细胞防御机制和程序性细胞死亡,这两种机制都已在辣椒(Capsicum annuum L.)和炭疽之间的相互作用中得到报道[13]。硫蛋白是植物防御的重要组成部分,可应对入侵的病原体,并具有针对各种植物病原体的体外抗菌活性[14-16]。硫蛋白前原蛋白包含一个信号肽、成熟硫蛋白和一个酸性结构域[8],成熟的硫素是具有抗菌活性的部分,而酸性结构域的适当功能尚不清楚[17],目前大麦中Thil 基因家族的研究尚未见报道。本研究基于大麦基因组,运用生物信息学手段,筛选并分析大麦Thil 基因家族成员的理化性质、基因结构、保守基序、进化关系及组织表达和烟草亚细胞定位的结果等信息,丰富了植物Thil基因家族种类研究,也为进一步研究大麦Thil基因提供了理论依据。在本研究中,在大麦基因组中鉴定了7个Thil基因家族成员,一个基因家族的典型进化印迹与内含子/外显子结构以及内含子的类型和数量有关[18],因此它们被分为4个亚组,这与水稻和拟南芥中的亚组分类相似[9]。
大约 94% 的拟南芥 CRP(cysteine-rich peptides)基因缺乏内含子或只含有单个内含子,该内含子通常位于编码信号肽和成熟肽的外显子之间[19]。通过Thil 基因结构分析显示,本研究的 7个Thil基因中有4个存在内含子。发现来自不同植物科的硫素基因在酸性结构域内有两个小内含子[20],类似地在Thil 基因中内含子/外显子结构模式也存在于大麦中。
前人研究发现,Thil基因与植物的保护和防御机制有一定的关系,本研究发现Thil基因一般在幼叶中表达并且茉莉酸甲酯响应元件数量最多。在刚发芽时植株需要强有力的保护来适应新的环境,这样才能更好地成长,而茉莉酸甲酯广泛地存在于植物体中,能够激发防御植物基因的表达,诱导植物的化学防御,产生与机械损伤和昆虫取食相似的效果[21],这与先前研究的保护和防御机制相对应。
大麦中不同Thil蛋白之间的定位也存在差异,Thil1和Thil2定位于烟草的细胞膜、细胞核、细胞质上,Thil3和Thil7定位于细胞膜上,Thil6定位于叶绿体中,说明不同的成员之间在进化过程中分别参与了植物不同的发育学过程。
4 结论
Thil基因与植物的保护和防御机制有关,在幼叶中能够激发植物保护机制的元件响应最多,在RT-qPCR中可以看到Thil基因在幼叶中的表达量最高,在亚细胞定位中可以发现相同的成员之间在进化过程中分别参与了植物不同的发育学过程。
