锌指E 盒结合同源盒1 通过抑制sirtuin3 影响结肠癌细胞能量代谢和转移复发的机制
2023-01-05严冰冰吴华星韩嘉晟袁胜春
严冰冰 吴华星 韩嘉晟 袁胜春*
结肠癌是一种消化道恶性肿瘤,其发病率在全球肿瘤中排第三位,已成为肿瘤中的第二大死亡原因。尽管在结肠癌的诊断和治疗方面已取得重大进展,但该疾病的5 年生存率仍保持在6%左右[1]。目前,临床上治疗结肠癌的方法以手术切除、化疗、放疗为主,但这些方法不足以完全跟治结肠癌[2],因此,在基因层面探究结肠癌的发病机制以进一步找寻生物疗法至关重要。
上皮-间质转化(EMT)是一种形态学上的细胞程序,其定义为从上皮状态到间充质状态的表型转化。上皮状态被认为是稳定的并且能够定殖,而间充质表型被认为是亚稳态的。长期以来,EMT 一直被认为是导致癌细胞转移的重要因素[3]。EMT 由涉及表观遗传修饰和转录控制的复杂调控网络调控[4]。锌指E 盒结合的同源盒蛋白1(ZEB1)是EMT 的重要调节剂,在调节恶性肿瘤转移方面起着至关重要的作用[5]。ZEB1 还参与结肠癌细胞基质相关特性的调节。此外,据报道ZEB1 可以调节结肠癌的遗传毒性反应和耐药性,并且是改善化疗耐药性的重要目标。ZEB1 是维持结肠癌细胞恶性特性的重要因素。
近年来,异常的癌细胞代谢在肿瘤发生和癌症进展中的功能受到越来越多的关注[6]。实体瘤细胞位于微环境中,其特征是致密的基质和有限的血管系统,导致严重的缺氧状况。为了在如此恶劣的环境下生存,癌细胞必须改变其代谢模式[7]。通过改变其代谢程序,癌细胞可以使用有限的氧气和营养供应来满足不受控制的增殖和转移需求。与正常细胞获取能量的方式不同,癌细胞依靠糖酵解途径。从三磷酸腺苷(ATP)的产生方面来看,效率并不高,但通过糖酵解,癌细胞将葡萄糖分解为小分子,以合成其他大分子[8]。此外,糖酵解产生的乳酸产生了酸性微环境,导致细胞外基质破坏,从而提供了转移优势[9]。糖酵解是通过一系列酶促反应将葡萄糖降解成丙酮酸并伴有ATP 生成的过程,一些糖酵解酶如乳酸脱氢酶和丙酮酸激酶在癌细胞转移和EMT 中起着至关重要的作用[10-11]。然而,很少报道EMT 调节剂对糖酵解的影响。
SIRT3 是一种肿瘤抑制因子,定位于线粒体,具有很强的脱乙酰酶活性,可通过多种途径抑制糖酵解。SIRT3 会脱乙酰化并激活与氧化应激有关的细胞反应中涉及的几种酶,以及调节线粒体代谢的酶,例如异柠檬酸脱氢酶(IDH)或线粒体呼吸链复合物。最近的研究表明,SIRT3 在调节线粒体的数量和质量方面也起着至关重要的作用,间接影响与线粒体稳态有关的基因,例如PGC-1α、TFAM 或与线粒体动力学相关的蛋白质[12]。先前研究表明,SIRT3 沉默可增加机体氧化应激反应并导致线粒体功能障碍,使乳腺癌和结肠癌细胞对细胞毒性治疗敏感[13-14]。本研究就ZEB1 通过抑制sirtuin3 影响结肠癌细胞能量代谢和转移复发的机制进行分析。现报道如下。
1 材料与方法
1.1 细胞培养
人结肠癌细胞系SW620 获自美国典型培养物保藏中心。在含有胎牛血清(FBS)的Dulbecco 改良版Eagle 培养基(DMEM)中培养SW620 细胞,最终浓度为10%。
1.2 稳定的敲低细胞系的产生
为了沉默结肠癌细胞中ZEB1 的表达,使用pLKO.1 TRC 克隆载体(Addgene plasmid 10878)[15]针对ZEB1 目标基因进行转染(21 bp,正向:5’-CCTCTCTGAAAAA AGAACACATTA-3’,反向:5’-GCTGTTGTTCTGCCAACAGTT-3’)。通过慢病毒包装载体psPAX2 和pMD2.G 以4∶3∶1 的比例共同转染pLKO.1-ZEB1 构建体来产生慢病毒颗粒。通过用慢病毒感染靶细胞,然后选择嘌呤霉素来产生稳定的细胞系。通过实时定量聚合酶链反应(RT-PCR)和蛋白质印迹法测量沉默效率。
1.3 RT-PCR
使用TRIzol 试剂(Invitrogen)提取RNA,并使用PrimeScript RT 试剂盒(TaKaRa)进行反转录获得cDNA。通过RT-PCR 确定指定基因和内参基因β-actin 的表达状态。所有反应重复3 次。引物序列如表1 所示。

表1 引物序列
1.4 蛋白质印迹法
结肠癌细胞用冰冷的磷酸盐缓冲溶液(PBS)洗涤两次,并在RIPA 缓冲液中裂解10 min,然后超声处理以确保完全裂解。在4 ℃下,10 000 g 离心20 min去除细胞碎片。将全细胞裂解液(20 μg)在十二烷基硫酸钠(SDS)上样缓冲液中进行变性,然后进行SDS-PAGE,分离胶浓度为10%。将样品转移到膜上,随后用特异性抗体进行蛋白印迹。ZEB1、SIRT3 和β-actin 抗体购自北京索莱宝科技有限公司。
1.5 细胞外酸化和耗氧率测量
为了评估ZEB1 对结肠癌细胞的糖酵解能力和线粒体呼吸的影响,按照Seahorse XF 糖酵解压力测试试剂盒和Cell Mito 压力测试试剂盒的说明,使用Seahorse Bioscience XF96 细胞外通量分析仪测量细胞外酸化率(ECAR)和耗氧率(OCR),以分析细胞代谢变化。
1.6 活性氧(ROS)产生分析
为了评估ZEB1 和SIRT3 对结肠癌细胞中ROS产生的影响,使用了Beyotime 活性氧检测试剂盒(北京索莱宝科技有限公司)。使用可渗透细胞的荧光探针2',7'-二氯二氢荧光素二乙酸酯(DCF-DA)标记活细胞内的ROS。DCF-DA 扩散到细胞中后,通过细胞酯酶将其脱乙酰基化为非荧光化合物,并被ROS 迅速氧化为DCF。DCF 具有高度荧光性,可以通过细胞仪检测。荧光强度与细胞内的ROS 水平正比。
1.7 线粒体膜电位测量
使用带有JC-1 染料的线粒体膜电位测定试剂盒(Beyotime)测量细胞膜电位。JC-1 在线粒体中显示出电位依赖性积累,在正常线粒体的基质中可以聚集,在膜电位降低的线粒体中则无法聚集,JC-1单体发出绿色荧光(529 nm),JC-1 聚合物发出红色荧光(590 nm),通过红色/绿色荧光强度比率可以反映线粒体膜电位。
1.8 双重荧光素酶测定
为了评估ZEB1 对SIRT3 启动子活性的影响,使用了双荧光素酶检测试剂盒(Promega)。从SW620细胞的基因组DNA 中扩增SIRT3 启动子,并连接到pGL3-Basic 载体中以产生pGL3-SIRT3 构建体。用海肾荧光素酶载体将pGL3-SIRT3 转染到结肠癌细胞中。用双荧光素酶测定试剂盒评估ZEB1 对SIRT3启动子活性的影响。
1.9 芯片分析
为了测试ZEB1 是否占据了SIRT3 启动子区域,进行了染色质免疫沉淀(ChIP)分析。使用甲醛处理细胞,使蛋白质与DNA 交联;之后使用超声波将染色质打断为一定大小;通过抗体沉淀蛋白-DNA交联复合体;解除交联,纯化DNA,用PCR 实时定量检测DNA 含量。ChIP 分析是使用EZ ChIP 试剂盒(Millipore)和 ZEB1 抗体(Cell Signaling Technologies)进行的。用于检测与ZEB1 结合的SIRT3 启动子的引物序列为正向:5'-AGTAGCAGGG ATTACAG GCATGAG-3',反向:5'-TGCCTTCCCT GAGATACTCAGCT-3'。
1.10 免疫组织化学分析
通过免疫组织化学染色评估结肠癌患者样品中ZEB1 和SIRT3 的表达。将石蜡切片在70 ℃下孵育1 h,在二甲苯中脱蜡,然后在梯度乙醇中再水化。用3% H2O2将载玻片孵育30 min。在95 ℃的恒温箱中用柠檬酸缓冲液(pH6.0)处理抗原。抗原回收后,将载玻片与一抗和二抗孵育。以1∶100 的稀释度使用ZEB1 抗体(Abcam),以1∶50 的稀释度使用SIRT3 抗体(Abcam)。将切片用3,3-二氨基联苯胺染色,在PBS 中终止,并用苏木精复染。
1.11 统计学分析
使用独立的学生t检验(两尾)或单向方差分析在SPSS 17.0 版(IBM Corp.)中进行统计分析。使用Logistic 回归确定TCGA 队列中ZEB1 和SIRT3表达水平之间的相关性。P<0.05 为差异有统计学意义。
2 结果
2.1 ZEB1 在结肠癌中介导有氧糖酵解
蛋白质印迹法结果显示,shZEB1A 和shZEB1B组ZEB1 蛋白表达明显减少(P<0.05)。见图1。

图1 ZEB1 在SW620 细胞中有效下调
在ZEB1 沉默的SW620 细胞中,ECAR 降低,随着时间变化,ECAR 呈现先降低、后升高、再降低的趋势;在ZEB1 敲低的SW620 细胞中,OCR 增加,随着时间变化,OCR 呈现先降低、后升高、再降低的趋势。见表2。
表2 ZEB1 对结肠癌细胞的ECAR、OCR 影响()
2.2 ZEB1 维持ROS 生成和线粒体膜电位
当ZEB1 表达沉默时,ROS 产生减少(P<0.05),线粒体膜电位增加(P<0.05)。见表3。
表3 ZEB1 调节ROS 产生和线粒体膜电位()
注:与对照组比较,aP<0.05
2.3 ZEB1 与结肠癌SIRT3 表达负相关
在ZEB1 沉默的SW620 细胞中,SIRT3 的mRNA水平显著增加(P<0.05),SIRT4 和SIRT5 的mRNA水平无明显变化(P>0.05)。见表4。在ZEB1 沉默的SW620 细胞中,SIRT3 的蛋白表达水平显著增加(P<0.05)。见图2。

图2 ZEB1 敲低增加了SW620 细胞中SIRT3 的蛋白表达水平
表4 ZEB1 敲低增加了SW620 细胞中SIRT3 的mRNA表达水平()

表4 ZEB1 敲低增加了SW620 细胞中SIRT3 的mRNA表达水平()
注:与对照组比较,aP<0.05
为了进一步探讨ZEB1 和SIRT3 之间的相关性,分析了结肠癌患者中ZEB1 和SIRT3 的表达。IHC染色检查ZEB1 和SIRT3 之间的表达相关,结果显示:较高ZEB1 表达的结肠癌患者显示较低SIRT3表达(图3)。

图3 较高ZEB1 表达的结肠癌患者显示较低SIRT3 表达
2.4 SIRT3 是ZEB1 的转录靶标
双重荧光素酶测定ZEB1 对SIRT3 启动子荧光素酶活性的影响,结果表明ZEB1 以剂量依赖性方式抑制SIRT3 启动子活性,结果如表5 所示。

表5 ZEB1 以剂量依赖性方式抑制SIRT3 启动子荧光素酶活性
2.5 表观遗传因子MBD1 可与结肠癌细胞中ZEB1相互作用
ChIP 分析表明,ZEB1 与MBD1 相互作用(图4A),且在SW620 细胞的细胞核中共定位(图4B)。
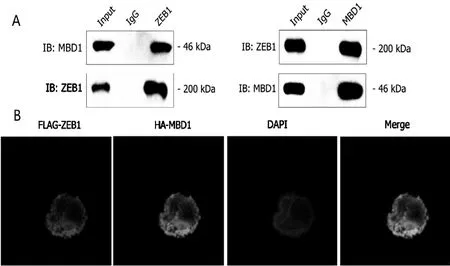
图4 表观遗传因子MBD1 可与结肠癌细胞中ZEB1 相互作用
2.6 MBD1 积极调节结肠癌细胞中有氧糖酵解和ROS 的产生
通过蛋白质印迹法验证MBD1 沉默的SW620 细胞系的击倒效率(图5A)。接下来,使用海马能量通量分析仪测试了MBD1 对糖酵解的影响。MBD1沉默抑制了SW620 细胞中的ECAR 值,MBD1 沉默细胞系中OCR 值增加,MBD1 沉默可降低结肠癌细胞中ROS 的产生(图5B)。

图5 MBD1 积极调节结肠癌细胞中有氧糖酵解和ROS 的产生
2.7 ZEB1 与MBD1 相互作用以抑制SIRT3 在结肠癌细胞中的表达
如上所述,ZEB1 负调节结肠癌细胞中SIRT3 的表达。接下来探究MBD1 是否在ZEB1 介导的SIRT3抑制中起辅助因子的作用。双重荧光素酶检测结果表明MBD1 抑制了SIRT3 启动子活性,而ZEB1 与MBD1 的共转染则更加显著地抑制了SIRT3 启动子活性。见表6。
表6 ZEB1 和MBD1 相互作用抑制SIRT3 启动子荧光素酶活性()

表6 ZEB1 和MBD1 相互作用抑制SIRT3 启动子荧光素酶活性()
注:*P<0.05,**P<0.01,差异有统计学意义
ChIP 分析证明ZEB1 和MBD1 在SIRT3 启动子区域富集(图6A)。reChIP 分析证明ZEB1 和MBD1同时占据SIRT3 启动子的同一区域(图6B)。总而言之,ZEB1 和MBD1 相互作用抑制SIRT3 表达,从而诱导结肠癌中有氧糖酵解。

图6 ZEB1与MBD1相互作用以抑制结肠癌细胞中sirtuin 3 的表达
3 讨论
越来越多的证据表明,EMT 在肿瘤进展中起重要作用[16]。EMT 在结肠癌发展中也起着关键作用。本研究结果表明,ZEB1 是糖酵解的负调节剂,在从线粒体到糖酵解的新陈代谢重编程过程中,线粒体呼吸受到损害,可以通过OCR 进行测试其在诱导和维持EMT 中起着重要作用,本研究结果表明,在ZEB1 沉默的SW620 细胞中,ECAR 降低,在ZEB1敲低的SW620 细胞中,OCR 增加,说明ZEB1 是线粒体呼吸的负调节剂,也说明ZEB1 是结肠癌中有氧糖酵解的正调节剂。ROS 的产生是糖酵解的净结果,而糖酵解又对有氧糖酵解产生积极影响,ZEB1 表达沉默时,ROS 产生减少,说明ZEB1 在结肠癌细胞中对ROS 产生正向调节作用。癌细胞通过有氧糖酵解利用葡萄糖,在此过程中,线粒体膜电位降低。ZEB1 沉默后,线粒体膜电位增加,表明ZEB1 可以维持ROS 的产生并调节结肠癌细胞中的线粒体膜电位。Sirtuin 家族成员(包括SIRT1-7)是脱乙酰基酶,可调节细胞中的新陈代谢、衰老、能量和氧化还原稳态。其中SIRT3、SIRT4 和SIRT5 定位于线粒体并负向调节糖酵解。因此,本研究检测了ZEB1 对SW620 细胞中SIRT3、SIRT4 和SIRT5 表达的影响。ZEB1 在其下游转录靶标的启动子区域特异性结合E-box(CANNTG)或Z-box(CAGGTA)序列。本研究分析了SIRT3 的启动子区域(从-2500 到+200),并确定了启动子区域中潜在的Z 框。双重荧光素酶测定ZEB1 对SIRT3 启动子荧光素酶活性的影响,结果表明ZEB1 以剂量依赖性方式抑制SIRT3 启动子活性。先前研究表明,表观遗传因子甲基-CpG 结合域蛋白1(MBD1)与TWIST 在结肠癌细胞中相互作用以诱导EMT。ZEB1 和TWIST 在促进转移方面有共同的下游目标。因此,本研究验证ZEB1 是否可以与结肠癌患者的MBD1 相互作用。MBD1 沉默抑制了SW620 细胞中的ECAR 值,表明MBD1 充当糖酵解的正调节剂。MBD1 沉默细胞系中OCR 值增加,表明MBD1 充当线粒体呼吸调节因子的负调节剂。MBD1 沉默可降低结肠癌细胞中ROS 的产生。这些结果证实MBD1 积极调节结肠癌细胞中的耗氧糖酵解和ROS 的产生。
在分化程度低的结肠癌样品和分化的结肠癌肿瘤衍生的浸润细胞中ZEB1 表达增加,因此其可作为结肠癌细胞存活的预后标志物。然而,很少讨论ZEB1 对癌细胞代谢的影响。在乳腺癌中,EMT 调节剂SNAIL 通过抑制果糖双磷酸酶1(FBP1)在诱导有氧糖酵解中起积极作用。FBP1 是糖酵解的负调节剂,可催化糖异生。在乳腺癌、透明肾细胞癌和胃癌中,FBP1 发挥抑癌作用。因此,SNAIL 介导的FBP1 抑制为侵袭性癌细胞带来了代谢优势[17]。研究表明,ZEB1 可抑制SIRT3 表达。SIRT3 是线粒体抑癌基因,对糖酵解有负调控作用[18]。除了其在调节葡萄糖代谢中的作用外,SIRT3 可调节癌细胞中的EMT 及EMT 转移。例如,作为脱乙酰基酶,SIRT3可以使S 相激酶相关蛋白2(SKP2)脱乙酰基。脱乙酰基 SKP2 的连接酶活性降低,从而逆转了EMT[19]。因此,SIRT3 充当EMT 的负调节器。
SIRT3 是一种肿瘤抑制因子,对糖酵解和EMT负调控。但是,很少讨论SIRT3 失调在癌症中的调控机制。过氧化物酶体增殖物激活受体PPARγ2α,一种调节线粒体发生的转录因子,也通过雌激素相关受体-α(ERR-α)调节SIRT3 表达,并且在启动子中存在一个推定的ERR-α 投标元件SIRT3 的区域。另一个观察结果是,SIRT3 随ROS 产量增加而特异性上调。这种上调可以通过涉及转录因子(如Nrf2)的氧气传感机制来控制。在此过程中,还观察到了ROS 水平的变化,因此可以认为EMT 调节剂可以对SIRT3 表达产生某些影响。据报道,MBD1 是一种可以与甲基化的CpG 岛特异性结合的表观遗传因子,在结肠癌中被上调,并调节EMT 以及化学疗法和放射疗法的抵抗力[20]。在本研究中,ZEB1 与MBD1相互作用,并且这两个蛋白共同占据SIRT3 启动子区域,表明ZEB1/MBD1 复合物调节SIRT3 表达。
综上所述,SW620 癌细胞中的ZEB1 通过与MBD1 相互作用沉默SIRT3 表达,从而导致线粒体能量代谢功能障碍,最终影响细胞转移复发,可能是细胞对治疗更加敏感的治疗策略。本研究阐明了通过减少燃料供应和抑制糖酵解来抑制结肠癌转移的可能性,发现了EMT 和糖酵解之间的新型联系,为结肠癌提供了潜在的治疗靶标。
