黄褐土玉米秸秆腐解菌株筛选及其促腐能力研究
2023-01-05张倩徐春燕张铎王亚会梁新盈李慧
张倩 徐春燕 张铎 王亚会 梁新盈 李慧
(河南农业大学资源与环境学院,郑州 450002)
我国是传统的农业大国,粮食年产量位居世界首位,秸秆年产量超过9 亿t,作物秸秆含有丰富的氮磷钾养分,养分含量相当于全国化肥养分总量的25%[1]。作为农业生产中重要的生物资源,在提高土壤肥力、改善土壤结构、激发土壤微生物活力等方面发挥着重要作用[2],但是,研究表明自然状态下粉碎秸秆还田300 d,其碳氮释放率仅约80%[3],影响耕作和下茬作物萌发,作物生长与秸秆腐解同期进行还易造成微生物与作物生长争氮,减缓秸秆养分在土壤中的转化速率,当前,秸秆如何高效原位腐解是制约其资源化利用的瓶颈问题。
秸秆腐熟菌剂通过多条生物化学途径实现对秸秆纤维素、半纤维素和木质素等物质的分解,是目前加速秸秆腐解及养分释放的最便捷、有效的途径。从自然界筛选到的秸秆腐熟菌种包括细菌芽孢杆菌属、假单胞菌属、纤维单胞菌属、瘤胃球菌属等,以及真菌青霉菌属、木霉属、曲霉属、枝顶孢霉属等[4-6]。然而,我国幅员辽阔,土壤环境差异巨大,不同菌株的适宜生长条件各不相同,在目标地分离的菌株对原有环境的适应性更强,不仅易于存活还可避免对土著微生物群落的扰动,可有效解决外源菌株应用效果不佳的问题。李正风等[7]从烟草秸秆自然发酵物中筛选到高效产纤维素酶细菌Luteibactersp.L43 用于烟草秸秆腐熟。胡佳俊[8]从海水及其沉积物中分离驯化获得了非光合CO2同化的高效固碳微生物菌群,发现其对混合无机碳源的同化效率显著高于单一碳源。李娜等[9]基于小兴安岭山区土壤分离到1 株在低温下具有较强纤维素降解能力的真菌,对秸秆的降解能力达55.6%。顾文杰等[10]通过拮抗实验筛选构建了能够适应南方酸性土壤的高效复合半纤维素降解菌系。青格尔等[11]将筛选到的玉米秸秆低温降解复合菌系进行室内土培接种实验,发现其可有效加快秸秆分解,提高土壤微生物群落多样性。
黄褐土是黄淮海粮食主产区的典型土壤类型之一,占地约380 万hm2,第二次土壤普查以来,黄褐土已经出现了酸化态势,pH < 5.5 的占地面积达7.08 万hm2[12],黄褐土土壤黏粒和粉砂较多,保肥性较强,但土壤易板结[13],并且光热资源不足造成了玉米-小麦轮作茬口紧、还田玉米秸秆腐解速率慢等问题,导致了小麦出苗困难、越冬受阻,目前商品用秸秆腐熟菌株在黏板酸化土壤上的定殖效果不佳,无明显促腐效果[14-15]。因此,本文基于连续8年秸秆还田的黄褐土,结合选择性平板、滤纸和秸秆崩解定性分析、酶活性定量测定、种属鉴定等方法筛选优势玉米秸秆腐解菌株,通过土培试验验证其实际促腐效果,弥补外源腐解菌土壤定殖能力弱、促腐效果差及作物生长不良等缺点,为障碍黄褐土麦玉轮作区秸秆腐熟菌剂开发和应用提供理论基础,促进秸秆类农田废弃物资源化利用。
1 材料与方法
1.1 材料
1.1.1 土壤样品采集 土壤采自黄褐土小麦-玉米轮作长期定位试验,试验地点位于河南省方城县赵河镇现代农业示范园区(33°08′N,112°58′E),处于亚热带大陆性气候带,年平均日照时数为2 092 h,年均气温14.4℃,年均降雨量803.9 mm 左右,无霜期220 d。小麦季,化肥氮(N)、磷(P)、钾(K)用量为每年施用N 117 kg/hm2,P2O590 kg/hm2,K2O 75 kg/hm2,玉米秸秆(切碎成3-5 cm)全量还田,折合总氮投入为180 kg/hm2,氮肥基追比5∶5,拔节期开沟条施追肥。玉米季,肥料用量为每年施用N 210 kg/hm2,P2O575 kg/hm2,K2O 90 kg/hm2,其中磷肥、钾肥于五叶期一次性沟施,氮肥分别在玉米五叶期和抽雄期条施(5∶5),氮磷钾肥料分别为尿素、过磷酸钙和氯化钾。2019年小麦收获季采集土壤样品用于土著高效玉米秸秆腐解菌株筛选,供试土壤pH 5.81,有机质22.04 g/kg,全氮1.43 g/kg,碱解氮127.31 mg/kg,速效磷28.00 mg/kg,速效钾285.14 mg/kg。
1.1.2 培养基 主要培养基配置方法如下:(1)LB培养基:蛋白胨10 g、酵母膏5 g、NaCl 10 g、蒸馏水1 000 mL(若用固体培养基则增加20g 琼脂),pH 自然。(2)羧甲基纤维素钠(CMC-Na)液体培养基:CMC-Na 15.0 g、K2HPO41.0 g、MgSO4·7H2O 0.5 g、NaNO33.0 g、KCl 0.5 g、FeSO40.01 g、蒸馏水1 000 mL。(3)CMC-Na 分离培养基:CMC-Na 15.0 g、K2HPO41.0 g、MgSO4·7H2O 0.5 g、NaNO33.0 g、KCl 0.5 g、FeSO40.01 g、琼脂15.0 g、蒸馏水1 000 mL。(4)玉米秸秆粉培养基[16]:KH2PO41.0 g、MgSO4·7H2O 0.4 g、CaCl20.1 g、FeCl30.01 g、NaCl 0.2 g、(NH4)2SO43.0 g、玉米秸秆粉20.0 g、琼脂18.0 g、蒸馏水1 000 mL。(5)刚果红固体培养基:(NH4)2SO42.0 g、MgSO4·7H2O 0.5 g、K2HPO41.0 g、NaCl 0.5 g、CMC-Na 2.0 g、刚果红0.2 g、琼脂20.0 g,蒸馏水1 000 mL,pH 自然。(6)滤纸崩解液体培养基:(NH4)2SO41.0 g、MgSO4·7H2O 0.5 g、KH2PO41.0 g、酵母膏0.1 g、蒸馏水1 000 mL,pH 自然。(7)秸秆崩解液体培养基:玉米秸秆0.5 g、KH2PO41.0 g、MgSO4·7H2O 0.5 g、NaNO33.0 g、KCl 0.5 g、FeCl3·6H2O 0.01 g,蒸馏水1 000 mL[17]。以上培养基均于121℃高压灭菌30 min 后备用。
1.2 方法
1.2.1 纤维素降解菌株分离与纯化 称取新鲜土壤样品10 g 于250 mL 锥形瓶(装有90 mL 无菌水和几粒玻璃珠),200 r/min 震荡1 h,静置2 h。取1 mL 上清液加入装有9 mL 无菌水的试管中,成10-1倍稀释液。混匀后,再取1 mL 加入装有9 mL 无菌水的试管中,即成10-2倍稀释液,按上述方法稀释到10-9倍。
菌株筛选方案1:取10-1、10-3、10-5、10-7、10-9稀释液涂布于CMC-Na 固体分离培养基上,每个稀释度重复3 次,28℃下黑暗培养5-7 d。长出菌落后,根据菌落形态特征挑取单个菌落接种在LB纯化培养基,反复划线分离至长出单一菌落。方案2:取8 g 土样,加3 g 玉米秸秆段及100 mL 蒸馏水,160 r/min 震荡富集10 d,将土样溶液稀释成10-3、10-4、10-5和10-6共4 个梯度,再依次取100 μL 涂布于玉米秸秆粉培养基上,37℃条件下培养2 d,将长势较好的单菌落反复划线分离至长出单一菌落[18]。方案3 取10-5-10-7的土壤溶液稀释液,涂布于秸秆粉培养基上,置于30℃恒温培养箱中培养4 d,挑选出生长旺盛的菌株接种至秸秆粉培养基平板上,多次平板划线分离纯化。最后将筛选获得的纯细菌菌落保存至LB 培养基(含20%甘油)中,-80℃冷冻保藏。
1.2.2 秸秆腐解菌株的初筛 将纯化后的菌株点接在刚果红固体培养基,每个菌株3 次重复,28℃倒置培养3-5 d 后,观察菌落周围是否产生水解圈,记录透明圈直径(D)与菌落直径(d)比值的大小,初步筛选出纤维素降解能力强的菌株。
1.2.3 滤纸条和玉米秸秆崩解复筛 挑取单菌落接种于LB 培养基中,37℃、160 r/min 培养24 h 后,制备菌悬液。按10%的接种量将菌悬液接种于90 mL 滤纸条崩解培养基/秸秆崩解液体培养基中,并放入6 条滤纸条(1 cm×6 cm)/0.5 g 玉米秸秆(约0.5 cm×3.0 cm 的条状),于28℃、120 r/min 条件下恒温振荡培养,每个菌株3 次重复,以接入10 mL 灭菌水为对照,定期观察滤纸条/玉米秸秆崩解情况。
1.2.4 秸秆高效腐解菌酶活性测定 将所筛菌株的菌悬液吸取5 mL 于液体产酶培养基培养3-4 d 后,于8 000 r/min 离心15 min,所得上清液即为粗酶液。基于DNS 显色法[19],结合不同的底物,分别测定所筛菌株的滤纸酶、内切酶、外切葡聚糖酶、β-葡萄糖苷酶和木聚糖酶活性。
向25 mL 具刻度试管中分别添加0.05 g 新华1号滤纸和2 mL 醋酸-醋酸钠缓冲液(0.05 mol/L,pH4.8)、1% CMC-Na 溶液、0.05 g 脱脂棉和2 mL 柠檬酸缓冲液(0.05 mol/L,pH4.5)、2 mL 水杨苷溶液(1%)、1 mL 木聚糖溶液(1%)作为上述5 种酶活性的底物和缓冲液,添加0.5 mL 粗酶液后,超声震荡30 s,将试管50℃水浴0.5 h,加入3 mL DNS 试剂,沸水浴10 min 后置冷水中冷却,蒸馏水定容至25 mL。另取等量底物加入刻度管,并向管中加入3 mL DNS 后再加入等量粗酶液混匀以终止酶反应,与试验组在同等条件下进行反应。试验组和对照组均于波长为540 nm 下测定吸光度值。同样利用DNS 方法,制作葡萄糖和木聚糖溶液的标准曲线。酶活力单位用U,定义为在50℃条件下,1 mL 粗酶液1 min 内催化底物水解生成1 μg 葡萄糖/木聚糖的粗酶量。
酶活力(U)= m·n·1 000/(t·v);式中m为葡萄糖或木聚糖质量,n 为分取倍数,t 为反应时间30 min,v 为粗酶液量0.5 mL。
1.2.5 菌株实际秸秆促腐能力 取烘干玉米秸秆12.0 g(长度1-2 cm)装在250 目尼龙网袋中,将网袋平铺放置于装有6.0 kg 土壤的盆中,每个处理加入秸秆崩解液体培养基(去除CMC-Na)30 mL 和相应菌液10 mL,腐解菌株终浓度1.0×108CFU/g 秸秆,覆土3 cm(新鲜土壤提前调节为田间持水量的60%),对照组用等量蒸馏水代替菌液,25℃培养,每2 d 称重调节土壤含水量,分别在7、14、21、28 d 后取出,洗净烘干至恒重,测定秸秆包内玉米秸秆质量变化动态,计算秸秆腐解速率。
1.2.6 菌株的鉴定 将纯化后的秸秆腐解菌株活化,在LB 培养基平板上划线法接种菌株,在28℃的培养箱中培养2-3 d,直至在平板上生长出清晰的单菌落,观察菌落的性状、大小、隆起性状、表明透明度、边缘及菌落颜色等形态特征。所筛菌株的革兰氏染色、过氧化氢酶反应、甲基红、乙酰甲基甲醇、淀粉水解、明胶水解、硝酸盐还原、柠檬酸盐利用试验分析参照文献[19]进行,表征菌株的形态学与生理生化特性。
将初筛所得菌株接种至LB 培养基,28℃、180 r/min 震荡培养至OD = 0.8,分别取1 mL 菌液,12 000 r/min 离心2 min,弃上清液,用天根细菌基因组提取试剂盒提取总DNA,用NanoDrop 检测DNA 浓度和纯度,-20℃保存备用。分别以菌株基因组总DNA 为模板,用细菌16S rRNA 基因通用引物27F/1492R 扩增,电泳检测合格后测序。将序列在Ribosomal Database Project(RDP)中对比以获取同源序列,使用MEGA X 软件,基于Neighbour-Joining法构建系统发育树(bootstrap consensus tree),并根据系统关系确定分类地位。
1.2.7 数据分析与处理 文中利用Excel 2016、SPSS、Origin 9.0 进行统计、分析和作图。
2 结果
2.1 玉米秸秆纤维素高效降解菌初筛
基于长期还田的黄褐土土壤样品,通过不同方案分离并纯化获得生长能力强的单一菌株58 株,依次编号为XJ1-XJ58。利用刚果红染色法初步将所得具纤维素降解能力的细菌进行初筛,以菌株培养4 d 后透明圈直径/菌落直径(D/d)> 1 为判定界限,发现57 株菌株具有纤维素降解能力,其中D/d 值大于2.0 的菌株36 株,大于3.0 的菌株29 株(表1),如图1所示,菌株XJ9、XJ12、XJ13、XJ37 的D/d值大于8.0。
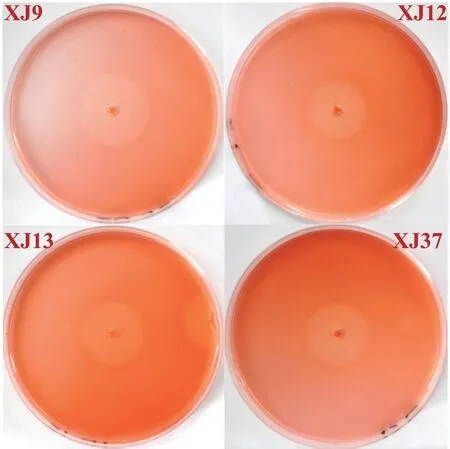
图1 部分优势菌株在纤维素刚果红培养基上产生的水解圈Fig.1 Hydrolysis circles of dominant strains on cellulose Congo red medium
2.2 玉米秸秆纤维素降解菌复筛
对初筛得到的58 株纤维素降解菌进行滤纸条和秸秆崩解能力复筛,记录培养7 d 后的滤纸条崩解程度和培养10 d 后的秸秆崩解程度(表1),发现约一半菌株对滤纸条有一定的降解能力,其中以XJ9、XJ12、XJ14、XJ16、XJ31、XJ34、XJ36、XJ37、XJ39、XJ49 等15 株菌株的滤纸条崩解能力更强,培养7 d 后滤纸条整体膨胀并已下弯,部分滤纸条破碎,瓶底出现纸屑。此外,XJ1、XJ2、XJ5、XJ8、XJ13、XJ14、XJ15、XJ16、XJ21、XJ22、XJ27、XJ28、XJ43、XJ49、XJ54、XJ55、XJ57 共17 株菌株的玉米秸秆崩解能力更强,三角瓶中玉米秸秆出现明显的秸秆碎屑,培养基液体明显浑浊,部分优势菌株接种下玉米秸秆的崩解效果如图2所示。
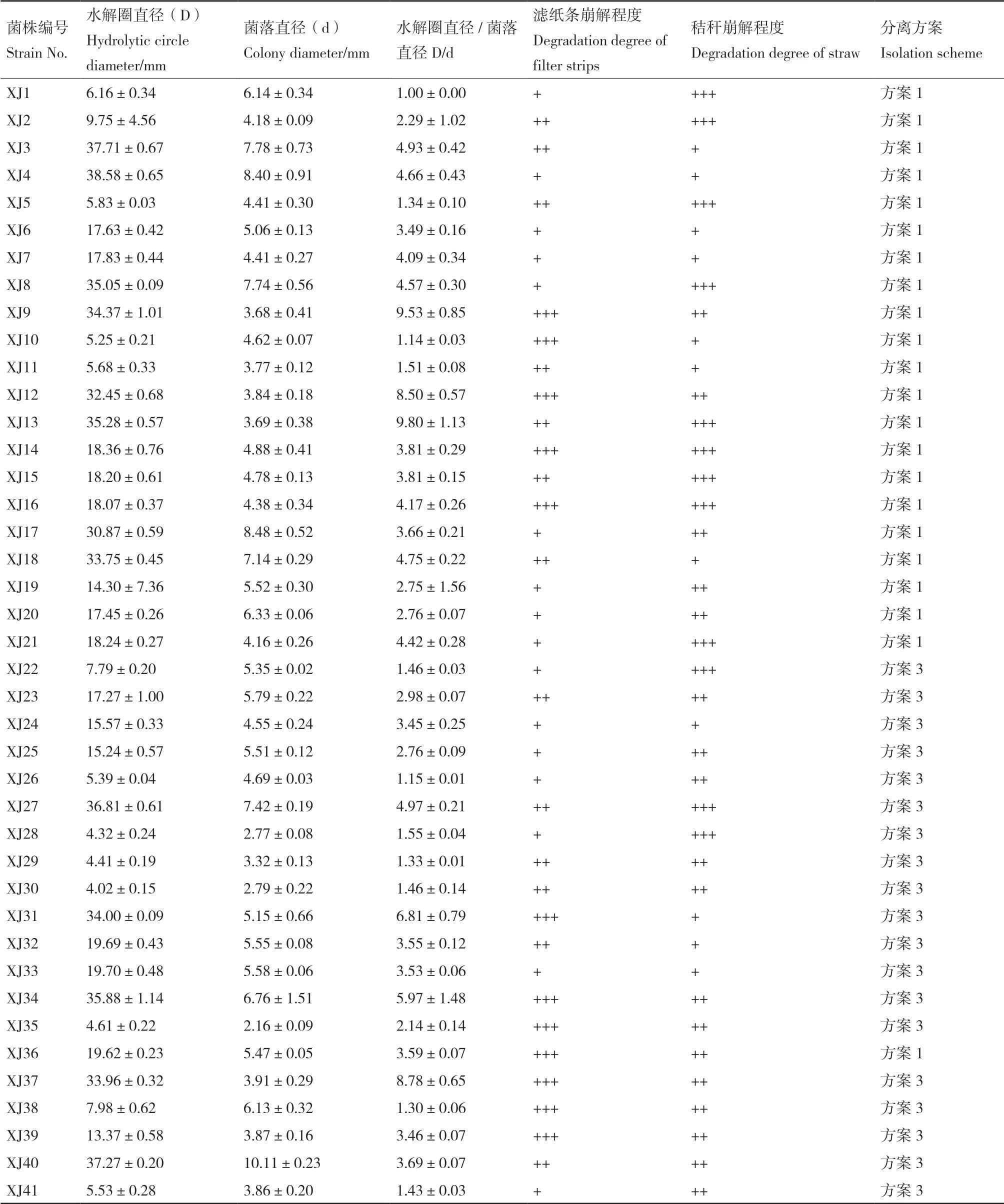
表1 各菌株接种下刚果红水解圈、滤纸条和玉米秸秆崩解情况Table 1 Hydrolytic circle diameter of strains on Congo red medium,and degradation degrees of filter strips and maize straw with different strains inoculated
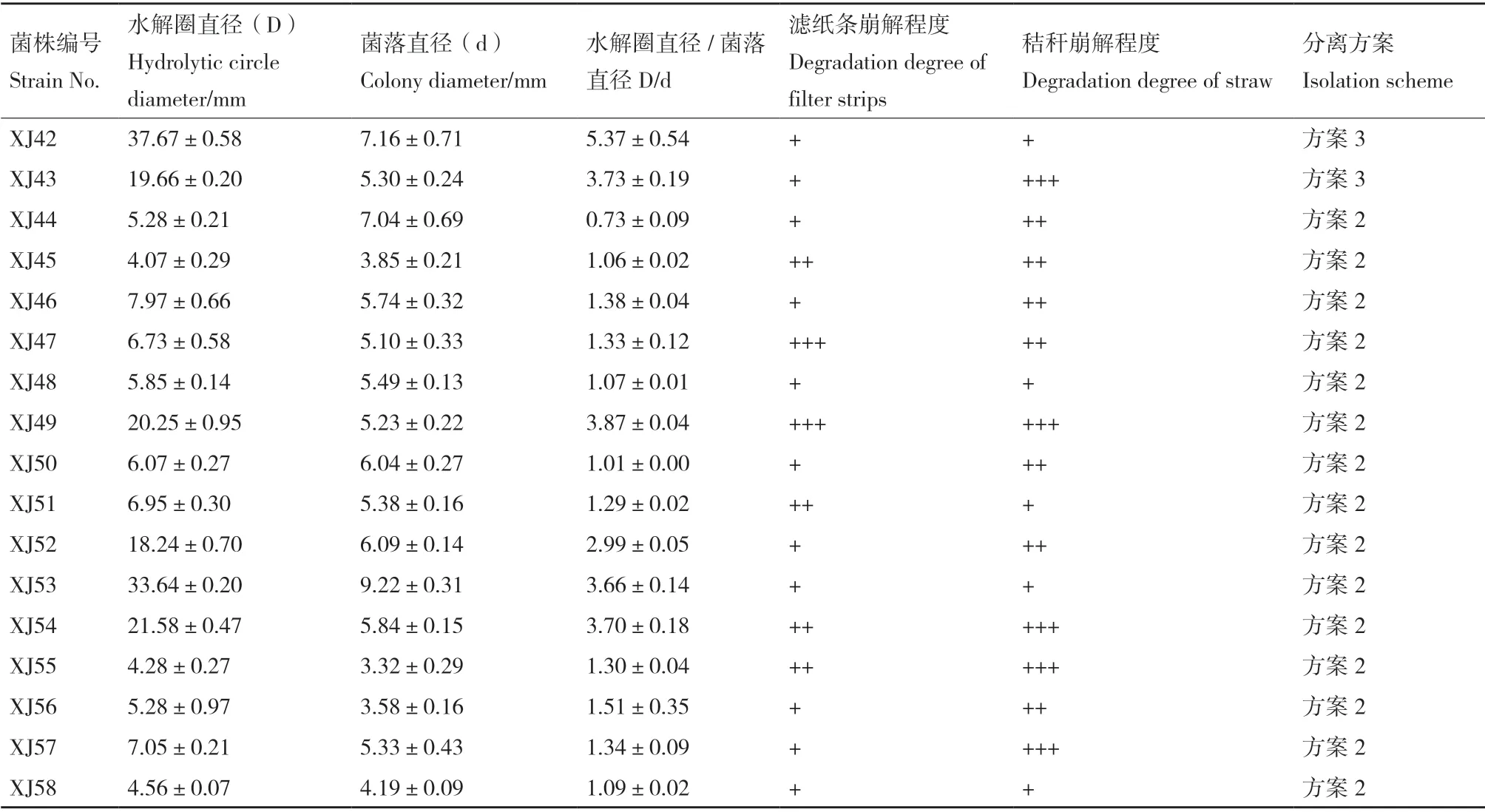
续表Continued
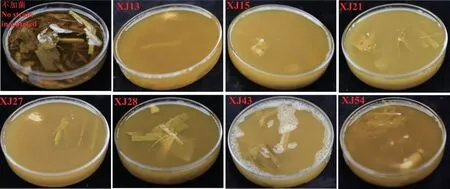
图2 优势菌株接种下玉米秸秆降解效果Fig.2 Degradation results of maize straw with domi-nant strains inoculated
2.3 玉米秸秆纤维素高效降解菌的产酶能力
对比58 株菌株的5 种纤维素降解相关酶活性发现(图3),整体上,各菌株的内切葡聚糖酶和β-葡糖苷酶活性差异不大,大多数的菌株具有较高的滤纸酶活性,XJ3、XJ13、XJ27 和XJ37 菌株的纤维素降解酶活性均较高,其中,XJ13 菌株的滤纸酶、内切葡聚糖酶、外切酶、β-葡糖苷酶和木聚糖酶活性分别为315.62、222.70、278.86、275.33 和5 252.64 U,XJ37 菌株的各酶活性则为291.47、263.10、211.93、287.27 和17 109.91 U,这与其较高的D/d 比值、滤纸和秸秆崩解程度相一致。菌株XJ6、XJ12 和XJ34的滤纸酶、内切葡聚糖酶、外切酶和β-葡糖苷酶活性均较高,其中XJ6 的滤纸酶、外切酶、β-葡糖苷酶活性均为各菌株中最高,达1 031.33、457.42和571.14 U,XJ34 的内切葡聚糖酶活性最高,达648.34 U。菌株XJ9 和XJ38 的内切葡聚糖酶、外切酶、β-葡糖苷酶和木聚糖酶活性较高,但是滤纸酶活性较低。此外,各菌株木聚糖酶活性差异很大,XJ1、XJ23、XJ29、XJ31、XJ53 和XJ58 菌株表现出较强的木聚糖酶活性,达6203.97 U 以上,但有相当一部分菌株的木聚糖酶活性仅为1 000 U 左右,XJ16-18、XJ20-21、XJ49 菌株仅表现出较高的滤纸酶活性和外切酶活性。综上,筛选得到的58 株菌株中,XJ6、XJ9、XJ13、XJ27、XJ34、XJ37 菌株产纤维素降解酶能力较强。
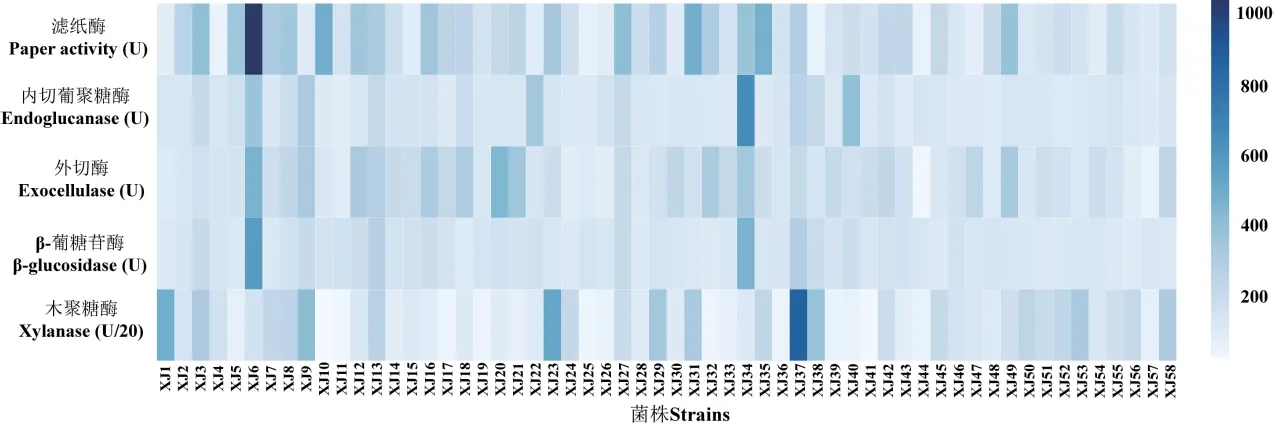
图3 各菌株的纤维素降解相关酶活性Fig.3 Cellulose-degrading related enzyme activities of different strains
2.4 玉米秸秆高效腐解菌株的鉴定
结合平板初筛、以及各菌株的产酶能力,依据选择性平板、滤纸和秸秆崩解程度、产酶活性的结果共筛选出高效秸秆腐解菌株22 株(XJ9、XJ12、XJ13、XJ16、XJ31、XJ34、XJ37、XJ3、XJ6、XJ49、XJ27、XJ14、XJ15、XJ18、XJ21、XJ17、XJ1、XJ54、XJ29、XJ2、XJ8、XJ53,排序按照能力由强至弱排列),构建系统发育树和相似性分析发现(图4),7 个菌株与Klebsiella variicolaF2R9T相似性极强,结合以上指标结果,选取XJ9、XJ12、XJ34 作为代表菌株;菌株XJ37 与PseudomonasazotoformansIAM1603T相似性强,XJ14、XJ18、XJ21、XJ31 菌株虽与Stenotrophomonas同源,但相似性不够紧密,因而全部保留用于下一步秸秆腐解土培试验。菌株XJ29 与Stenotrophomonas rhizophilae-p10T相似性强,菌株XJ27 与Enterococcus italicusTP1.5T相似性高于99%,XJ16 与XJ17 菌株均与Staphylococcus epidermidisATCC 14990T相似性强,选择XJ16 用于下一步试验;菌株XJ1 与Staphylococcus capraeATCC 35538T相似性强,XJ3、XJ15、XJ8分别归属于芽孢杆菌属的Bacillus tequilensis10bT、Bacillus aryabhattaiB8W22T和Bacillus cereusATCC 14579T,后续进行土培试验研究高效秸秆腐解菌株的实际促腐能力。
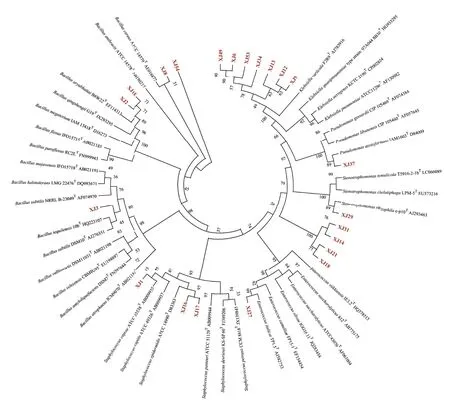
图4 根据16S rRNA 构建的优势玉米秸秆腐解菌株的系统发育树Fig.4 Neighbor-joining phylogenetic tree based on 16S rRNA gene sequences of dominant maize straw-decomposing bacteria
2.5 高效秸秆腐解菌株的实际促腐能力
将上述筛选出的14 株菌株接种入黄褐土中进行秸秆包填埋试验发现,玉米秸秆在土壤腐解过程中,秸秆由土黄色变成黑褐色,由长条状变成短状或碎末状,同时秸秆硬度逐渐下降并且松散易断。图5表明,菌株XJ8(Bacillus cereus)、XJ3(Bacillus subtilis)接种下秸秆的腐解速率较高,较不接种处理分别提高7.58%和6.33%,培养28 d 后,玉米秸秆腐解率达45.58%和44.33%,效果优于其他菌株,2 株细菌的形态学及生理生化特性见表2,菌株XJ3和XJ8 在中国农业微生物菌种保藏管理中心进行保藏,编号分别为ACCC 62095 和ACCC 62096。
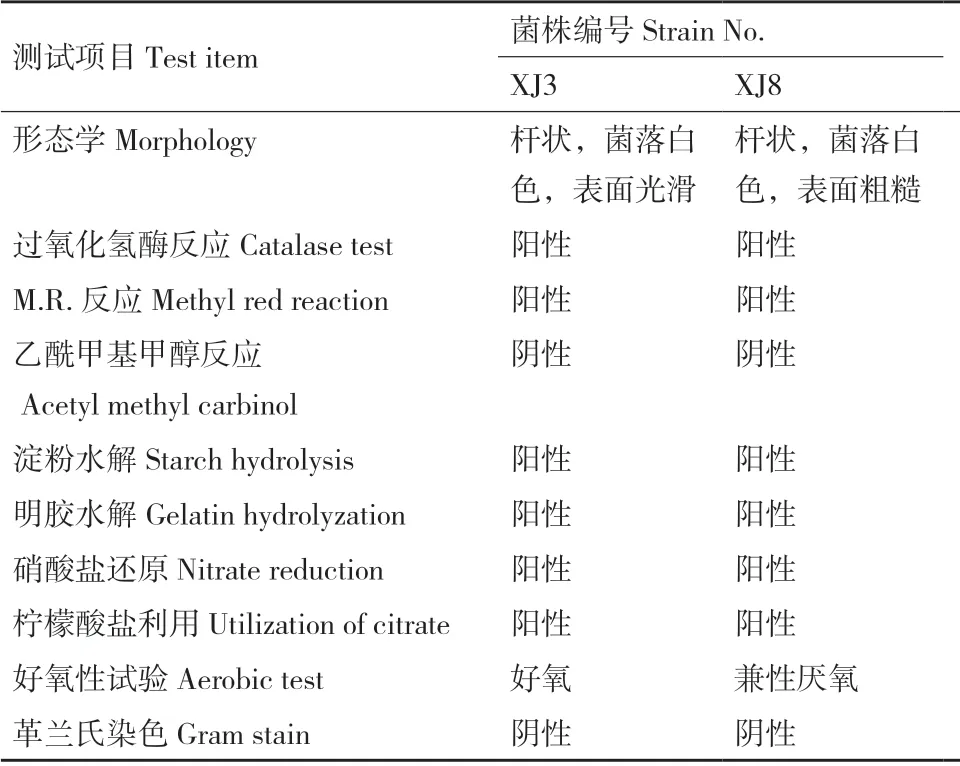
表2 优势秸秆腐解菌株的形态及生理生化特性Table 2 Morphology and physiological-biochemical characteristics of maize straw-decomposing strains
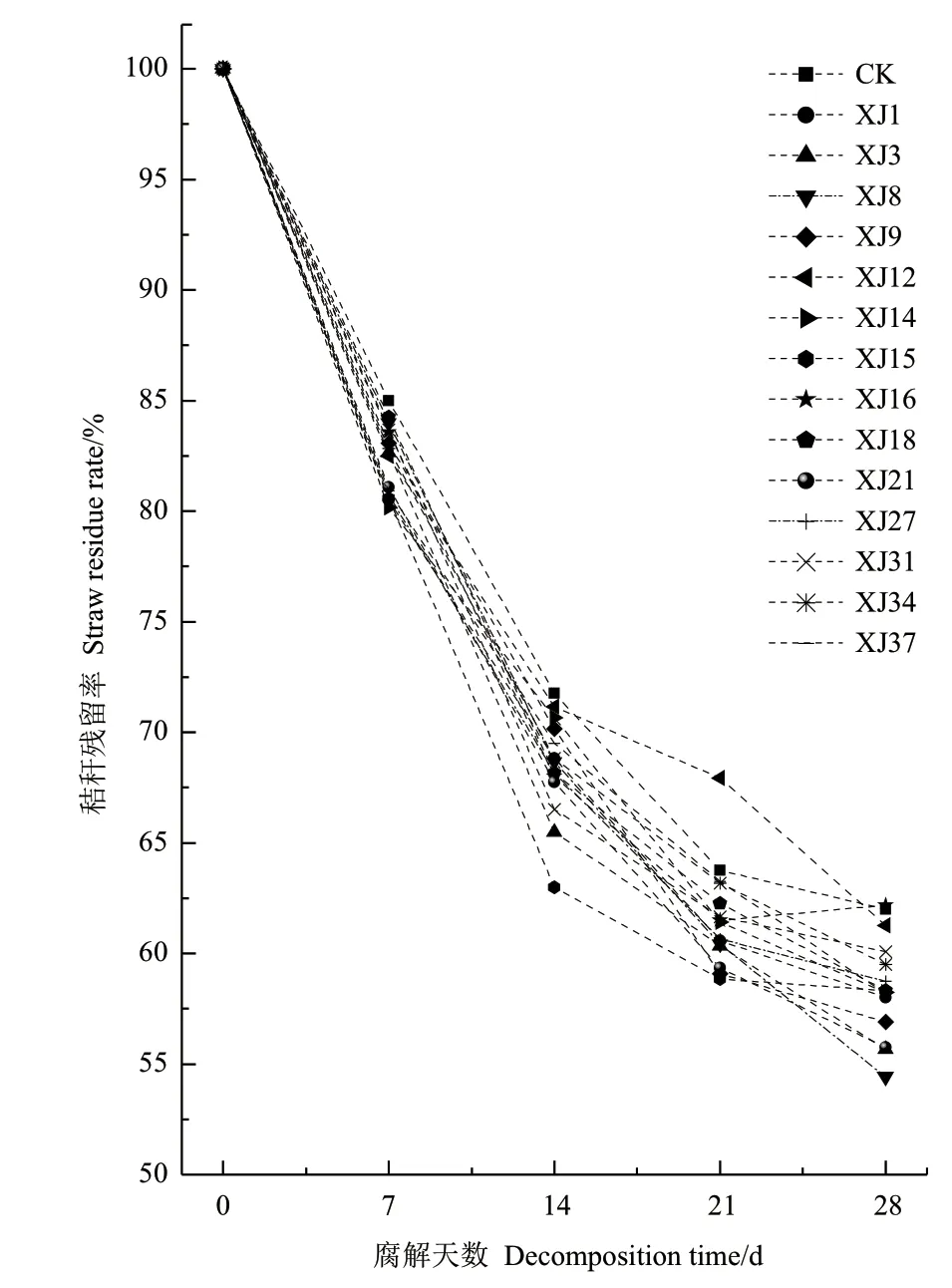
图5 不同菌株接种下玉米秸秆腐解速率Fig.5 Maize straw decomposition rates under different strains inoculated
3 讨论
直接还田是秸秆资源化利用的有效方式之一,加速还田秸秆的原位微生物腐解过程是其养分高效利用的关键,已成为理论研究和应用开发的热点。商品秸秆腐熟菌剂的菌种单一,田间施用效果参差不齐,如姚云柯等[20]发现施用厚壁菌门芽孢杆菌(Bacillus subtilis、Bacillus licheniformis)以及佛山金葵子牌腐秆剂(菌种包括Bacillus subtilis、Paenibacillus polymyxa和Bacillus brevis),未能显著提高酸性红壤的稻秸腐解速率。从障碍性土壤中筛选土著腐解菌株更具有针对性,实践效果更佳。本文通过将定性/定量分析、现象/机理多手段联合筛选到XJ8、XJ3 共2 株在障碍黄褐土中具有高效促腐能力的细菌菌株,经鉴定为蜡样芽孢杆菌(Bacillus cereus)和枯草芽孢杆菌(Bacillus subtilis),28 d 秸秆促腐率为最高为45.58%,相同培养时间下,较韦中等[21]筛选的拟康宁木霉(Trichoderma koningiopsis)和解淀粉芽孢杆菌(Bacillus amyloliquefaciens)的秸秆促腐率高出约12%。除被广泛应用于秸秆腐熟菌剂和微生物肥料的生产外,枯草芽孢杆菌还可受水杨酸刺激,增强烟草抗青枯病能力[22]。根际蜡样芽孢杆菌不仅具有促腐秸秆的作用,还可通过植物激素茉莉酸、乙烯、水杨酸途径诱导植物的根系防御反应,是典型的根际益生菌[23-26]。菌株的促腐效果主要取决于其与土著菌竞争后的存活能力,前期对供试土壤细菌群落进行高通量测序发现,芽孢杆菌(Bacillus)的相对丰度为1.21%,是黄褐土细菌群落的土著优势属,这可能提高了其与土著菌群的竞争能力,有利于其在土壤中的定殖。
土壤环境复杂、气候条件差异巨大,不同微生物类群间存在协作、拮抗、捕食等关系,仅依靠刚果红、酶活性以及液体培养崩解评价菌株的实际促腐能力有一定的局限性[27-30],存在与土培秸秆促腐效果不一致的情况。本研究中,XJ6、XJ34 菌株的产酶能力较强,但XJ6 的刚果红水解能力以及液体培养滤纸/秸秆的崩解效果较差,XJ34 菌株的刚果红水解能力以及液体培养滤纸/秸秆的崩解效果虽表现良好,其秸秆腐解速率却仅提高了约2%,这可能与高度专一性的诱导型糖苷水解酶类β-葡萄糖苷酶有关,β-葡萄糖苷酶可水解纤维二糖和短链纤维寡糖释放出葡萄糖,但其酶活性一方面受代谢产物的阻遏效应,另一方面也对内切及外切葡聚糖酶具有抑制作用[31-32],XJ6 和XJ34 菌株的β-葡萄糖苷酶活性高达459 U,明显优于其他菌株,可能导致其土培促腐能力较弱。秸秆成分复杂,木聚糖是秸秆半纤维素中最具代表性的组分之一,降解该物质的木聚糖酶也是半纤维素酶系中含量最多的酶,本文所筛秸秆高效腐解菌株XJ8 和XJ3 表现出了较高的滤纸酶活性和木聚糖酶活性,表明这两种酶活性可能对促进黄褐土玉米秸秆腐解的贡献更大。
复合菌系处理秸秆被认为是一种稳定高效的降解手段,顾文杰等[10]构建了互不拮抗的哥斯达黎加链霉菌(Streptomyces costaricanus)、亮白曲霉(Aspergillus candidus)和黄蓝状菌(Tarlaromyces flavus)纤维素降解复合菌剂,显著提高了半纤维素酶活性。另有研究表明,固氮螺菌属(Azospirillum)和肠球菌属(Enterococcus)复合菌系的低温降解玉米秸秆能力较强,更适应于北方高寒区秸秆原位腐解[33]。王新光等[34]构建了枯草芽孢杆菌(Bacillus subtilis)、地衣芽孢杆菌(Bacillus lincheniformis)、蜡样芽孢杆菌(Bacillus cereus)和黑胡桃链霉菌(Streptomyces nogalater)的复合菌系,发现其固体发酵条件下玉米秸秆降解率达63.6%,显著高于单菌处理,部分验证了我们所筛菌株的秸秆促腐能力。供试黄褐土酸板黏的环境条件一定程度限制了土壤微生物生长和活动,下一步,将所筛秸秆高效腐解菌株构建复合菌系,探索其最佳功能条件,定量评价复合菌系在黄褐土中的定殖情况,分析在玉米秸秆腐解过程中,微生物群落组成及演替规律,开展其促腐兼具抗性机制研究,将是未来研究的重点。
4 结论
本研究从长期秸秆还田的黄褐土中筛选出两株玉米秸秆高效腐解菌株XJ8(Bacillus cereus)和XJ3(Bacillus subtilis),XJ8 的28 d 土培秸秆腐解率最高为45.58%,较不加菌土壤,可提高黄褐土土壤中秸秆腐解效率达19.96%,补充了现行商品秸秆腐熟菌种资源库,对酸性、黏、板黄褐土等障碍土壤中秸秆腐解菌剂的创制和应用提供参考。
