miR169/NFYA模块响应植物非生物胁迫的研究进展
2023-01-05季洁韵李强曾幼玲
季洁韵 李强 曾幼玲
(1.新疆大学生命科学与技术学院 新疆生物资源基因工程重点实验室,乌鲁木齐 830017;2.新疆农业科学院经济作物研究所,乌鲁木齐 830091)
遗传信息与外部环境共同影响生物体的生长,而植物作为一种固着生物受到外界环境的影响较大,已进化出系列机制应对非生物胁迫[1],包括胁迫传感、信号传导、基因表达、转录加工及翻译后的蛋白修饰。这些反应会通过减少植物活性氧(ROS)水平、提高细胞膜系统稳定性等过程增强植物对非生物胁迫的耐受性[2]。
microRNA 是一种20-24 nt 的非编码RNA。一般情况下,植物miRNA 通过剪切信使RNA(messenger RNA,mRNA)或者抑制翻译负调控靶基因的表达。随着测序技术与分子手段的发展,在多种植物中已鉴定了大量miRNA 并明确了其靶基因的作用。植物中很多miRNA 靶基因编码的蛋白是与启动子结合调控下游基因转录活性的转录因子[3]。miRNA/转录因子模块在植物多种生理过程中发挥作用。miR156/SPL 模块是调控植物从营养生长到生殖生长转变的关键因子。SPL,SQUAMOSA 启动子结合类蛋白,与花发育基因的启动子特异结合,影响植物的顶芽、花序发育以及开花时间。幼苗期miR156 转录水平较高,导致SPL表达较低,随着植物的生长,miR156转录水平逐渐降低,使得SPL 转录因子积累,这样SPL 又会促进其下游miR172 的转录,从而抑制miR172 靶向的APETALA2(AP2)类转录因子的表达,使植物从幼苗转为成苗[4-6]。苹果miR156/SPL模块通过激活WRKY100的表达调控植物的耐盐性[7];miR171 及其靶向的转录因子SCARECROWLIKE(SCL)通过整合抗坏血酸途径增强苹果的耐旱性[8]。
1 植物miR169 对NFYA 的调控作用
在单子叶和双子叶植物中共鉴定到400 多个miR169 家族成员[9],其成熟体序列较为保守。鹰嘴豆(Cicer arietinum)中鉴定了13 个miR169 成员,其序列一致性达到84.25%,个别成员序列完全一致[10]。葡萄(Vitis vinifera)中鉴定出25 个成员,其成熟体约一半的碱基完全一致,仅3′和5′端1-2 个碱基保守性较差[11]。拟南芥(Arabidopsis thaliana)miR169 家族分为4 个亚族,为miR169a、miR169b/c、miR169d/e/f/g 及miR169h/i/j/k/l/m/n[12]。
核因子Y(nuclear factor Y,NF-Y)又称CCAAT 结合因子(CCAAT-binding factor,CBF),是由3 个进化相对保守的亚基NFYA、NFYB、NFYC 组成。NFYA 家族有2 个核心结构域,分别为在N 端与NFYB 和NFYC 互作的结构域,以及在C 端识别并结合DNA 位点的结构域[13]。NFYB 与NFYC 形成二聚体寻找CCAAT-box,继而招募NFYA 形成三聚体插入DNA 双螺旋的小沟,使DNA 双螺旋保持松弛状态,从而更有利地募集RNA 聚合酶或其他转录因子[14],对其下游基因进行调控。目前,在多种真核生物中均有NF-Y 家族成员。拟南芥NFYA、NFYB 和NFYC 家族的成员分别有10(可分为3 组,第1 组:NFYA3/4/5/6/7/8,第2 组:NFYA1/9,第3 组:NFYA2/10)、13 和13 个,推测可形成1 690 种三聚体组合[15]。CCAAT-box 存在于25%以上的真核生物基因组中[16],暗示NF-Y 家族通过结合CCAATbox 广泛调节下游基因的表达,参与植物多种生理过程。
miR169 家族最主要的靶基因是NFYA 家族成员。葡萄miR169 基因家族共预测22 个靶基因,其中,有21 个属于NFYA 家族[11];油菜(Brassica napus)miR169 家族的16 个靶基因中,12 个属于NFYA 家族[17]。与多数植物miRNA 作用相似,miR169 家族的调控方式多为转录后水平切割mRNA,使其降解。大部分NFYA 家族的3′UTR 区域有一段可以与miR169 互补的保守序列(不同物种中的序列有差异),拟南芥NFYA 家族成员中大多数具有这段保守序列[15];玉米(Zea mays)14 个NFYA 成员中,有8 个可以被miR169 靶向切割[18]。在大豆(Glycine max)[19]、日本杏(Prunus mume)[20]、水稻(Oryza sativa)[21]等物种中也均有报道通过RLM-RACE 技术确定miR169 家族对靶基因3′UTR 区域的切割位点。miR169 也会在翻译水平上影响靶基因的表达。拟南芥miR169i/l 的二级结构在11 nt 和16 nt 处碱基错配造成的凸起,改变了AGO 蛋白的分选,导致没有降低靶基因AtNFYA5的转录丰度,反而增加了其蛋白水平[22]。miR169 对其靶基因调控方式呈现多样性。miR169/NFYA 模块就像一个开关,启动或关闭下游基因的表达,以满足植物应对逆境和生长发育阶段变化的生理需求。因此,研究miR169/NFYA模块的作用具有重要的理论与实际意义。
2 miR169/NFYA 模块在非生物胁迫中发挥作用
miR169/NFYA 模块响应盐、旱、高温、低温等非生物胁迫。油菜miR169 家族启动子中含有干旱诱导元件MYB、逆境胁迫响应元件TC-rich、脱落酸(abscisic acid,ABA)响应元件ABRE 等[17]。拟南芥[23]和玉米幼苗[18,24]暴露于干旱胁迫、盐胁迫及外源激素ABA 时,miR169 家族成员的表达受到强烈抑制,NFYA 家族基因的表达被强烈诱导,这种现象在玉米根中的表现尤为明显。在柑橘(Citrus sinensis)[25]、棉花(Gossypium hirsutum)[26]、小麦(Triticum aestivum)[27]等物种中,NFYA 家族也会受到盐分和干旱胁迫及外源激素ABA 的诱导。低氮条件下,拟南芥miR169 家族的表达也被强烈抑制,导致NFYA 基因的表达显著上调[28]。高温及低温胁迫会诱导拟南芥miR169 家族基因的表达[29]。
2.1 miR169/NFYA模块在干旱胁迫中发挥作用
由于全球气候变化,干旱已成为限制农作物产量的主要胁迫之一。植物受到干旱胁迫后,会通过激素信号传导产生生理生化反应,从而抵御干旱。施加外源ABA 可以提高植物包括干旱在内多种非生物抗性[30]。植物遭受逆境胁迫时,编码ABA 合成关键酶的NCEDs、ABAs基因表达量上升,植物体内ABA 含量增加[31]。当ABA 存在时,ABA 受体蛋白PYR/PYLs 与蛋白磷酸酶PP2Cs 结合并抑制其活性,从而解除PP2Cs 对蛋白激酶SnRK2s 的抑制作用,磷酸化转录因子ABFs 激活下游启动子中含ABRE元件的ABA 响应基因,通过促进叶片气孔关闭防止水分散失[32]和促进植物主根生长吸取更多水分[33]增强植物抗逆性。ABA 不敏感基因(ABA-insensitive,ABI)也在ABA 信号通路中发挥重要作用,其中,ABI1/2编码的PP2C 蛋白负调控ABA 信号传导。然而,被SnRKs 激活的B3 类转录因子ABI3、AP2类转录因子ABI4 和bZIP 类转录因子ABI5 则会正调控ABA 信号传导[31],例如ABI3[34]和ABI5[35]可激活编码亲水性蛋白LEA基因的表达,提高植物对渗透胁迫的耐受性。
miR169 家族参与植物抵御干旱胁迫,但其发挥的作用并不保守,miR169 对靶基因不同的调控方式使其发挥的作用不同。拟南芥miR169a 靶向切割抗旱正调控因子AtNFYA5,过表达miR169a株系与nfya5突变体表现出对干旱敏感相似的表型[23]。拟南芥miR169i/l 能够增强AtNFYA5 蛋白丰度,过表达miR169i/l 提高拟南芥的耐旱性[22]。大豆GmmiR169c 的靶基因GmNFYA3赋予大豆的耐旱性[14],且GmmiR169c 通过靶向切割AtNFYA1及AtNFYA5,降低拟南芥的抗旱性[19]。在油菜中沉默BnmiR169n 后,由于其靶基因BnNFYA8的增加,植物的耐旱性有所上升[36]。过表达SlmiR169c番茄(Solanum lycopersicum)降低了SlNFYA1、SlNFYA2、SlNFYA3和一个多药耐药相关蛋白基因(multidrug resistance-associated protein,SlMRP1)的表达,使得植物的抗旱性增强[37]。同样,过表达PtmiR169o杨树(Populus trichocarpa)通过靶向切割抗旱负调控因子PtNFYA6,增强了植物的抗旱性[38]。
在大豆、玉米、杨树、柑橘和棉花等物种中,一些在干旱胁迫中发挥作用的NFYA 家族成员未被报道受miR169 的调控。非生物胁迫下,它们的启动子活性增强。杨树NFYA9的启动子受盐、旱胁迫的诱导[39]。与野生型拟南芥相比,施加外源ABA 后,异源表达GmNFYA5[40]、GmNFYA13[41]以及PtNFYA9[39]的拟南芥萌发率更低,叶片气孔更加闭合;另一方面,转基因拟南芥受到干旱胁迫后存活率更高,体内ABA 积累更多。GmNFYA5、GmNFYA13 和PtNFYA9 会增加ABA 的合成,放大ABA 信号的传导,增强植物的抗旱性。NFYA 作为NFY 家族的一个亚族,需要与NFYB、NFYC 形成三聚体发挥作用,这两个亚族成员也会通过ABA依赖的方式增强植物的抗旱性[42]。大豆中NFY 家族成员会整合脱落酸信号调节植物的抗逆能力。NFYA16、NFYB2 和NFYC14 形成的三聚体可以提高PYR1的表达量,其编码的蛋白与ABA 结合后抑制PP2C 的积累,激活SnRK2,使之磷酸化ABFs 途径介导的ABA 信号传导,最终提高植物的耐盐和抗旱性[43]。杨树NFYB21可以提高FUSCA3(FUS3)的积累,激活NCED3的表达,使杨树根中积累更多ABA,从而增强主根的生长来抵御旱胁迫[44]。拟南芥NFYC9 及苔藓(Physcomitrella patens)NFYC1 也会与ABI3/5的启动子结合并增强其转录活性,提高LEA1 蛋白的积累增强植物的抗逆性[45-46]。这些文献报道证明NF-Y 转录因子家族成员与ABA 信号通路具有密切的关系,调控植物的抗逆性。也有NFYA 家族成员,如水稻NFYA7不受ABA 诱导,OsNFYA7通过ABA 非依赖途径参与植物赋予植物极强的抗旱性[47]。
2.2 miR169/NFYA模块在盐胁迫中发挥作用
miR169/NFYA 模块在盐胁迫中同样发挥作用。植物受到盐胁迫时,体内ROS 水平升高,解除ROS毒性对植物抵御盐胁迫有重要意义。盐胁迫下,玉米miR169q 的表达受到抑制,其靶基因ZmNFYA8表达上调。ZmNFYA8 与编码抗氧化物酶的基因ZmPER1启动子结合并激活其表达,减轻ROS 对植物的毒害作用,增强玉米的耐盐性[48]。经转录组和ChIP 分析,大豆NFYA 会与GmLOS2(渗透性反应低表达基因)、GmOMT(编码O-甲基转移酶基因)、GmXTH23-2(编码木葡聚糖内转葡萄糖基酶/水解酶基因)等盐响应基因启动子结合并激活其转录,赋予大豆耐盐性[49]。
ABA 也是盐胁迫中的一个重要信号传导因子,外源施加ABA 会产生更多的脯氨酸[31],提高抗氧化物酶活性[50],增强植物对盐的耐受性。前述GmNFYA13[41]和PtNFYA9[39]在拟南芥中过表达,同样通过增加ABA 合成和信号传导通路提高植物的盐耐性。值得注意的是,ABA 导致植物萌发期胚胎发育停滞,这被认为是提高幼苗在胁迫下存活的适应机制之一。相较野生型,过表达AtNFYA1的拟南芥在盐胁迫下会积累更多ABA,表现出严重的萌发后生长停滞,但这种盐敏感表型随着植物的生长逐渐消失[51]。与其他NFYA 家族成员不同,小麦NFYA10的表达受到盐胁迫及外源ABA 的抑制,过表达TaNFYA10的拟南芥抑制ABA 信号传导,使植物成苗期对盐胁迫敏感[27](表1,表2)。

表1 miR169/NFYA 模块参与植物的盐、旱胁迫Table 1 miR169/NFYA module involved in plant salt and drought stress

表2 NFYA 转录因子在盐、旱胁迫中发挥作用Table 2 NFYA transcription factors playing a role in salt and drought stress
大部分miR169 家族成员在植物受到逆境胁迫下的表达都会下调,而其靶向的NFYA 家族成员表达呈现上调,同时,NFYA 家族成员响应非生物胁迫也会受到自身启动子的调控。NFYA 与NFYB、NFYC 形成三聚体直接或间接正调控其下游ABA 合成基因(NCED3、ABA1、ABA2)、ABA 信号传导基因(PYR1、ABFs、ABI3和ABI5)赋予植物耐逆性。另外,NFYA 家族成员还会激活逆境响应基因(DREB1、WRKY4、MYB84、NHX1、SOS1、SALT3等)的表达增强植物对逆境胁迫的耐受性(图1)。
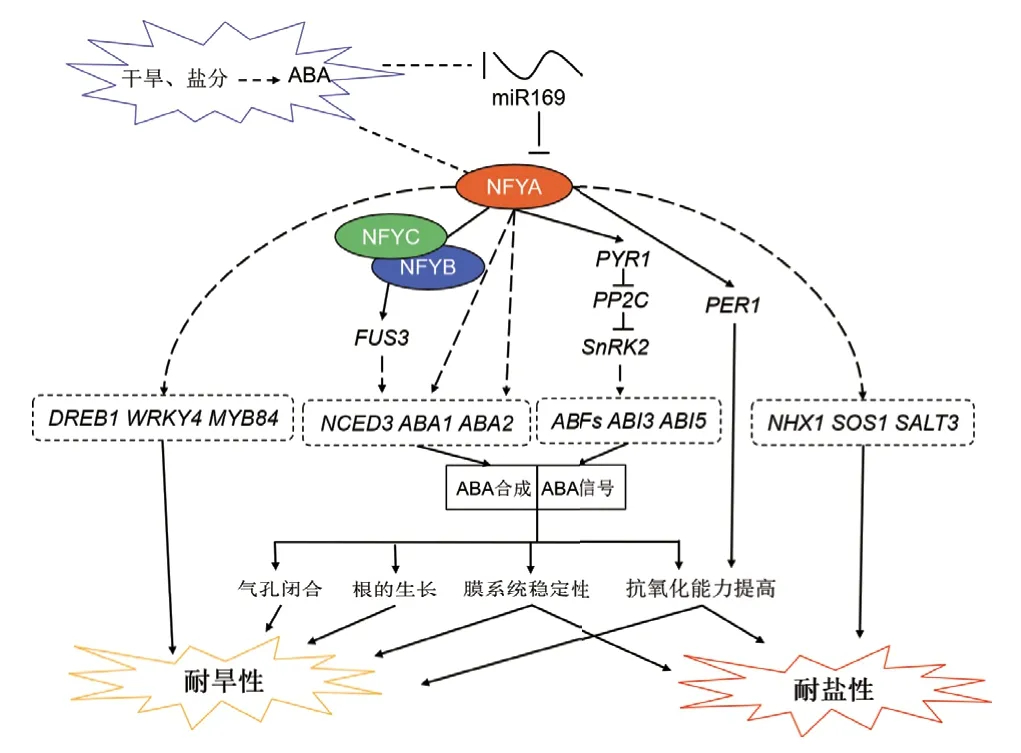
图1 miR169/NFYA 模块在植物盐、旱胁迫中的调控机理Fig.1 Regulatory mechanism of miR169/NFYA module in plants under salt and drought stress
3 miR169/NFYA 模块对植物生长发育的影响
植物应对逆境胁迫时,其生长发育也会受到影响。ChIP-seq 及RNA-seq 的结果表明,生长调节因子GRF1/3(growth-regulating factors1/3)通过调节防御和发育相关基因以及激素水平来平衡植物的生长与防御[53]。参与植物花发育的TOE3(target of early activation tagged)、ELF3(early flowering)可以提高植物的冷抗性及耐盐性[54-55]。miR169/NFYA 模块也参与植物的生长发育。
拟南芥应激条件下miR169m/o 表达量降低,导致其靶基因AtNFYA2/3/7/10的表达急剧上升。AtNFYA2/3/7/10 会抑制细胞伸长相关基因的转录,导致植物矮化、生长停滞、种子变小[56];拟南芥NFYA1/5/6/9 也有同样的功能[57]。miR169/NFYA 模块在植物花器官的发育中也起到了重要的作用。过表达miR169 的拟南芥中,其靶基因AtNFYA2的表达降低,导致提前开花。AtNFYA2 与开花抑制因子FLC(flowering locus C)启动子中的AACCT 元件结合并激活其表达,推迟植物的开花时间[58]。拟南芥NFYA8 与miR156 的启动子结合阻止植物幼苗向成苗转换,延迟植物开花时间[59]。
4 展望
本文综述了miR169/NFYA 模块参与植物非生物胁迫的作用机制。为了更好地利用候选基因改良作物的耐盐抗旱性,还有一些问题需要研究:(1)在一些极端耐盐、耐旱的植物中探讨miR169/NFYA 模块的作用机理或许可以得到更多信息。(2)miRNA常常有多个功能不同的靶基因,miRNA 对植物生理过程的调控是精细且复杂的。目前,对于miR169 靶基因的研究主要集中于NFYA 家族,可利用降解组测序技术更广泛地研究miR169 的靶基因网络,宏观了解其在植物体内的调控机制。(3)NFYA 在逆境胁迫中多发挥正向调控作用,但会使拟南芥具有晚花、种子变小等表型。将其作为候选基因进行抗逆分子育种,还需更深入研究。
