宫颈管内膜型宫颈原位腺癌临床病理特征分析
2023-01-05顾文贤程羽青高蔚华芬周晓莉王更芳
顾文贤 程羽青 高蔚 华芬 周晓莉 王更芳
宫颈原位腺癌(adenocarcinoma in situ,AIS)是宫颈恶性形态的腺上皮形成的上皮内病变,若不进行治疗则进展为浸润性腺癌的风险很大[1]。宫颈AIS 发病率低,临床病理医师对其认识并不充分。2020 版世界卫生组织(WHO)女性生殖系统分类中将宫颈AIS 分为人乳头瘤病毒(HPV)相关和HPV 不相关两类。虽然在2020 版WHO 分类中HPV 相关的宫颈AIS 不像2014 版WHO 分类中强调将其分为宫颈内膜型、复层产黏液型上皮内病变等亚型。宫颈管内膜型AIS 作为最常见的宫颈AIS 亚型,其病理特征及鉴别诊断等问题值得病理医师重视。本研究收集18 例宫颈管内膜型AIS 的临床病理资料进行分析,旨在提高病理医师对其的认识。现报告如下。
1 资料与方法
1.1 资料 检索并回顾性复习常州第二人民医院病理报告系统中2013~2019 年诊断为“AIS、宫颈腺上皮非典型增生、宫颈腺体上皮内瘤变”的患者情况,重新阅片,根据2020 版WHO 女性生殖系统肿瘤分类标准[1],筛选出18 例HPV 相关的宫颈AIS 患者,收集其临床病理资料,进行病理形态学观察并结合文献进行分析。
1.2 方法 标本均经4%中性甲醛固定,石蜡包埋。患者均行免疫组化,采用Roche Ventana Benchmark XT全自动免疫组化染色系统,抗体包括Ki67、P16(均购自罗氏诊断公司)。Ki67 阳性为细胞核着色,P16 阳性为细胞核和细胞质着色,>70%的病变细胞出现棕黄色颗粒判读为弥漫强阳性。
液基细胞学检测技术(TCT)检查液基细胞保存液按提取DNA 后进行实时荧光定量PCR 检测HPV DNA,使用DA7600 型核酸扩增实时荧光检测仪和HPV 核酸定量检测试剂盒(均购自中山大学达安基因股份有限公司),根据试剂盒说明书判读结果。
2 结果
2.1 临床资料分析 18 例患者年龄23~73 岁,中位年龄44.5 岁,平均年龄41.8 岁。10 例无自觉症状,仅因宫颈细胞学检查或HPV 检测异常而行活检,各有4 例出现接触性宫颈出血或异常阴道出血。其中3 例患者仅行宫颈活检,未在本院接受后续治疗;1 例患者活检诊断为宫颈管内膜型AIS 后直接行全子宫双附件切除术,3 例患者仅行宫颈锥切术治疗,11 例患者宫颈锥切术后行全子宫双附件切除术。
2.2 宫颈脱落细胞学检查分析 18 例患者在组织活检前均行宫颈液基细胞学检查,2 例报告为不能明确意义的非典型腺细胞,细胞学形态表现为细胞排列拥挤重叠、不规则,核浆比增大,细胞核拉长增大,细胞核深染伴染色质颗粒状,核膜不规则。其余患者中有2 例为高级别鳞状上皮细胞内病变,2 例为低级别鳞状上皮细胞内病变,3 例为不除外高级别鳞状上皮细胞内病变的非典型鳞状上皮细胞,4 例为不能明确意义的非典型鳞状上皮细胞,5 例患者细胞学检查阴性。
2.3 HPV 检测结果分析 15 例行HPV 检测的患者中,14 例HPV 阳性,进行HPV 分型检测的10 例HPV阳性患者中,6 例为HPV16 型阳性,4 例HPV18 型阳性。
2.4 组织病理学检查分析 宫颈锥切标本和全子宫切除标本宫颈巨检均未见有占位病变。镜检:低倍镜下宫颈腺体小叶状结构存在,部分宫颈管腺体上皮增生,细胞核增大拉长呈雪茄样、纺锤状,肿瘤细胞假复层或复层排列(见图1)。高倍镜下细胞核深染,细胞内黏液减少,核浆比增大,可见1~2 个小核仁;核分裂象1~3 个每高倍视野(见图2),可见凋亡小体。大多数受累腺体正常柱状上皮被肿瘤细胞完全替代,也有少数腺体仅部分上皮被肿瘤细胞取代,正常上皮与肿瘤上皮之间分界清晰(见图3)。受累腺体均局限于宫颈内1/3,不超过正常腺体分布深度。间质未见促纤维结缔组织反应。13 例伴有鳞状上皮高级别上皮瘤变(见图4)。
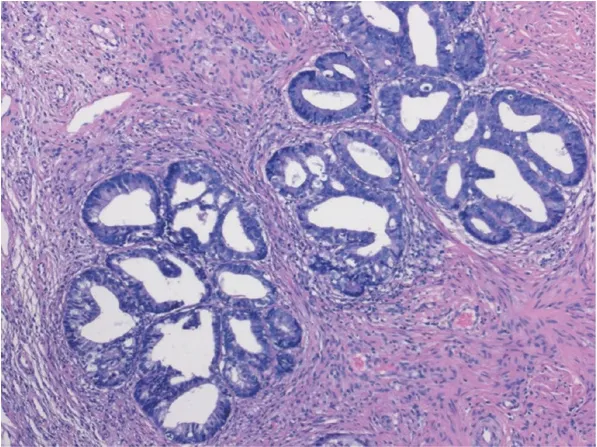
图1 肿瘤腺体保留小叶结构,腺上皮增生深染呈复层或假复层排列(100 倍放大)
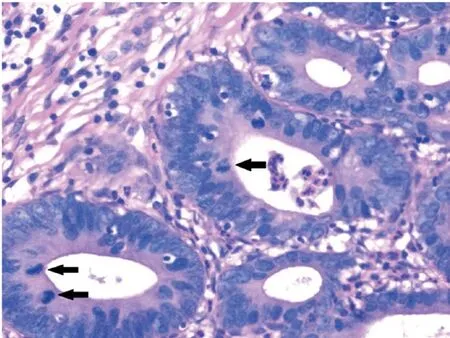
图2 肿瘤细胞核深染,细胞内黏液减少,核浆比增大,核分裂像易见。↑标示核分裂像(400 倍放大)

图3 肿瘤上皮与非肿瘤上皮之间截然转变(200 倍放大)

图4 宫颈管内膜型AIS 伴有高级别鳞状上皮细胞内瘤变。↑标示鳞状上皮细胞内病变,★标示宫颈管内膜型原位腺癌(200 倍放大)
2.5 免疫组化分析 18 例宫颈管内膜型AIS 的P16免疫组化染色均在腺癌细胞核、细胞质中呈现均一的弥漫性强阳性表达(见图5);Ki67 均在腺癌细胞核中呈弥漫强阳性表达(见图6),周围非肿瘤宫颈腺上皮呈阴性或散在个别细胞阳性表达。

图5 宫颈管内膜型AIS 弥漫强阳性表达P16,而周边的正常腺体无表达(100 倍放大)
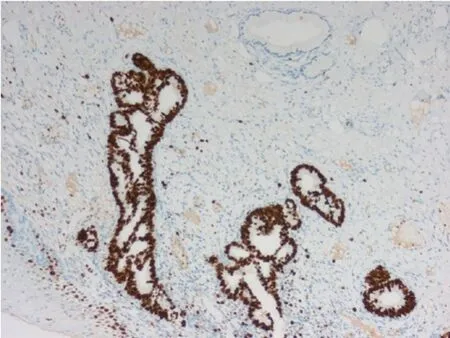
图6 宫颈管内膜型AIS 弥漫强阳性表达Ki67,而周边的正常颈管黏膜仅个别细胞表达(100 倍放大)
诊断:11 例活检诊断有宫颈管内膜型AIS,6 例在锥切标本中才发现AIS 成分,1 例仅在子宫切除标本中发现AIS。11 例锥切术后行全子宫双附件切除的患者中,7 例锥切标本切缘无AIS 累及的患者中有2 例在后续子宫切除标本中发现有残留AIS 病灶;4 例锥切标本切缘AIS 累及的患者在子宫切除标本中有2 例发现有残留AIS。
3 讨论
宫颈癌在我国女性恶性肿瘤发病率中居于第6 位[2]。随着宫颈癌筛查的广泛开展和HPV 疫苗的应用,经济发达地区宫颈鳞状细胞癌的发病率逐渐下降,但宫颈腺癌的发病率仍呈稳定或上升趋势。有报道称,美国宫颈腺癌占宫颈癌比例由1952 年的4.5%上升至2000 年的20%[3]。宫颈腺癌ⅠA1 期5 年生存率为100%,ⅠA2 期为93%,ⅠB 期为83%~89%,Ⅱ期生存率仅为49%。在日常工作中准确诊断宫颈AIS 并进行早期治疗对患者预后有非常重要的意义[1]。宫颈AIS分为宫颈管内膜型、肠型、子宫内膜型,还有一种罕见亚型为产生黏液的复层上皮内病变,以宫颈管内膜型最为常见。
宫颈AIS 患者年龄以35 岁较为多见,且呈现年轻化趋势。患者多无明显症状,少数患者出现接触性出血或排液等症状[4]。文献报道宫颈AIS 的阴道镜改变存在几种形式:类似不成熟转化区的乳头表现、扁平红白相间改变、隆起的致密浓厚醋酸白病变凸起在柱状上皮表面,这些改变都很轻微,也缺乏特异性,导致阴道镜检出宫颈AIS 十分困难,阴道镜发现病变多是AIS 伴发的鳞状上皮病变[5]。宫颈管内膜型AIS 通常起自颈管下部腺体,以腺体颈部为中心向表面黏膜及深部扩展,多数患者都会累及表面上皮和移行区附近的浅表腺体。目前认为AIS 起源于单个病灶,但在确诊时由于已发生水平和垂直播散,通常会累及宫颈多个象限和颈管上部[4]。
宫颈AIS 细胞学结构异常表现为细胞排列拥挤,无急性,可以表现为特征性的羽毛状边缘,也可以表现为假复层、合胞体、菊形团样;细胞核拉长、深染、染色质粗糙,细胞核浆比增大,约1/2 患者可见核仁,但显著的大核仁基本不存在于AIS 中。细胞质细颗粒状,嗜双染或嗜碱性,边界不清[6,7]。尽管AIS 细胞学具有以上特点,但细胞学检查对AIS 的检出率明显低于鳞状上皮病变。原因在于:AIS 通常发生于宫颈管内,且病变常累及深部腺体,细胞学检查取材主要取自宫颈外口的表面黏膜,难以取材到腺体病变区域;宫颈细胞学检查中腺上皮病变比例很低(<0.05%),且常混有多种形态类似的细胞,如反应性颈管细胞、内膜细胞、高级别鳞状上皮内病变细胞等,临床上细胞病理医师容易发生漏诊和误诊,且不同观察者之间判读腺上皮异常的重复性也很低。宫颈AIS 的正确判读率仅为50%,假阴性率可达6.9%[8-10],但宫颈细胞学筛查出鳞状上皮异常后因进行活检或治疗,同样有助于发现伴随的宫颈管内膜型AIS。本组患者仅2 例宫颈细胞学检查发现有倾向肿瘤的非典型腺细胞,形态学符合文献描述的典型表现,另有11 例是发现宫颈鳞状上皮病变进而在活检或手术切除标本中发现伴随的AIS。
宫颈AIS 的HPV 阳性率40%~90%,部分患者可能由于HPV DNA 拷贝数低而为阴性。感染的HPV 类型以HPV18 型最为常见,其次是宫颈鳞状上皮病变中最常见的HPV16 型[11]。本组行HPV 检测的患者93.3%为阳性,同文献报道一致,但以HPV16 型为主,可能与行分型检测的患者较少有关。5 例患者细胞学检查阴性而仅因HPV 阳性而进行活检发现宫颈管内膜型AIS,说明HPV 检测联合细胞学检查有助提高于宫颈腺癌筛查的灵敏度。
宫颈管内膜型AIS 组织学特点是宫颈腺体分叶结构存在,宫颈腺体或宫颈管黏膜被覆异型的柱状上皮细胞。肿瘤细胞形态同浸润性腺癌细胞一致,但无浸润。肿瘤细胞拉长,雪茄状,核深染,染色质粗糙,可见单个或多个核仁,核分裂像和凋亡小体易见。肿瘤细胞核浆比高,细胞内黏液可减少。肿瘤细胞排列成假复层或双/多层。肿瘤可以多灶或弥漫性累及腺体,也可仅累及一个腺体的部分上皮,肿瘤上皮与正常上皮之间分界清晰,受累的腺体结构可以无明显异常,也可以出现乳头状内折。肿瘤间质为正常宫颈间质[1,4,8,12,13]。由于宫颈管内膜型AIS 同宫颈鳞状上皮病变的致病因素均为HPV 感染,HPV 感染宫颈储备细胞后可以出现双向分化,HPV 感染的柱状上皮也可以发生鳞化,因此可以理解35%~69%的AIS 伴发宫颈鳞状上皮瘤变。偶有报道合并小细胞癌、微小偏离型腺癌或非典型类癌[6,14,15]。免疫组化显示,肿瘤细胞P16及Ki67 弥漫强阳性有助于诊断,约70%的宫颈管内膜型AIS 细胞质阳性表达癌胚抗原(CEA),而正常宫颈管腺体表达于腔缘或阴性[1,13]。
宫颈管内膜型AIS 的鉴别诊断:①反应性非典型腺体。宫颈管腺上皮在受到炎症刺激时可以出现类似于宫颈管内膜型AIS 的细胞形态变化。反应性或修复性增生的细胞核浆比增大,核仁明显。细胞核具有多形性,炎症刺激时宫颈管腺体储备细胞增生也可能形成假复层排列,但反应性增生的细胞核染色质呈污秽退行性改变,核分裂象难以找见。病变的间质大量急慢性炎症细胞浸润,病变上皮内也可见炎症细胞浸润。Ki67、P16 免疫组化染色不会出现弥漫强阳性。②子宫内膜异位症和输卵管上皮化生。两种病变细胞核浆比均较正常宫颈管高,细胞核染色较深,细胞可以出现假复层,会被误认为AIS。但子宫内膜异位症有子宫内膜样腺体和间质组成,输卵管上皮可见明显的纤毛细胞,都缺乏真正的细胞异型性,核分裂难以找到,P16斑驳状阳性,Ki67 不会出现弥漫强阳性表达。输卵管上皮化生和子宫内膜异位症Bcl-2 染色阳性,而AIS呈阴性或灶性阳性。③子宫内膜样腺癌。宫体下段的子宫内膜样腺癌可以蔓延至宫颈管,形态学也可以类似宫颈管AIS,在宫颈管搔刮物标本中有时难以分辨起源。利用免疫组化可以鉴别两者:子宫内膜样腺癌ER、PR、Vim 阳性,P16、CEA 阴性,而宫颈管内膜型AIS P16 弥漫阳性,CEA 大多阳性,Vim 阴性,ER、PR 表达不定。④早期宫颈浸润性腺癌。AIS 是否发生早期浸润不易判断,出现以下情况时要考虑存在早期宫颈浸润性腺癌:a.腺癌累及腺体超过正常腺体的最深部;b.腺癌累及的腺体出现于正常腺体范围外;c.腺癌累及的腺体周围出现促纤维结缔组织反应;d.癌细胞累及的腺体出现出芽、腺腔破碎或不完整、广泛的筛孔结构、腺体融合也提示浸润性腺癌。需要指出的是,虽然一般认为宫颈管腺体不超过宫颈内1/3 深度(<1 cm),但在纳氏囊肿、隧道样腺丛、中肾管残留等情况时,良性腺体可以出现在宫颈管深部甚至达外1/3。有研究指出20%的患者难以区分AIS 和早期浸润性腺癌[1,4,12,13]。
宫颈原位进展为浸润性腺癌的比例、进展为浸润性腺癌的时间间隔或自发消退的比例尚不明了。对无生育要求的宫颈管内膜型AIS 患者治疗一般采取全子宫切除术,对希望保留生育功能的患者可以使用锥切术(冷刀锥切或环形电切)保守治疗[16-18]。荟萃分析显示[19-21],16.5%经过锥切治疗的患者在第二次锥切或子宫切除的标本中发现残留病灶,尤其是锥切切缘阳性患者中,49.3%会发现残留病灶,5.9%会发现浸润性癌,同时,3%锥切切缘阴性的患者会出现复发,而切缘阳性的患者17%出现复发[3]。本研究中4 例锥切切缘有AIS 累及的患者在全子宫切除标本中有2 例发现AIS 残留,9 例锥切切缘阴性的患者中有2 例在后续子宫切除标本中发现癌残留,与文献描述一致。目前对AIS 的锥切治疗已经不再强调一定采用冷刀锥切或环形电切术,而重点在于锥切组织的完整性、切缘的可判读性[9]。锥切治疗AIS 患者完成生育后是否切除子宫仍有争议。
综上所述,宫颈管内膜型宫颈AIS 是临床较为少见的宫颈肿瘤,进行免疫组化检测有助于鉴别诊断。
