CYP2C19 基因多态性与沙利度胺联合治疗晚期胃癌化疗患者效果的关系研究
2023-01-05黄莉叶建明廖家华王祥财涂福平郭蒸
黄莉 叶建明 廖家华 王祥财 涂福平 郭蒸
胃癌是临床上常见的癌症类型之一,在我国恶性肿瘤的发生率及检出率中处于前列[1]。目前临床以化疗加靶向治疗方案为主。由于肿瘤是早期的全身性疾病,实体肿瘤的发生发展与血管生成高度相关。沙利度胺具有抑制肿瘤微血管、促细胞凋亡、免疫调节、降低转移等作用,并可增进患者食欲,改善肿瘤恶液质。CYP2C19 是一种药物代谢酶,参与包括沙利度胺、环磷酰胺在内的多种化疗药物代谢[2]。CYP2C19 基因变异导致功能多态性丧失,这影响着大约3%的高加索人。同时CYP2C19 具有显著的遗传多态性,可将其分为EM 和PM[3,4]。目前国内外关于低剂量沙利度胺中CYP2C19 基因多态性在晚期胃癌化疗患者治疗效果中差异的研究鲜有报道。基于此,本研究选取49 例晚期胃癌化疗患者为研究对象,比较不同基因型晚期胃癌化疗患者近远期疗效和不良反应情况。现报告如下。
1 资料与方法
1.1 一般资料 选取2017 年1 月~2019 年3 月本院收治的49 例晚期胃癌化疗患者为研究对象,按照化疗方案不同将患者分为XELOX 组(23 例)和XELOX 联合沙利度胺组(26 例),并根据CYP2C19 基因型不同,将XELOX 组患者分为单独化疗EM 组(13 例)和单独化疗PM 组(10 例),将XELOX 联合沙利度胺组患者分为药物联合化疗EM 组(17 例)和药物联合化疗PM 组(9 例)。四组一般资料比较,差异无统计学意义(P>0.05),具有可比性。见表1。
表1 四组一般资料比较(n,)

表1 四组一般资料比较(n,)
注:四组比较,P>0.05
1.2 纳入及排除标准 纳入标准:①经影像学及病理检查确诊为晚期胃癌,根据2010 年国际抗癌联盟/美国癌症联合委员会(UICC/AJCC)TNM 分期确定为Ⅲ~Ⅳ期;②年龄18~60 岁;③Karnofsky(KPS)评分≥70 分;④血常规、心、肝、肾功能正常;⑤无手术切除指征;⑥既往无手术、放化疗、生物等治疗史;⑦患者或家属已签署知情同意书。排除标准:有CYP2C19 抑制剂或拮抗剂用药史。
1.3 治疗方法 XELOX 组采用XELOX 方案化疗。化疗第1 天下午开始,给予患者静脉滴注奥沙利铂130 mg/m2,2 h;口服卡培他滨1000 mg/m2,2 次/d,共治疗14 d。XELOX 联合沙利度胺组在XELOX 组基础上联合沙利度胺治疗。于化疗第1 天开始睡前顿服沙利度胺片100 mg,1 周后若无不良反应,以每周为时间间隔,日剂量增加50 mg,直至日剂量增加至200 mg,连服21 d 为1 个疗程,2 个疗程后若无明显反应,可长期维持治疗。入选患者使用XELOX 方案进行化疗至少16 个疗程。
1.4 CYP2C19 基因型检测 DNA 提取:抽取患者外周血5 ml,运用DNA 抽提试剂提取DNA,并使用紫外分光光度计测定A260、A280、A320 nm 的光密度(OD)值,计算DNA 的浓度和纯度。
引物(上海sangon 公司):①CYP2C19*2 的引物:上游CAG AGC TTG GCA TAT TGT ATC,下游GTA AAC ACA CAA CTA GTC AAT G;②CYP2C19*3 的引物:上游AAA TTG TTT CCA ATC ATT TAG CT,下游ACT TCA GGG CTT GGT CAA TA。
CYP2C19 基因型检测:应用温度梯度聚合酶链反应(PCR)仪(德国Biometra 公司)和荧光定量PCR 反应测定DNA,于95℃下30 s、56℃下30 s 和65℃下45 s进行30 个循环,进行PCR 扩增,获得扩增曲线,用Ct值分析出基因型数据。
1.5 基因分型 根据CYP2C19 的基因型CYP2C19*2(681G>A,dbSNP rs424428) 和CYP2C19*3(636G>A,dbSNP rs4986893) 进行分类,分为:EM为无*2或*3(*1/*1),中间代谢(IM)为1个*2或*3等位基因即(*1/*2或*1/*3),PM为至少2个*2或*3等位基因(*2/*2、*2/*3 或*3/*3)。
1.6 观察指标及判定标准 比较不同基因型晚期胃癌化疗患者近远期疗效和不良反应情况。①近期疗效评估:于第2 个疗程结束后评估近期疗效,参照实体瘤疗效评估标准(RECIST)进行判定,主要包括完全缓解(CR)、部分缓解(PR)、无变化/稳定(SD)及进展(PD)。ORR=CR 率+PR 率,DCR=CR 率+PR 率+SD 率。②远期疗效评估:随访时间为12~36 个月,统计中位生存期和1 年生存率。③不良反应发生情况评估:根据抗癌药物急性及亚急性毒性反应分级标准进行评估。
1.7 统计学方法 采用SPSS16.0 统计学软件处理数据。计量资料以均数±标准差()表示,采用t检验;多组间行F检验;计数资料以率(%)表示,采用χ2检验。P<0.05 表示差异有统计学意义。
2 结果
2.1 四组近期疗效比较 单独化疗EM 组与单独化疗PM 组ORR 和DCR 比较,差异无统计学意义(P>0.05)。药物联合化疗EM 组与药物联合化疗PM 组ORR 和DCR 比较,差异无统计学意义(P>0.05)。见表2。
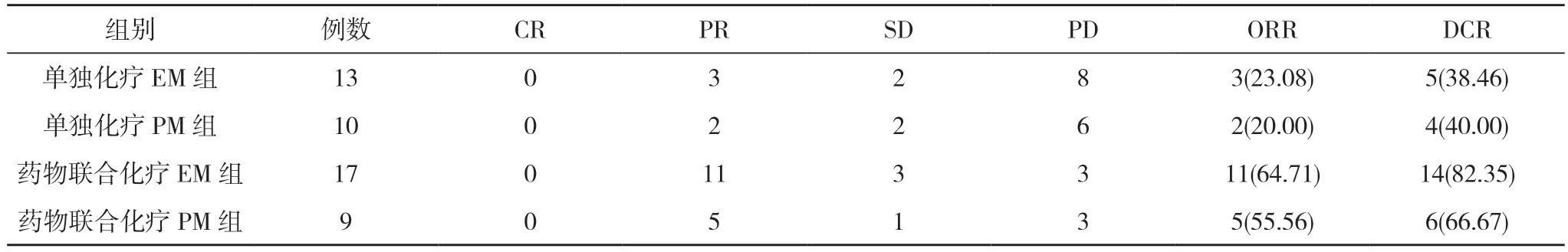
表2 四组近期疗效比较[n,n(%)]
2.2 四组远期疗效比较 随访12~36 个月,单独化疗EM 组与单独化疗PM 组中位生存期和1 年生存率比较,差异无统计学意义(P>0.05)。药物联合化疗EM 组与药物联合化疗PM 组中位生存期和1 年生存率比较,差异无统计学意义(P>0.05)。见表3。
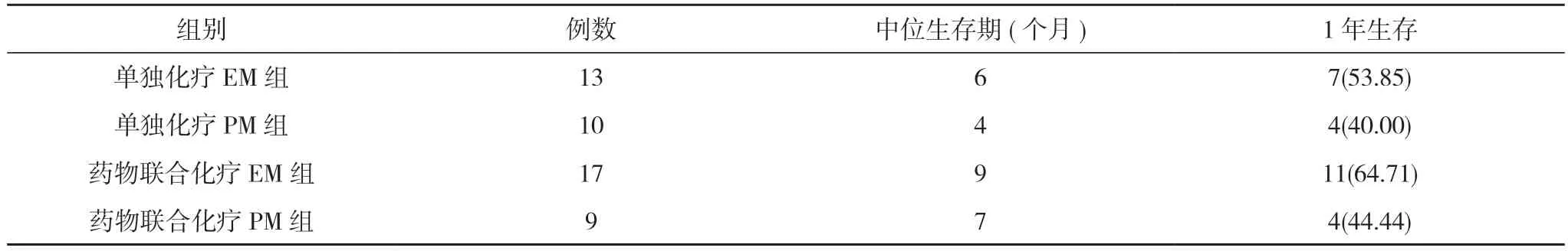
表3 四组中位生存期与1 年生存率比较[M,n(%)]
2.3 四组不良反应比较 单独化疗EM 组与单独化疗PM 组不良反应发生率比较,差异无统计学意义(P>0.05)。药物联合化疗EM 组眩晕和恶心呕吐发生率(35.29%、35.29%)显著低于药物联合化疗PM 组(77.78%、77.78%),差异有统计学意义(P<0.05);嗜睡、腹泻、肝功能损害及中性粒细胞减少发生率比较,差异无统计学意义(P>0.05)。见表4。

表4 四组不良反应发生情况比较[n(%)]
3 讨论
CYP2C19 是最重要的细胞色素P450 之一,被认为是许多致癌物和内源性化合物及结构不相关药物(如奥美拉唑、兰索拉唑、美芬妥英和西酞普兰)体内代谢的关键酶。依据S-美芬妥英的羟基化能力,机体被分为PM 和EM 两类,其中有两个主要的酶缺乏等位基因称为CYP2C19*2 和CYP2C19*3。遗传两个突变的CYP2C19 等位基因的个体,无论是同种(*2/*2,*3/*3)还是不同种类(*2/*3)都具有降低的CYP2C19底物代谢能力且是弱代谢者PM[5-8]。近年研究结果显示,CYP2C19 的PMs 基因型是发生癌症的危险因素。CYP2C19 多态性分布在不同种族人群之间不同。CYP2C19*3 多态性等位基因的频率在中国人群中为12%[9-12]。
沙利度胺具有复杂的免疫调节和抗炎特性,已被证明可以下调肿瘤坏死因子-α(TNF-α)和其他促炎细胞因子的产生,抑制转录因子核因子κB(NFκB),下调环氧合酶2,并抑制血管生成。在临床实验中其可有效改善人类免疫缺陷病毒相关的消瘦和活动性肺结核患者的体重减轻[13-15]。沙利度胺具有抗血管生成和免疫调节特性,最近已用于治疗人类恶性肿瘤[16-18]。沙利度胺有许多使其成为潜在有用抗癌剂的作用,包括抑制血管生成、调节粘附分子、抑制环氧合酶2、刺激免疫反应,以及抑制骨髓纤维化、骨髓增生异常综合征中的活性[19,20]。沙利度胺在体内的代谢主要通过CYP2C19 基因介导。
研究表明,胃癌晚期化疗患者使用XELOX+沙利多胺化疗法在疾病控制率、远期疗效和近期疗效方面较仅用XELOX 方法更有效,说明晚期胃癌于XELOX化疗基础上采用沙利度胺辅助治疗可有效提高患者生存率,这可能是受到CYP2C19 基因多态性的影响。在使用沙利多胺化疗药物的组内CYP2C19 基因多态性在影响有效率、疾病控制率、中位生存期、1 年生存率方面,有EM 组优于PM 组的趋势。在药物不良反应方面,EM 组比PM 组更能够改善化疗的恶心呕吐反应。通过基因检测筛选CYP2C19 基因EM 表型的患者,服用沙利度胺可以改善晚期胃癌化疗患者食欲减退、消瘦等肿瘤相关并发症状,而毒副作用等不良反应较小,患者在经济上较易接受。晚期胃癌化疗患者在治疗过程中通过基因检测PM 表型,联合使用沙利度胺值得临床进一步应用。
综上所述,CYP2C19 基因多态性对沙利度胺抗晚期胃癌的近远期疗效无明显影响,但EM 型患者能够部分耐受化疗后不良反应,对PM 型患者可在化疗方案中联合服用沙利度胺以提高疗效。
