剪切波弹性成像联合AKT1对判断局部晚期HER2阳性乳腺癌患者新辅助化疗效果及短期预后的预测价值
2023-01-04覃莉丽匡思杰王开权
覃莉丽,成 宏,匡思杰,王开权
(1.湖北省恩施自治州中心医院超声二科,湖北 恩施 445000;2.湖北省恩施自治州中心医院乳腺外科,湖北 恩施 445000)
乳腺癌是女性常见恶性肿瘤,人表皮生长因子受体2(human epidermal growth factor receptor-2,HER2)属表皮生长因子受体家族成员,HER2阳性乳腺癌患者生物学活性强,恶性程度高,预后较普通乳腺癌更差,更易发生治疗耐药现象,影响新辅助化疗(neoadjuvant chemotherapy,NC)效果[1]。尤其是对于局部晚期HER2阳性乳腺癌患者,因肿瘤分期晚,进一步影响NC疗效[2]。因而,对局部晚期HER2阳性乳腺癌患者NC疗效进行早期判断,对指导临床早期干预具有重要意义。剪切波弹性成像(shear wave elastrography,SWE)已在乳腺癌诊断中得到广泛应用,SWE定量参数既往多用于乳腺癌的诊断[3],推测SWE参数可能对判断NC疗效有积极作用。另外,丝氨酸/苏氨酸蛋白激酶(serine/threonine kinase,AKT)是磷脂酰肌醇3激酶下游直接靶蛋白,而AKT1则是AKT主要亚型,参与HER2阳性乳腺肿瘤的发生发展[4]。本研究收集124例接受NC干预的局部晚期HER2阳性乳腺癌患者作为研究对象,探讨SWE参数、AKT1表达水平对治疗效果和预后的预测价值。为临床干预提供参考。报告如下。
1 资 料 与 方 法
1.1一般资料 收集2019年5月—2021年5月局部晚期HER2阳性乳腺癌患者124例的临床资料。纳入标准:①患者均符合中国临床肿瘤学会乳腺癌专家委员会共识有关局部晚期HER2阳性乳腺癌诊断标准[5];②患者年龄≥18岁;③患者均接受NC治疗。排除标准:①对治疗药物过敏者;②既往已接受手术、放化疗、靶向治疗及其他抗肿瘤治疗者;③肿瘤复发患者;④预计生存期<3个月者。剔除标准:①主动放弃治疗,退出研究者;②随访失访者;③因意外死亡者。124例患者平均年龄(46.07±12.84)岁,体重指数21.29±1.51。
1.2方法
1.2.1治疗药物 多西他赛(湘北威尔曼制药股份有限公司,国药准字H20093967,规格2 mL:80 mg),卡铂(齐鲁制药有限公司,国药准字H20020180,规格10 mL:100 mg),曲妥珠单抗(Genentech Inc.,国药准字J20110020,规格440 mg/瓶),帕妥珠单抗(Genentech公司,批准注册证号:S20130015,规格420 mg/14 mL)。
1.2.2NC治疗方案 患者均接受TcbHP治疗方案(多西他赛+卡铂+曲妥珠单抗+帕妥珠单抗)。第1天:静脉滴注多西他赛 75 mg/m2,静脉注射卡铂 6 mg·mL-1·min-1),静脉滴注曲妥珠单抗,首剂8 mg/kg,以后6 mg/kg,静脉滴注帕妥珠单抗,首剂840 mg,以后420 mg。每21 d为1个周期,共6个周期。
1.2.3治疗效果评估 在治疗结束后4周评价疗效[6],记录病理完全缓解(pathological complete remission,pCR)发生率,以乳腺和腋窝均无浸润性癌灶残留为pCR。在治疗结束后进入随访,随访以电话形式进行,记录患者总生存时间,总生存时间为患者开始接受治疗至死亡时间或随访截止时间,记录患者1年生存率。
1.2.4SWE检查方法 患者均于治疗前接受SWE检查,检查时采用高频超声探头,探头频率5~10 MHz。患者取仰卧位,暴露双乳,先行双侧乳腺平扫,确定肿块位置,记录病灶回声特点,记录肿瘤病灶直径和血流速度。再将超声调整至弹性成像程序,启动实时双幅模式,放置3~5 s,图像稳定后测定乳腺病灶处的弹性模量值,测量3次后,取平均值。
1.2.5AKT1检测方法 取乳腺癌病理组织作为检测标本,采用石蜡切片,苏木精-伊红染色后脱蜡水化,将切片进行抗原修复,采用磷酸盐缓冲液进行冲洗,滴加3%过氧化氢溶液50 μL,温室孵育10 min,磷酸盐缓冲液冲洗3 min后滴加一抗50 μL,室温下孵育1 h,冷冻过夜后磷酸盐缓冲液冲洗,加EnVision试剂50 μL,显色后脱水拍照,记录检测结果。按显色颜色和阳性细胞数两项评分乘积记录结果,见表1。以两项乘积≥2分为AKT1结果阳性[7]。

表1 免疫组织化学评分结果Table 1 Immunohistochemical score results
1.3统计学方法 应用SPSS 20.0软件包分析数据。计量资料比较采用t检验,计数资料比较采用χ2检验,影响因素采用Logistic多因素分析,预测价值采用受试者工作曲线(receiver operating characteristic,ROC)分析,结果以曲线下面积(area under the curve,AUC)表示,生存分析采用Kaplan meier描述。P<0.05为差异有统计学意义。
2 结 果
2.1治疗结果 124例患者均完成NC治疗,随访期间,失访2例,入组122例,其中达到pCR38例,pCR率为31.15%。随访4~12个月,中位时间6.12个月,死亡40例,存活82例,1年生存率67.21%。
2.2不同疗效患者SWE参数和AKT1比较 pCR组弹性模量值和AKT1阳性率低于非pCP组,差异有统计学意义(P<0.05)。见表2,图1。
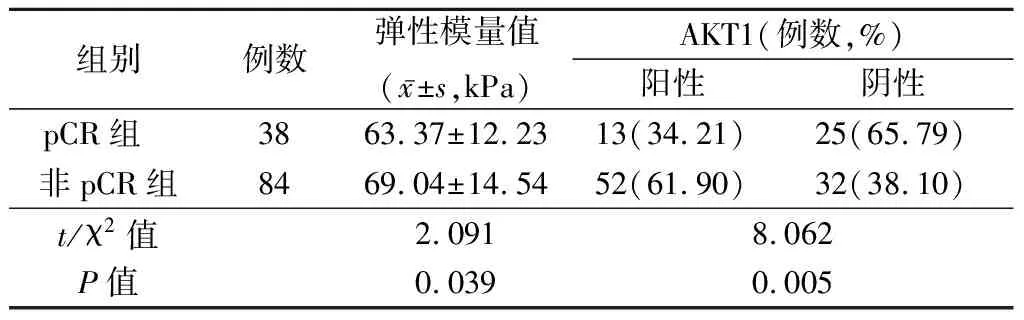
表2 不同疗效患者SWE参数和AKT1比较Table 2 Comparison of SWE parameters and AKT1 in patients with different efficacy
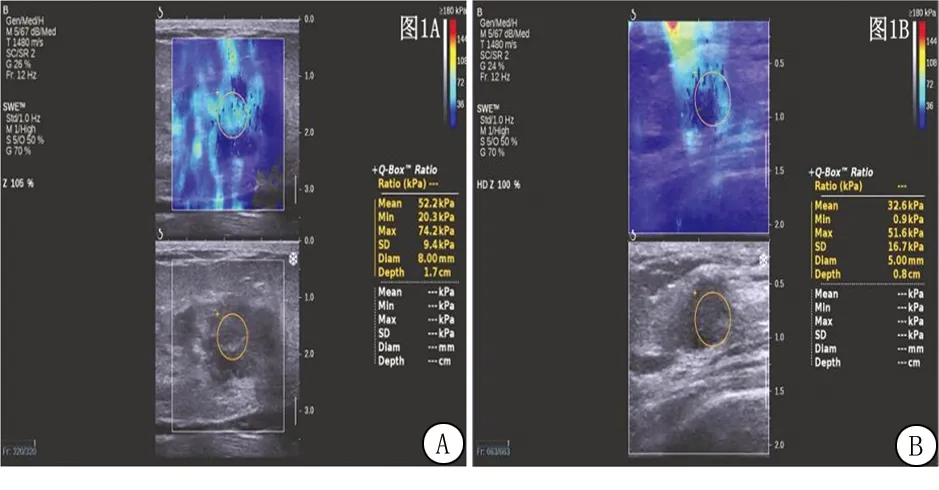
图1 不同疗效乳腺癌患者超声影像结果对
2.3不同疗效患者临床病理特征指标比较 pCR组与非pCR组患者病理分期及分化程度差异有统计学意义(P<0.05)。2组年龄、体重指数、肿瘤直径、病理分型差异无统计学意义(P>0.05)。见表3。
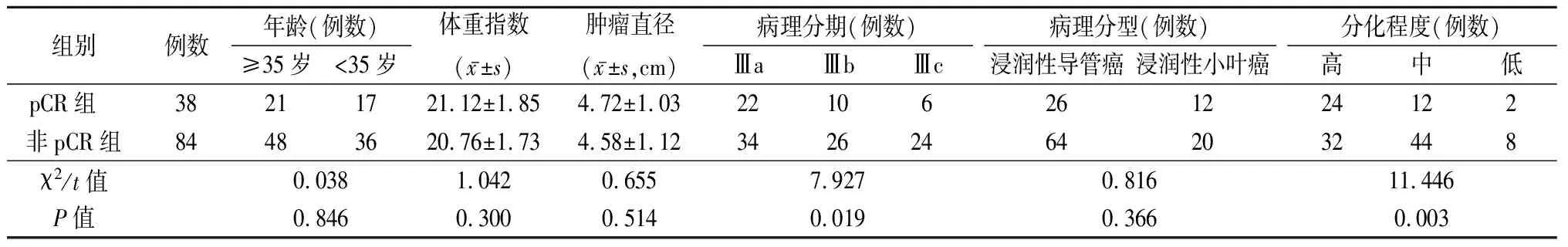
表3 不同疗效患者临床病理特征指标比较Table 3 Comparison of clinicopathological characteristics of patients with different efficacy
2.4HER2阳性乳腺癌NC疗效影响因素分析 以pCR为因变量,以病理分期、分化程度、弹性模量值、AKT1阳性为自变量,进行Logistic多因素回归分析,结果显示,分化程度、弹性模量值及AKT1阳性率是NC疗效的独立影响因素(P<0.05)。见表4,5。

表4 变量赋值表Table 4 The variable assignment table
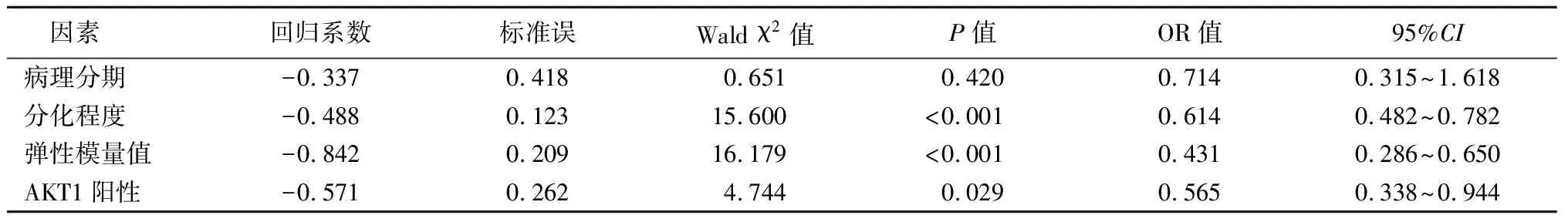
表5 HER2阳性乳腺癌NC疗效影响因素分析Table 5 Analysis of factors influencing the efficacy of neoadjuvant chemotherapy for HER2-positive breast cancer
2.5SWE参数、AKT1与患者治疗效果和预后分析 以弹性模量值+分化程度为联合预测概率1,以弹性模量值+AKT1为联合预测概率2,以弹性模量值+分化程度+AKT1为联合预测概率3,进行ROC分析,结果显示弹性模量值截断值为67.50 kPa,见图2,表6。联合预测概率2判断pCR的AUC显著高于分化程度(Z=-3.071,P<0.001)、弹性模量值(Z=-2.184,P=0.005)及AKT1(Z=-2.596,P<0.001)单项指标的AUC值。联合预测概率1与分化程度(Z=-0.978,P=0.169)、弹性模量值(Z=-1.161,P=0.134)及AKT1(Z=-1.075,P=0.105)单项指标AUC值比较,差异无统计学意义(P>0.05)。联合预测概率2与联合预测概率3判断pCR的AUC值比较,差异无统计学意义(Z=-0.687,P=0.395)。122例患者中,不同分化程度、弹性模量值及AKT1表达水平患者1年生存率比较,差异有统计学意义(Log rank χ2=4.114,5.699,4.418;P=0.043,0.017,0.036)。见图3。
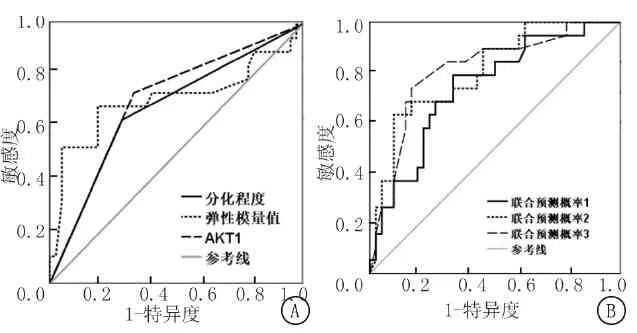
图2 单项与联合预测概率判断pCR的价值分析
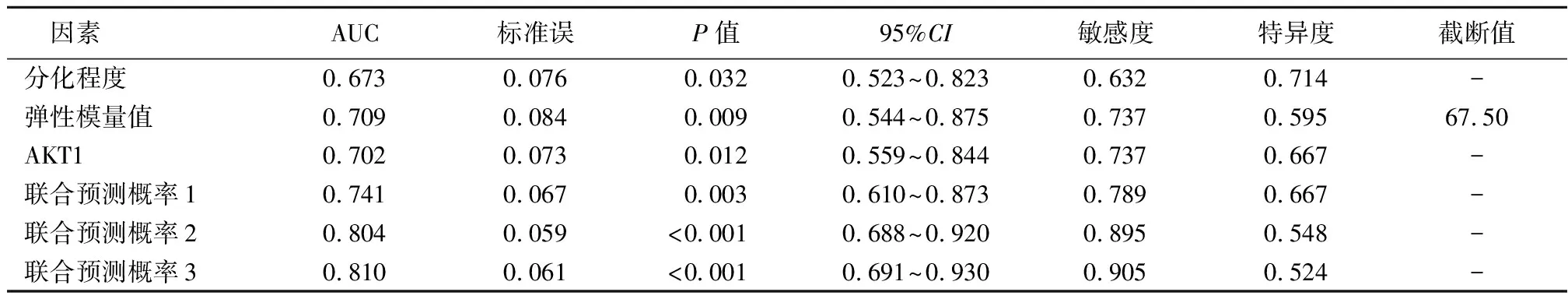
表6 影响因素判断pCR的ROC分析结果Table 6 ROC analysis results of pCR for determining influencing factors
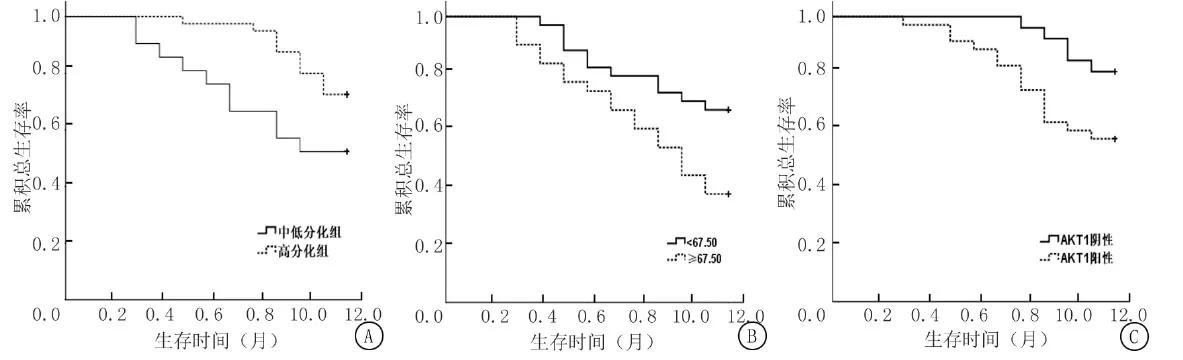
图3 不同病理特征患者1年生存率比较
3 讨 论
局部晚期HER2阳性乳腺癌患者预后差,NC是其主要治疗方案,已获得临床一致认可。多西他赛+卡铂+曲妥珠单抗+帕妥珠单抗化疗方案能有效抑制肿瘤生长,诱导肿瘤细胞凋亡,从而减小和消除肿瘤病灶[8-9],是局部晚期乳腺癌的一线化疗方案。另有回顾性研究也显示,多西他赛+卡铂+曲妥珠单抗+帕妥珠单抗方案能降低HER2阳性乳腺癌肿瘤分期[10]。本研究患者均采用这一化疗方案。但调查显示多西他赛+卡铂+曲妥珠单抗+帕妥珠单抗化疗方案的耐药性问题逐渐突出,近年来如何优化NC一直是临床关注重点[11]。pCR既可反映NC的短期化疗效果,又与患者远期生存效益相关[12]。因而,本研究采用多西他赛+卡铂+曲妥珠单抗+帕妥珠单抗化疗方案,并分析影响pCR的相关因素,以期为优化治疗方案提供思路。
研究结果显示,肿瘤分化程度是HER2阳性乳腺癌患者pCR的独立影响因素,这与既往报道一致[13]。肿瘤分化程度与肿瘤细胞增殖能力呈显著相关性,随着肿瘤分化程度的恶化,使细胞增殖和凋亡的平衡被打破,从而促进肿瘤的发生发展。刘芳等[14]乳腺癌肿瘤分化程度与肿瘤增殖/凋亡指数相关。另外,SWE检查实现了对肿瘤病灶的定量描述,本研究结果显示,弹性模量值与pCR相关,随着肿瘤恶化,肿瘤病灶间生成纤维致密组织,硬度逐渐增加,弹性降低,而癌细胞则呈现浸润性生长,使其与邻近正常组织的黏度降低,差异扩大[15]。因而,弹性模量值也能反映肿瘤恶性程度,这直接影响pCR率。通过检测弹性模量值,可为早期评估肿瘤病情,判断治疗效果提供依据。褚鑫等[16]研究显示,弹性模量值与细胞周期蛋白D1、基质金属蛋白酶2表达水平相关,提示细胞周期蛋白D1、基质金属蛋白酶2蛋白表达异常可使弹性模量值水平升高,增加肿瘤硬度,促进HER2阳性乳腺癌细胞增殖侵袭。
另外,AKT1可介导其下游信号分子哺乳动物雷帕霉素靶蛋白,从而加快细胞周期蛋白与细胞周期蛋白依赖激酶的结合。而抑制AKT1表达,阻断其磷酸化过程,可进一步下调哺乳动物雷帕霉素靶蛋白等下游蛋白分子,从而抑制局部晚期HER2阳性乳腺癌的恶性生物学行为[17-18]。目前已有学者推荐将抑制AKT1作为治疗HER2阳性乳腺癌的靶点,AKT1可能通过调控β-catenin蛋白水平,参与乳腺癌细胞的迁移增殖[19]。本研究多因素分析发现,AKT1表达阳性是pCR的独立影响因素,这可能是因AKT1表达水平能反映肿瘤增殖和恶性程度,从而为早期预测NC疗效提供依据,临床可根据AKT1检测结果,调整治疗方案。
本研究对比弹性模量值联合AKT1与单项指标判断pCR的准确度,结果显示,联合预测概率2的AUC值高于单项检测,而与联合预测概率3的AUC值差异无统计学意义,提示弹性模量值与AKT1两项指标联合方案与弹性模量值+分化程度+AKT1三项指标联合方案判断疗效的准确度相近,说明弹性模量值联合AKT1对判断化疗效果具有一定应用价值。此外,本研究对比不同临床特征患者1年生存率,结果显示不同分化程度、弹性模量值及AKT1表达水平患者1年生存率差异有统计学意义,这进一步证实弹性模量值和AKT1联合对判断化疗效果和临床预后具有重要作用。
综上所述,监测弹性模量值和AKT1水平有助于判断NC治疗局部晚期HER2阳性乳腺癌的效果和短期预后。
