绝热环境中碱对苯溶液中2,4-二氯过氧化苯甲酰热分解的影响
2023-01-04张兴赐林吉超胡东芳叶树亮
张兴赐,林吉超,丁 炯,胡东芳,叶树亮
1.中国计量大学,工业与商贸计量技术研究所,浙江 杭州 310018;
2.山东金特安全科技有限公司,山东 泰安 271028
硅橡胶材料是一种优良的绝缘橡胶材料,具有耐臭氧和耐高温等特点,是航空航天等国防尖端工业不可缺少的密封材料。但该材料最大的缺点是具有易燃性,因此需要性能良好的阻燃剂来增强其阻燃性,目前经常使用的阻燃剂是硫化剂。2,4-二氯过氧化苯甲酰(DCBP)作为一种硫化剂,使用其生产的硅橡胶尤其适用于导弹、航天器中密封圈及耐热胶管带。但是DCBP 属于有机过氧化物,受热易分解,并引发燃烧爆炸事故。为了安全生产与优化工艺条件,需要对DCBP 的热危险性进行研究。吕家育等[1]运用差示扫描量热仪(DSC)等温模式对DCBP 分解反应进行了研究,认为DCBP 的分解反应属于自催化反应。Cao 等[2]借助DSC 对DCBP 的热分解进行了研究,发现DCBP 在高温条件下会放出大量的热。此外,国内外涉及DCBP 热分解特性相关研究鲜有报道。有些自反应性物质自身的危险性不大,但当掺入杂质时其分解特性发生变化,本来反应活性较弱的物质变得非常活泼,甚至会发生灾难性的火灾和爆炸事故[3]。倪磊等[4]研究了含有FeCl3·6H2O 杂质的过氧化氢异丙苯(CHP)溶液的热危险性,认为FeCl3·6H2O 的存在提高了过氧化氢异丙苯的危险性;金满平等[5]研究了水和弱酸对过氧化氢异丙苯热危险性的影响,发现少量的水和弱酸会降低CHP 的起始放热温度、最大放热温度和活化能。DCBP 在生产应用中经常会接触到碱性物质,为了避免热安全事故的发生,有必要研究碱的存在对DCBP 热分解特性造成的影响。
绝热加速量热仪(ARC)是一种用于热安全评估的重要科学仪器,相较于差热分析仪(DTA)和热重分析仪(TGA)等量热仪器,其实验样品量更大,能更好地模拟化学物质在实际生产中发生热分解时的绝热环境[6]。目前,ARC 已广泛应用于精细化工和火炸药等化工产品的安全生产与风险评估领域。Zhao 等[7]通过ARC 研究和分析了过氧化二异丙苯(DCP)、20%(质量分数)过氧化二叔丁基(DTBP)等4 种自反应性物质的热分解特性;Arcady 等[8]通过ARC 对甲基丙烯酸甲酯(MMA)的热分解特性进行了测试与研究;Wu 等[9]基于ARC 和DSC 对1,3,5-三氟-2,4,6-三碘苯(TNPG)进行研究,发现ARC 测试结果与DSC 等温测试结果一致,即TNPG 热分解具有自催化特性。
DCBP 为粉末状固体,高温呈现非均相的熔融状态,量热学中通常要求被测样品为均相状态,因此,需要将DCBP 溶解在苯中,以便开展ARC 量热实验。本工作借助ARC 开展4 组不同热惰性因子的DCBP/苯溶液以及混有NaOH 的DCBP/苯溶液实验,结合无模型方法与动力学补偿效应对其热动力学进行研究。
1 仪器原理与热动力学计算方法
1.1 绝热加速量热仪相关理论
1.1.1 绝热加速量热仪结构
绝热加速量热仪结构如图1 所示,实验时待测样品放在样品池中,热电偶插入样品池内用于测量样品温度。量热仪通过保持炉体温度与样品温度一致来实现绝热状态。
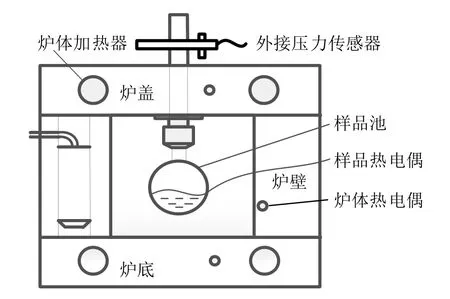
图1 绝热加速量热仪结构Fig.1 The schematic of the accelerating rate calorimeter
1.1.2 HWS 实验模式
绝热加速量热仪典型运行模式为“加热-等待-搜寻”,简称HWS 模式,模式的运行逻辑如图2 所示。首先仪器进入加热阶段(Heat),炉体被加热到预先设定的目标温度;然后仪器运转为等待阶段(Wait),等待炉体温度与样品温度热平衡;最后进入搜寻阶段(Search),在该阶段检测样品是否发生反应。样品发生反应时记录样品温度为T0,仪器进入绝热追踪状态,炉体温度追踪样品温度直到反应结束,反应结束温度记为Tf。在绝热加速量热的热分析领域,绝热追踪阶段的样品温度用来进行热动力学计算。

图2 绝热加速量热仪HWS 运行模式Fig.2 The HWS operation mode in accelerating rate calorimeter
1.1.3 动力学补偿效应
热分析动力学中反应速率与温度的关系可以用Arrhenius 方程来描述,与反应转化程度的关系可以用反应模型f(α)来描述。反应速率的一般形式如公式(1)所示:

式中:α为反应物的转化率,%;t为反应时间,s;T为样品温度,K;R为普适气体常数,其值为8.314 J/(mol·K);f(α)为反应模型;E为活化能,kJ/mol;A为指前因子,s-1。
动力学三因子“表观活化能、指前因子和反应模型”是热分析动力学研究的目的,理论上三者是相互独立的变量[10]。公式(1)做相应的变换,推导可得公式(2):

式中:j为不同的反应模型索引值;Aj为反应模型j对应的指前因子,s-1;Ej为反应模型j对应的活化能,kJ/mol;a和b为动力学补偿参数,a的单位是mol/kJ,b为无量纲。
公式(2)中当f(α)改变时,lnA和E之间存在着明显的线性关系,一般称之为动力学补偿效应。
1.1.4 热惰性因子
在绝热加速量热实验中,受限于仪器自身结构,样品释放的部分热量被样品容器吸收,从而使得反应进度显著减缓,导致热危险评估结果存在偏差。因此研究人员提出采用热惰性因子(ϕ)即样品和样品容器总热容之比来表示样品的绝热程度[11],ϕ值越接近于1 代表仪器绝热性能越好。

式中:Ms为样品质量,g;Cs为样品比热容,J/(g·K);Mb为样品池质量,g;Cb为样品池比热容,J/(g·K)。
1.2 热动力学计算方法
1.2.1 基于绝热加速量热的无模型动力学
传统的绝热动力学求解方法总是局限于单次量热数据的模型拟合法。根据国际热分析动力学学会(ICTAC)关于动力学求解的建议[12]可知,以单次量热数据进行动力学求解是存有风险的。因此,本工作考虑采用无模型方法进行绝热量热分析。
无模型方法采取最常用的Friedman 方法,其属于一种微分等转化率法,表达式如式(4)所示。

式中:i为不同的温控程序;ln(dα/dt)α,i表示转化率为α时的反应速率对数形式,ln(s-1);Aα为指前因子,s-1;Eα为活化能,kJ/mol;Tα,i为温控程序i下转化率为α时的样品温度,K。通过ln(dα/dt)α,i与-Tα,i-1的线性拟合,可以求解出活化能Eα。
不同于DTA 和TGA 等量热仪,ARC 在HWS 实验模式下,对于同一样品无法获得多组实验数据,无模型方法不适用于处理ARC 量热数据。但由于同一样品在不同热惰性因子下的热分解路径不同,通过公式(5)将温度转换成转化率,可以满足ARC 领域中应用无模型方法的条件[13]。

式中:Tonset为起始分解温度,K;Tfinal为反应结束温度,K。
另外,在ARC 领域中与DTA,TGA 等领域应用无模型方法求解动力学时i所代表的含义不同。对于DTA 和TGA 而言i代表不同的温控程序,对于ARC 来讲i的含义为不同的热惰性因子。所以在ARC 中应用微分等转化率法求解动力学时,需要结合公式(5)对公式(4)进行变换,变换后如公式(6)所示。
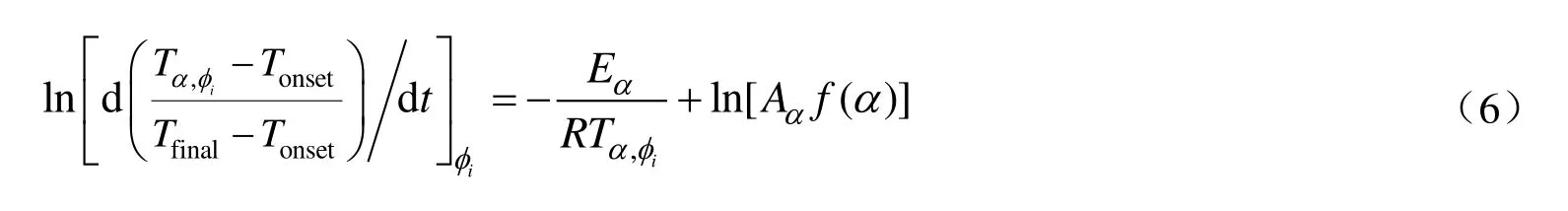
式中:Tα,ϕ i表示热惰性因子ϕi下转化率为α时的样品温度,K。
因此,在多组不同热惰性因子绝热量热数据基础上,根据公式(6)便可以实现在ARC 中应用微分等转化率求解热动力学。ARC 中应用微分等转化率法流程如图3 所示。
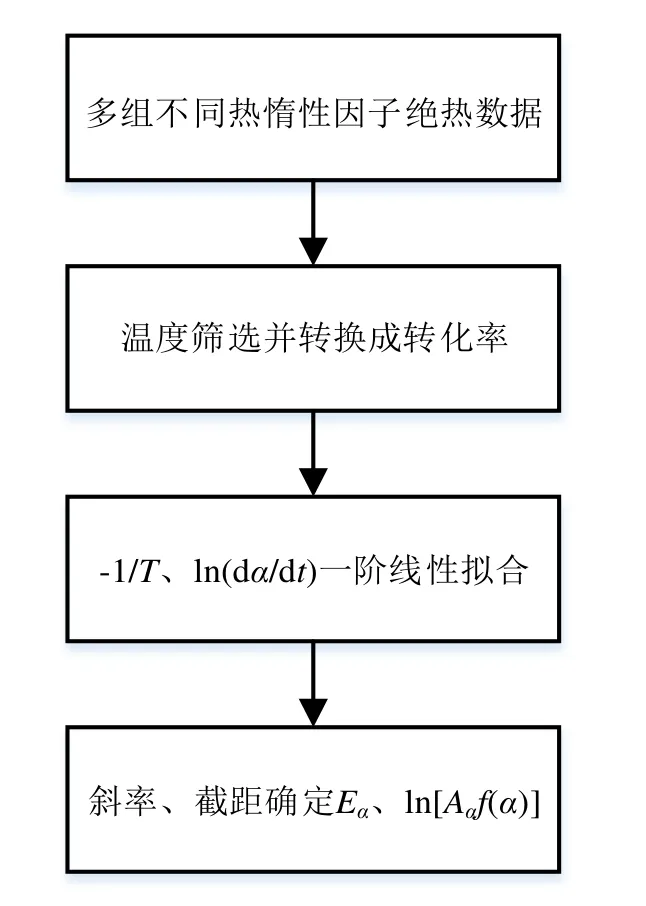
图3 ARC 应用微分等转化率法流程Fig.3 The procedure of differential isoconversional method used in ARC
1.2.2 无模型法和动力学补偿效应求解反应模型
为了解决传统绝热加速量热动力学计算时反应模型选择困难的问题,在本课题组前期研究中,提出了一种以3 组或4 组不同热惰性因子的绝热数据为基础,结合微分等转化率法结果与动力学补偿效应求解物质反应模型的方法[14]。
首先,在4 组不同热惰性因子的HWS 模式实验基础上,结合公式(6)通过微分等转化率法求得Eα。
其次,对公式(6)进行整理得到式(7)。在常用的物质分解模型中选择不同的反应模型与相关参数,计算出在每一个给定α下的[(dα/dt)/f(α)]。利用[(dα/dt)/f(α)]和-1/(RTα,ϕi)之间的线性拟合得到斜率与截距,斜率代表热惰性因子ϕi对应的活化能Eiϕ,截距代表热惰性因子ϕi对应的指前因子lnAiϕ。
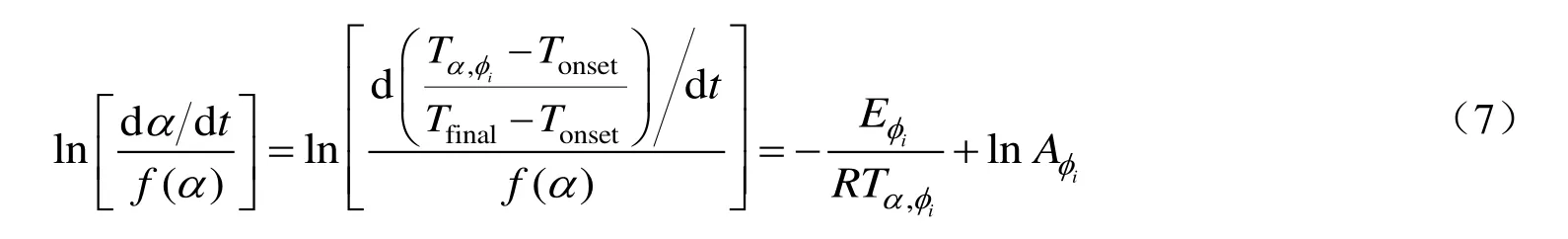
结合公式(8)所示的动力学补偿效应,对求解得到的(Eiϕ,lnAiϕ)参数组进行线性拟合,获得动力学补偿参数a和b。

根据公式(9),利用Friedman 方法求解的反应活化能Eα进一步求得指前因子lnAα。

根据公式(10),可以求解出反应模型f(α)的值。

最后,以自反应性物质常用反应模型为基础,结合公式(11)进行非线性回归。拟合度最佳对应的模型为所求物质的反应模型。

式(11)中:SS为残差平方和;N为数据总数;f(α)exp为实验求解出的反应模型数值;f(α)fit为选取的不同反应模型。
2 实验部分
配置DCBP 的质量分数为30%的苯溶液(30%DCBP/苯),将其与NaOH 质量分数分别为10%和30%的水溶液(分别计为10%NaOH/H2O 和30%NaOH/H2O)按一定质量比进行混合配置相关溶液。
绝热加速量热仪选用杭州仰仪科技有限公司生产的TAC-500A。样品池采用哈氏合金小球,小球质量为16.5 g,比热容为0.43 J/(g·K),容积为8.6 mL,实验模式为HWS 模式,温升台阶步长为5 ℃,反应起始温升速率检测阈值为0.02 ℃/min。
3 结果与讨论
3.1 30%DCBP/苯溶液热动力学参数计算
在ARC 的HWS 实验模式下,开展4 组质量分别为2.00,2.99,3.99 和4.99 g 的30%DCBP/苯溶液实验,热力学参数计算结果如表1 所示。4 组不同热惰性因子的30%DCBP/苯溶液温度时间曲线如图4 所示,图5 为其对应的ln(dT/dt)与-T-1关系曲线。由表1 中数据可知,30%DCBP/苯溶液在333.01~338.71 K 开始分解放热,起始分解温度较低,属于比较危险的有机过氧化物,所以在DCBP的使用及运输过程中应控制其温度。

图4 30%DCBP/苯溶液温度时间曲线Fig.4 Temperature time curves of 30%DCBP/benzene solutions
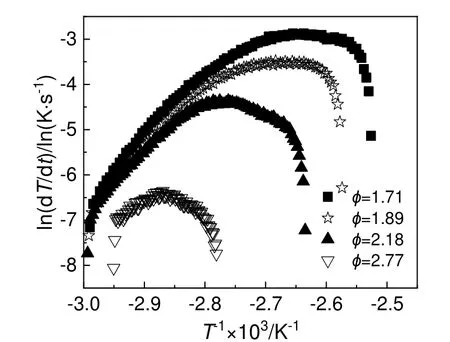
图5 30%DCBP/苯溶液ln(dT/dt)与-T-1 曲线Fig.5 ln(dT/dt) versus -T-1 curves of 30%DCBP/benzene solutions
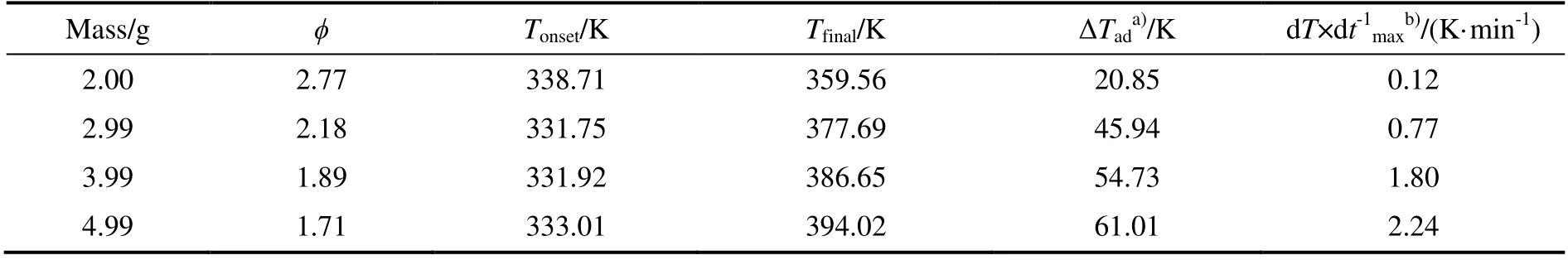
表1 30%DCBP/苯溶液热力学计算结果Table 1 Thermodynamic results of the 30%DCBP/ benzene solutions
采用无模型方法计算热动力学。在4组不同ϕ绝热量热实验基础上通过微分等转化率法计算得到30%DCBP/苯溶液活化能,结果如图6所示。根据ICTAC关于无模型方法求解动力学的建议可知,在α为0.1~0.9时,通过无模型方法计算得到Eα,若[(Eα)max-(Eα)min]>(10%-20%)(Eα)mean[其中(Eα)max、(Eα)min和(Eα)mean分别为α在0.1~0.9内Eα的最大值、最小值和平均值],则认为该反应为多步反应[15]。图6表明30%DCBP/苯溶液Eα在100~185 kJ/mol变动,说明30%DCBP/苯溶液分解反应为多步反应。
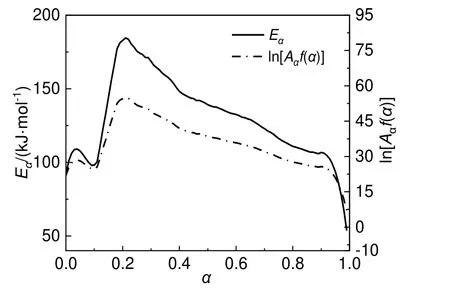
图6 30%DCBP/苯溶液的Eα 和ln[Aαf(α)]随转化率变化曲线Fig.6 The changes of Eα and ln[Aαf(α)]of 30% DCBP/benzene solutions with conversion
同时,鉴于实验的起始和结束阶段,测量结果受仪器噪声影响较大,热惰性因子愈接近于1,仪器绝热性能愈佳。所以选择热惰性因子最小的那组实验数据进行后续分析。在ϕ为1.71 的30%DCBP/苯溶液分解实验中,选择α为0.2~0.8 的量热数据,以表2 中14 个反应模型为基础求解出14 对动力学参数组(Eα,lnAα)。对动力学参数组线性进行拟合,拟合结果如图7 所示,该曲线线性拟合较好,动力学补偿参数a和b分别为0.336 4 mol/kJ 和-7.333 3。
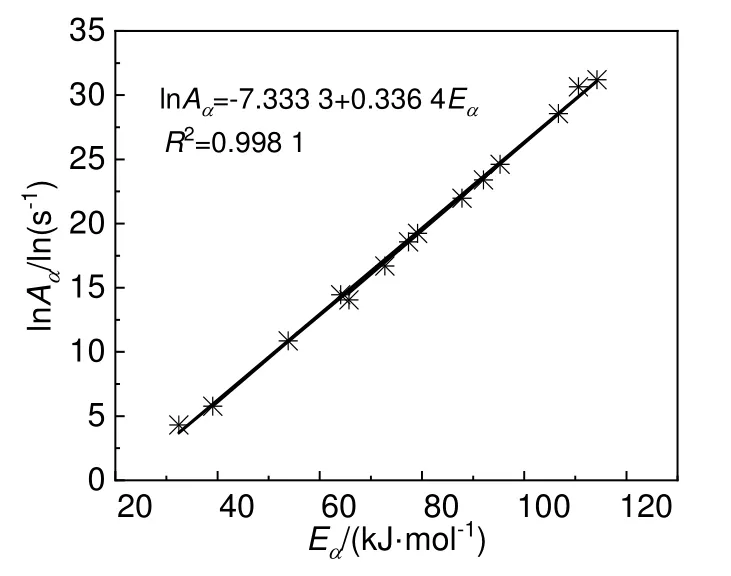
图7 30%DCBP/苯溶液中lnAα 与Eα 的关系曲线Fig.7 Correlation between lnAα and Eα of 30%DCBP/benzene solutions

表2 动力学求解中常用的物质分解模型Table 2 Some widely used reaction models in self-reactive chemicals thermal decomposition kinetics
绝热量热反应模型辨识结果。结合式(9)~式(11)可以计算出DCBP/苯溶液反应模型f(α)的值,以n级模型和自催化模型为基础分别拟合f(α),拟合结果如图8 所示。由图8 可知,自催化模型拟合效果最佳,所以可以判断DCBP/苯溶液的分解反应模型为自催化模型,其f(α)表达式如式(12)所示。
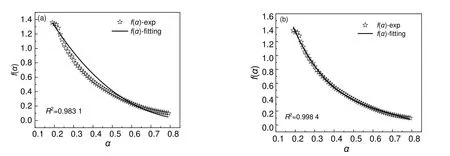
图8 反应模型拟合结果Fig.8 Fitting results of reaction models
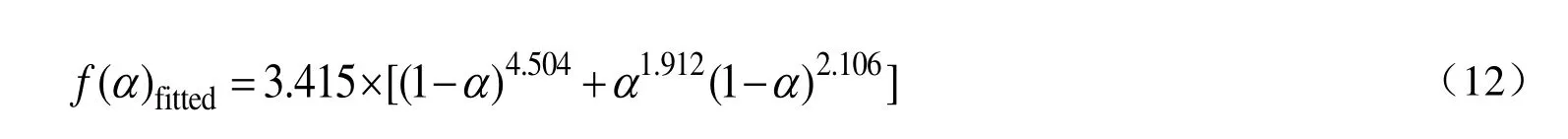
由于本工作选用DCBP/苯溶液作为绝热量热实验样品,其中苯作为有机溶剂在测试范围内不参加反应,所以DCBP 的分解反应模型与DCBP 苯溶液分解反应模型相同均为自催化模型。关于DCBP/苯溶液模型辨识结果与文献[2]中报道的DCBP 属于自催化反应模型一致。
3.2 30%DCBP/苯/NaOH 热动力学参数计算
为了研究碱对DCBP/苯溶液热分解特性的影响,将30%DCBP/苯溶液与NaOH 质量分数分别为10%和30%的水溶液与按质量比为10:1 的比例进行混合配制成杂质溶液。选择质量分别为2.00,3.00,3.99 和4.99 g 的混合溶液样品进行HWS 模式实验,其热力学计算结果如表3 所示,图9~图12 分别为混有不同浓度NaOH 的30%DCBP/苯溶液温度与时间曲线及对应的ln(dT/dt)与-T-1曲线。
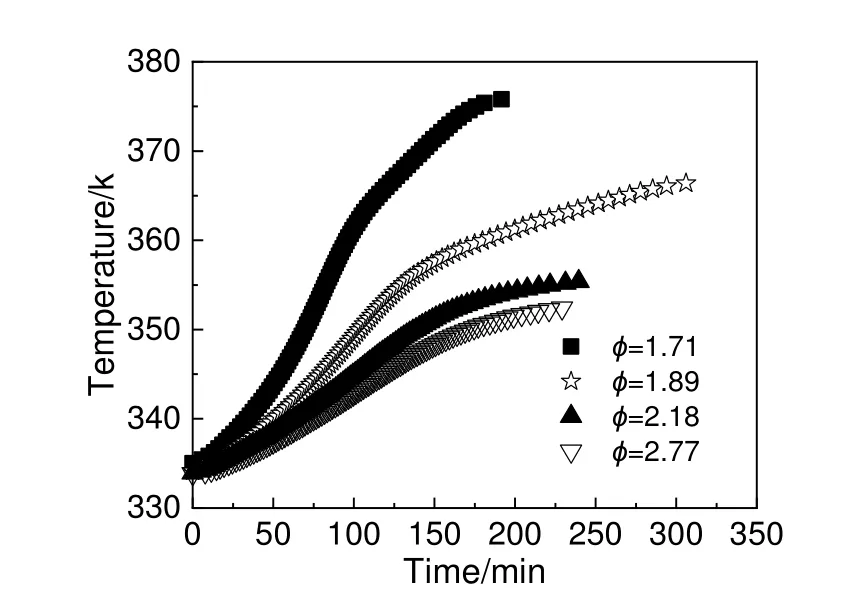
图9 混有10%NaOH/H2O 的30%DCBP/苯溶液温度时间曲线Fig.9 Temperature-time curves of 30%DCBP/benzene solutions with 10%NaOH/H2O

图10 混有10%NaOH/H2O 的30%DCBP/苯溶液ln(dT/dt)与-T-1 曲线Fig.10 ln(dT/dt) versus -T-1curves of 30%DCBP/ benzene solutions with 10%NaOH/H2O
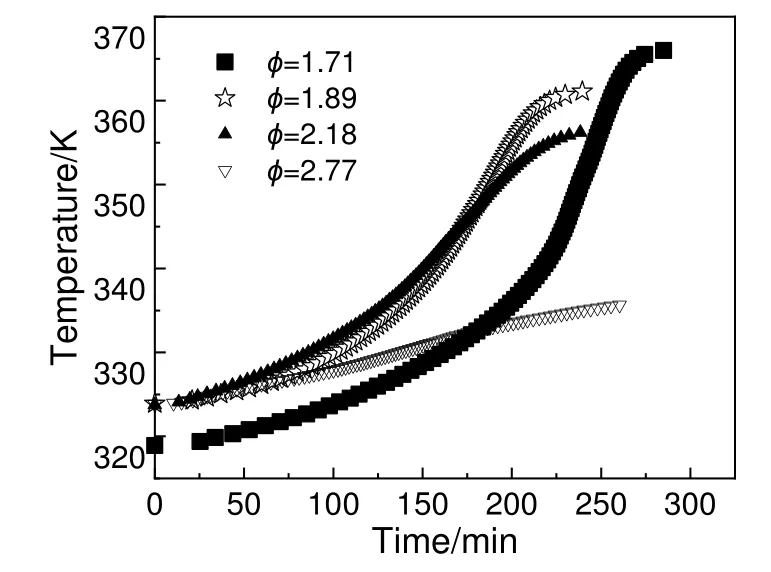
图11 混有30%NaOH/H2O 的30%DCBP/苯溶液温度时间曲线Fig.11 Temperature-time curves of 30%DCBP/benzene solutions with30%NaOH/H2O

图12 混有30%NaOH/H2O 的30%DCBP/苯溶液ln(dT/dt)与-T-1 曲线Fig.12 ln(dT/dt) versus -T-1 curves of 30%DCBP/benzene solutions with 30%NaOH/H2O

表3 30%DCBP/苯溶液和不同浓度NaOH 混合热力学计算结果Table 3 Thermodynamic results of the 30%DCBP/benzene solutions with different NaOH concentration
由表1 和表3 中热力学参数计算结果对比可知,NaOH 的加入使得DCBP/苯溶液分解反应放热更均匀,绝热温升减小,最大瞬时放热降低。碱性物质存在的DCBP/苯混合溶液热分解反应的最大温度降低是因为加入的是NaOH 水溶液,导致ARC 加热过程中一部分热量被水吸收。然而伴随NaOH浓度的增大,DCBP/苯溶液起始分解温度降低,热危险性增大,更容易引发热失控,因而在DCBP 的使用和运输过程中应尽量避免碱性物质与其混合。
基于微分等转化率法求解出混有10%NaOH/H2O 的30%DCBP/苯溶液Eα和ln[Aαf(α)]的值,计算结果如图13 所示。由图13 可知,NaOH 的存在使得30%DCBP/苯溶液的活化能明显降低,说明NaOH对DCBP/苯溶液的分解反应具有促进作用。
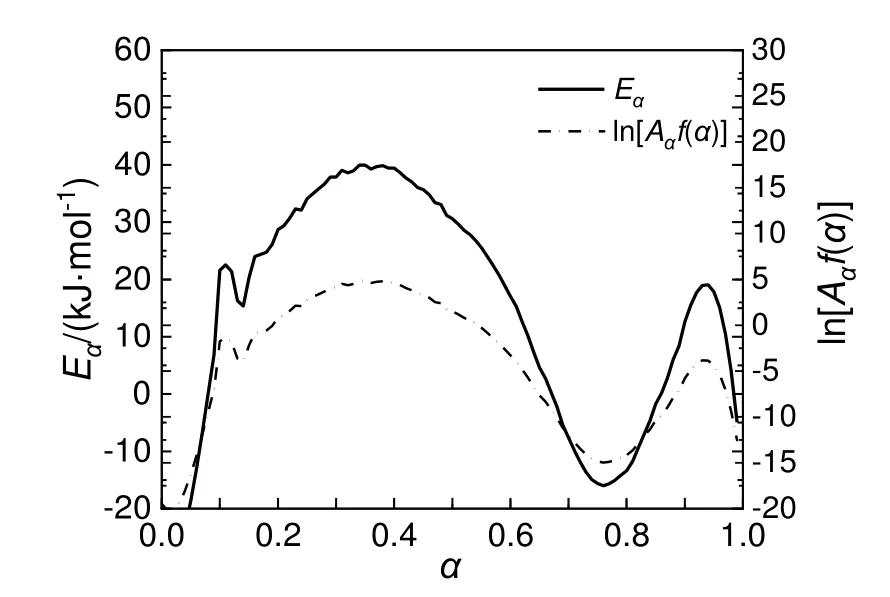
图13 混有10%NaOH/H2O 的30%DCBP/苯溶液Eα 和ln[Aαf(α)]曲线Fig.13 The curves of Eα and ln[Aαf(α)] of 30%DCBP/benzene solutions with 10%NaOH/H2O
图14 为根据式(7)和式(8)计算出的动力学补偿曲线,由图可知混有10%NaOH/H2O 的30%DCBP/苯溶液lnAα与Eα之间具有明显的动力学补偿效应,动力学补偿参数a为0.343 1 mol/kJ,b为-8.256 3。

图14 混有10%NaOH/H2O 的30%DCBP/苯溶液lnAα与Eα的关系曲线Fig.14 Correlation between lnAα and Eα of 30%DCBP/benzene solutions with 10%NaOH/H2O
然后,以自催化模型为基础拟合混有10%NaOH/H2O 的DCBP/苯溶液反应模型f(α)值,结果如图15(a)所示。由图可知,拟合效果与不混有NaOH 时的f(α)拟合效果相比较差。说明NaOH 的加入使得DCBP/苯溶液的反应模型发生了变化,变得更为复杂。采用高斯模型进行拟合,结果如图15(b)所示。由图可以看到拟合效果很好,因此10%NaOH/H2O 的30%DCBP/苯溶液最佳反应模型可以用高斯模型描述,反应模型数学表达式如公式(13)所示。
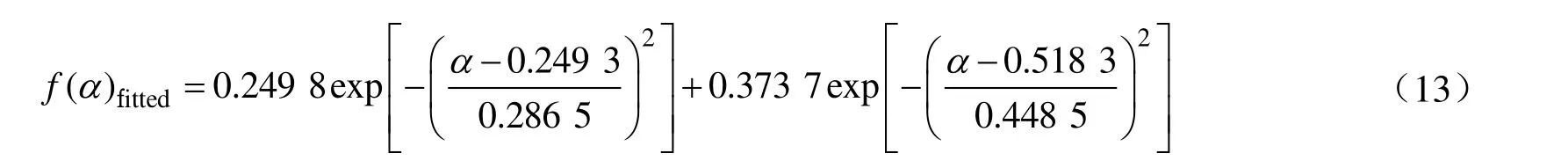
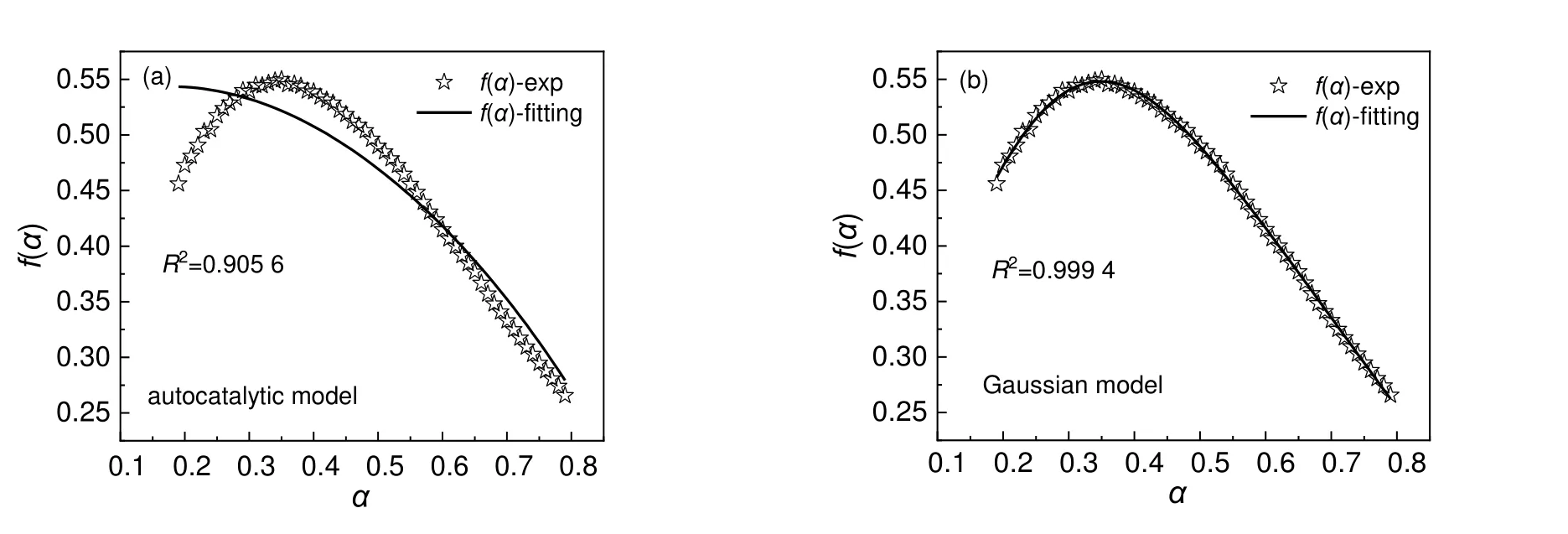
图15 混有10%NaOH/H2O 的30%DCBP/苯溶液的f(α)曲线Fig.15 f(α) curve of 30%DCBP/benzene solutions mixed with 10%NaOH/H2O
为了验证高斯模型对混有30%NaOH/H2O 的30%DCBP/苯溶液分解反应模型的匹配性,分别以自催化模型和高斯模型去拟合混有30%NaOH/H2O 的DCBP/苯溶液反应模型f(α)值,结果如图16 所示。对比图16 的拟合效果可知,高斯模型拟合效果最佳,自催化模型拟合效果较差,进而可以推断高斯模型对于混有30%NaOH/H2O 的30%DCBP/苯溶液分解反应模型仍然适用。
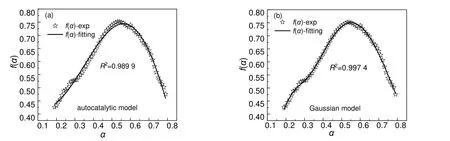
图16 混有30%NaOH/H2O 的30%DCBP/苯溶液的f(α)曲线Fig.16 f(α) curve of 30%DCBP/benzene solutions mixed with 30%NaOH/H2O
通过上述绝热量热反应模型辨识结果可知,NaOH的存在会使得DCBP/苯溶液分解反应模型发生改变。DCBP属于有机过氧化物,其中的过氧键(O—O)比较脆弱,极不稳定,受热易分解,随温度升高热分解加剧。DCBP/苯溶液发生热分解时,主要是其O—O的断裂,当碱性物质存在时,氢氧根离子会攻击DCBP的O—O,使得过氧键更容易断裂[16],加速自由基的生成,因此NaOH的存在使得DCBP/苯溶液分解的活化能降低,同时使得其反应模型发生变化。
综上所述,本工作中的热动力学计算方法既可以解决传统绝热分析中基于单次量热数据分析带来的风险性,同时也能有效解决无模型方法无法求解反应模型的缺陷,为绝热量热复杂热分解反应动力学计算提供一种新的思路。
4 结 论
基于4 组不同ϕ下的DCBP/苯溶液绝热加速量热实验数据,结合微分等转化率法与动力学补偿效应,对比分析了DCBP/苯溶液与混有NaOH 后DCBP/苯溶液的热分解特性,得出碱性物质对DCBP/苯溶液的热分解特性造成的影响有以下几点:
a)从反应动力学的角度来看,碱性物质如NaOH 的加入,会使得DCBP/苯溶液的活化能明显降低说明碱性物质的存在使得DCBP/苯溶液的分解反应更加容易。
b)从反应热力学的角度来看,碱性物质的存在,使得DCBP/苯溶液的分解速率和绝热温升降低,说明热失控的严重度降低;碱的浓度越大,DCBP/苯溶液的起始分解温度越低,热分解稳定性减弱。
c)从反应模型的角度来看,DCBP/苯溶液的分解反应为自催化反应,但是碱性物质的加入使得分解反应更加复杂。
d)从热安全的角度来看,对于DCBP 而言,其热分解特性与DCBP/苯溶液一致,因此在DCBP的使用与运输过程中应控制其温度,同时避免DCBP 中混入碱性物质。
