HIV-1原发性耐药国内外研究进展*
2023-01-04曹旭健综述余维维曾紫微彭勇权审校
曹旭健 综述,曹 静,祁 慧,余维维,曾紫微,彭勇权,王 敏△ 审校
(1.南华大学衡阳医学院/长沙市第一医院研究生协作培养基地,湖南 衡阳 421001; 2.长沙市第一医院艾滋病研究所,湖南 长沙 410000)
获得性免疫缺陷综合征(AIDS)是由人类免疫缺陷病毒(HIV)感染引起的一种慢性传染性疾病。HIV通过攻击人体免疫系统CD4+T淋巴细胞,导致其数量减少和功能缺陷,使机体逐渐丧失免疫功能,引起各种机会性感染及恶性肿瘤。截至2020年底全球共存活3 770万HIV感染者/AIDS患者(HIV/AIDS),其中2 750万人正在接受联合抗逆转录病毒治疗(cART)[1]。cART可最大限度地抑制病毒复制,重建患者免疫功能,从而延缓病程进展,提高患者生活质量,大幅降低了患者病死率[2]。
自从2006年“四免一关怀”政策在我国实行以来,越来越多的HIV/AIDS接受了正规检测与治疗,cART覆盖范围逐渐扩大。该政策极大地降低了我国AIDS患者病死率,对我国AIDS防治工作带来巨大帮助。然而,随着抗病毒治疗不断推广应用,原发性耐药(PDR)也不断增加。现将HIV-1 PDR产生机制、检测技术、现况、对治疗结局的影响、患者管理策略等研究进展综述如下。
1 HIV-1 PDR产生机制
HIV包括HIV-1和HIV-2,二者均属于HIV组,在进入细胞后的复制机制、传播方式、临床结局(最终发展成为AIDS)等基本相同[3]。然而HIV-1毒株在世界广泛传播,而HIV-2的流行主要局限于西非及某些欧洲国家(葡萄牙、法国)[4]。因此,学者主要针对HIV-1 PDR情况进行了研究。
HIV-1耐药性是在病毒自身因素及抗病毒药物选择压力作用产生的[5]。HIV-1作为RNA病毒具有高度遗传变异性,进入细胞后需要在逆转录酶作用下将RNA逆转录为cDNA,而参与HIV-1复制的逆转录仅具有DNA聚合酶的合成功能,缺少校正功能,因此,HIV-1复制具有易错倾向,平均每轮复制每个基因组约产生0.2个碱基变异[6-7],并且HIV-1具有高复制率,每天能产生1010~1012个新病毒[8],导致产生的碱基变异快速累积和放大。另一方面,随着cART的普及,在药物的选择压力作用下野生毒株与耐药毒株失去平衡,耐药毒株成为优势毒株,最终对抗病毒药物产生耐药。病毒复制程度及抗病毒药物的选择压力均可导致耐药突变(DRM)的产生和累积[9],发生耐药的HIV-1毒株可在人群中传播,导致新确诊的HIV-1感染者在进行抗病毒治疗前就存在了耐药毒株感染,即PDR,又称为传播性耐药。而获得性耐药(ADR)是指在患者治疗过程中药物选择压力作用下病毒基因突变导致的耐药。据文献报道,PDR可导致抗病毒治疗失败,加重治疗负担[10-11]。PDR的发生会降低抗病毒药物疗效并限制cART方案的选择;对患者而言,一旦出现PDR,所负担的治疗费用及病死率均将增加;对社会而言,PDR毒株的传播不利于HIV/AIDS疫情防控。因此,《中国艾滋病诊疗指南(2021年版)》[12]及《Guidelines for the Use of Antiretroviral Agents in Adults and Adolescents with HIV》[13]均推荐在抗病毒治疗前为患者进行基因型耐药检测(GDRAs),以指导抗病毒方案的选择。
2 HIV-1 PDR检测技术
HIV耐药检测技术包括表型耐药检测(PDRAs)和GDRAs,二者均存在一定优势及技术限制,GDRAs技术简单、成本更低,因此,目前针对新诊断HIV-1感染者治疗前耐药检测通常采用GDRAs。
2.1PDRAs技术 PDRAs的原理是基于体外培养技术,通过检测待检样本中抑制病毒生长所需的抗病毒药物浓度,与敏感参考株进行比较,得到病毒株的耐药情况[14]。其方法之一是运用逆转录-聚合酶链反应(PCR)扩增患者的基因片段(蛋白酶、整合酶及逆转录酶等),并将其植入野毒株内以获得重组病毒,通过重组病毒进行耐药检测[15]。一个关于PDRAs的关键指标是抑制50%病毒复制需要的抗病毒药物浓度(IC50)。若将患者感染病毒株的IC50与药物敏感参考毒株的IC50进行比较即可得出倍数变化值。由于PDRAs技术需要更高的成本和更长的检测时间,目前仅用于药物开发、耐药相关研究及多次抗病毒治疗失败的临床病例中[16]。
2.2GDRAs技术 GDRAs是对患者所感染的HIV-1基因组序列进行分析并与已知的针对抗逆转录病毒耐药的病毒序列谱进行比较[14]。实际方法是提取HIV-1感染者血浆中的病毒RNA,采用逆转录-PCR方法扩增与耐药性密切相关的基因片段并且进行序列测定后根据已建立的耐药性突变位点数据库(如斯坦福大学HIV耐药数据库https://hivdb.stanford.edu)进行耐药位点分析。该方法的优点是简单、快速及价格较低。但也存在数据库信息不足、耐药程度难以评价及无法对新型抗病毒药物耐药进行评价等问题[17]。GDRAs依赖于高质量、标准化的手段检测出患者的DRM,目前,GDRAs最主要的方法是Sanger测序,Sanger测序操作简单,是HIV-1耐药检测的“金标准”[18-19]。另外一种二代测序方法(NGS)的检测结果与Sanger测序的结果具有高度一致性,但当突变株比例小于20%时NGS具有更高的灵敏度[20]。HIV/AIDS应该在抗病毒治疗前、治疗失败后及病毒载量下降不理想时进行耐药检测。这种检测在发达国家是常规进行的,而在发展中国家由于成本等因素耐药检测难以推广应用,一项使用罗氏454焦磷酸测序系统进行的GDRAs调查结果显示,相较于Sanger测序,该方法灵敏度高4倍,并且在一次运行期间可检测至少48例患者样本(比Sanger测序多4倍),该方法可降低3~5倍成本,有望在发展中国家广泛使用[21]。NGS进行HIV耐药检测的步骤:(1)对样本进行核酸提取;(2)对目标HIV基因进行PCR扩增;(3)文库构建;(4)测序;(5)结果分析。由于NGS易受外界影响、测序结果的分析处理系统不完善及对技术人员操作水平要求更高,因此,在其广泛用于临床耐药检测前仍需进行优化改进[22]。
3 PDR现况
3.1世界各地PDR现况 在欧美一些发达国家PDR率呈下降趋势[23],与其日益更新的强效抗病毒药物有关。来自法国的一项关于PDR的研究结果显示,法国PDR率为10.8%,其中多数是(4.0%)对非核苷酸类逆转录酶抑制剂(NNRTIs)产生的耐药,存在PDR的患者最常见的病毒亚型为B亚型,但同时重组亚型(如毒性更强的CRF02_AG毒株)也在增加,提示HIV-1在不断进化重组[24]。而在美国,PDR率高达18%,其发现PDR在男性、20~29岁、男男性行为人群、CD4+T淋巴细胞计数大于或等于200个/μL者中更为常见[25]。在巴西一项针对596例HIV/AIDS进行的调查结果显示,PDR率为10.9%,并且发现根据GDRAs检测结果调整cART方案能获得更高的病毒学抑制率[26]。疫情最严重的撒哈拉以南非洲地区生活着全球70%以上的HIV/AIDS及近90%的儿童HIV/AIDS,有研究表明,该地区PDR率为5.6%,并且在该地推行抗病毒治疗时间越长的国家PDR率越高[27]。一项关于我国PDR现况的meta分析结果显示,我国PDR率为3.6%[28]。抗病毒制剂——蛋白酶抑制剂、核苷酸类逆转录酶抑制剂(NRTIs)、NNRTIs耐药率分别为1.1%、1.3%、1.6%,但未统计关于整合酶抑制剂(INSTIs)耐药情况。目前,我国PDR仍是针对NRTIs及NNRTIs耐药,原因在于这两类药物基因屏障低、抗病毒治疗推行时间长,然而我国指南仍推荐2种NRTI及1种NNRTI作为成人及青少年初治方案之一,因此,完善治疗前耐药检测有助于为患者制定个性化抗病毒方案。《EACS Guidelines》[29]建议,如需要在没有GDRAs检测结果的情况下启动cART,含INSTIs的方案可迅速降低病毒载量。同时,INSTIs也具有耐药屏障高的优点,但邓雪媚等[30]于2015—2016年云南省进行的治疗前耐药检测的513例有效基因序列中仍发现9例(1.7%)对INSTIs PDR。提示尽管INSTIs具有较高的基因屏障,其可能仍然并非是一种完全活性的抗病毒药物,也需要注意对该类抗病毒药物的耐药情况进行监控。
3.2国内各地PDR现况 尽管我国PDR率处于世界卫生组织(WHO)报告的低水平耐药流行预警行列(<5%),但我国各地区PDR率仍存在一定差异。广西壮族自治区PDR率为7.21%[31]。宁夏回族自治区PDR率为12.1%,高于我国浙江省(11.1%)、黑龙江省(8.3%)、北京市(3.4%)和上海市(2.7%)[32-36]。江苏省PDR率为2.8%,尽管该省PDR率暂时处于WHO报告的低水平耐药流行预警行列,但亚型分析结果显示,该省CRFs和URFs大量出现,导致该省亚型结构明显改变,亚型结构改变提示HIV-1感染者人口特征变化,以及病毒不断突变、重组等,因此,需进一步加大对HIV/AIDS疫情的防控[37]。我国各地PDR率分布见图1。
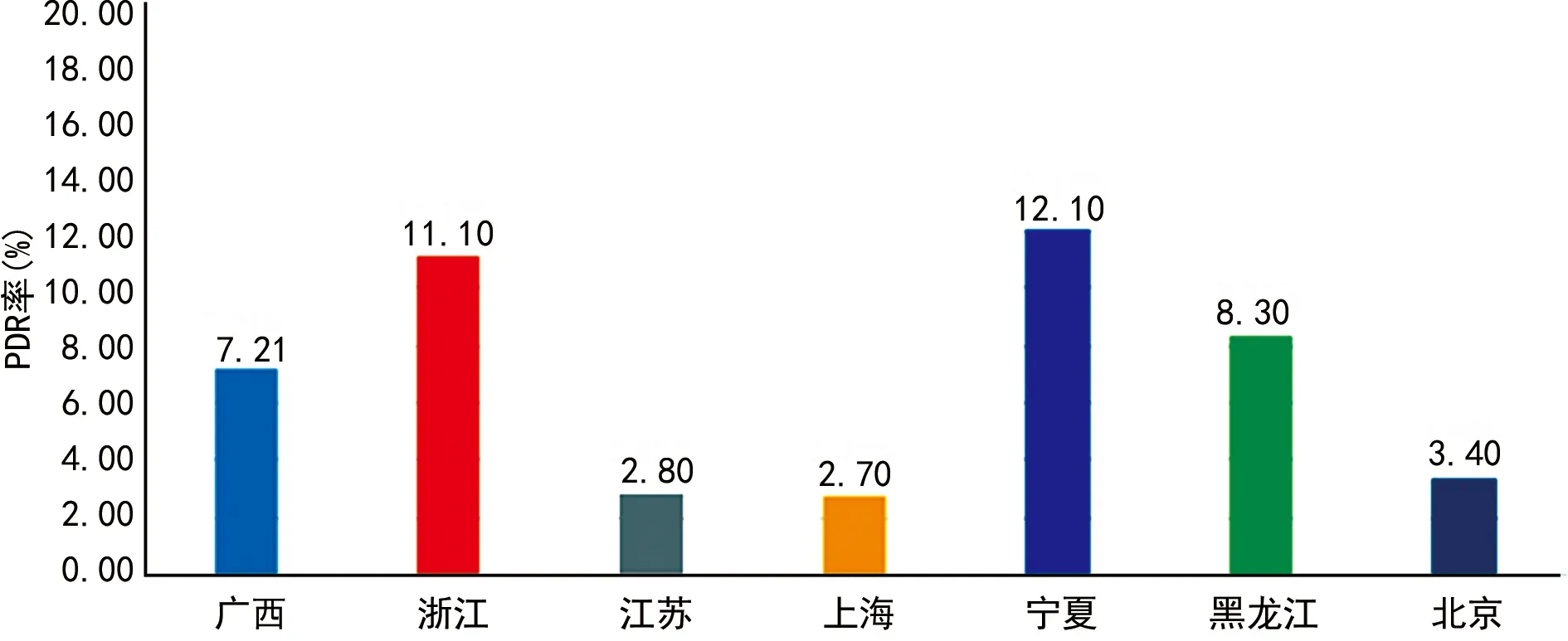
图1 我国各地PDR率分布
4 PDR对治疗结局的影响
在治疗前完善GDRAs只能提示患者体内病毒可能有PDR,判断PDR还需根据患者临床表现、病毒学指标及免疫学指标。一旦出现PDR,患者治疗结局:(1)病毒学抑制,规律cART 24周以上HIV RNA≤20或50 copy/mL;(2)病毒学失败,通常指持续cART 24周后血浆病毒载量持续大于或等于200 copy/mL或出现病毒学反弹,即在达到病毒完全抑制后又出现病毒载量大于或等于200 copy/mL[12]。而PDR对病毒学失败是否存在影响仍存在争议。
2007—2009年Pharmacess非洲耐药监测研究队列选取了2 733例HIV/AIDS进行相关研究,结果显示,与不存在PDR患者比较,存在PDR并接受部分活性cART患者第12个月病毒抑制率显著下降,病毒学失败风险显著增高,ADR风险显著增高,但存在PDR并接受完全活性cART患者无上述差异,并且存在PDR患者在随访期间CD4+T淋巴细胞计数上升更少[38]。同样来自非洲的一项对82例儿童的队列研究结果显示,在为期24个月的抗病毒治疗期间58.3%存在PDR的儿童出现了治疗失败,而在无PDR的儿童中仅24.6%存在治疗失败,表明PDR使治疗失败的概率增加了7.5倍[39]。而一项来自非洲6个国家的队列研究结果显示,对成人HIV/AIDS在使用一线cART方案的12个月内PDR同样与治疗失败有关[40]。相较于成人,母婴传播的儿童具有更高的PDR率及基线病毒载量,并且儿童二线抗病毒药物选择较成人更少,需要更加注意对儿童进行治疗前耐药检测。这与某些研究结果相悖,国外的一项队列研究结果显示,119例HIV/AIDS患者的PDR率为17.5%,使用一线cART方案随访12个月后未发现PDR与治疗失败及更高的病死率有关[41]。
上述研究结果的不同可能与研究地区差异(如当地经济水平、耐药情况及cART方案选择等)、个体化差异(如基线病毒载量、基线CD4细胞计数及服药依从性等)有关;另外,cART过程中出现ADR也是造成治疗失败的重要原因。由于随访难度大、治疗前难以完善耐药检测,目前,我国已发表的关于PDR的报告主要展示各地区HIV-1感染者PDR情况,关于PDR与治疗结局的研究甚少见,二者关系尚需进一步探究。
5 PDR管理策略
PDR在临床工作中常被忽视,其管理需要患者、管理者积极参与及合理的cART方案的制定。在抗病毒药物管理方面用药应考虑cART方案的效能及抗病毒药物的基因屏障。此外也需注意抗病毒药物的药代动力学特点,如药物生物利用度、半衰期及针对单药发生DRM时对方案其他抗病毒药物的影响。另外,一旦发生耐药需更换2种以上有活性的抗病毒药物,最好是3种[12]。由于个体的服药依从性及个体基因组的差异可影响药物血药浓度导致耐药,如依非韦伦血药浓度与CYP2B6、CYP2A6、UGT2B7、ABCB1/MDR1等编码其主要代谢酶或转运受体的基因密切相关[42],因此,应该对患者进行个体化用药,监测血药浓度,必要时调整抗病毒药物用量。若患者同时服用其他药物,还应该考虑不同药物的相互作用,也需注意患者合并其他感染(乙型肝炎病毒、丙型肝炎病毒)的情况。管理者应尽量要求患者完善治疗前耐药检测,了解当地各种抗病毒药物PDR现况,以优化cART方案。
综上所述,随着抗病毒治疗的普及,HIV-1在药物选择压力作用下不断变异,PDR不断增多。Sanger测序目前仍是GDRAs的“金标准”,而NGS作为一种灵敏度更高的检测手段在用于临床之前仍需优化改进。国内外目前PDR现况及趋势有所不同,由于推行抗病毒治疗时间更长,当前国外PDR率更高,但随着强效抗病毒药物的日益更新,其趋势逐渐下降,我国目前尚处于WHO低水平耐药预警行列,但各地PDR率存在一定差异,且多是针对NNRTIs耐药,而目前我国指南仍推荐NNRTIs为一线抗病毒药物,因此,对HIV/AIDS应提倡完善治疗前耐药检测。管理者应该根据耐药检测结果选择合理的cART方案,使患者获得更好的抗病毒疗效及远期预后,阻断耐药毒株在人群中的传播。
