基于网络药理学及分子对接研究夏枯草治疗乳腺囊性增生病的药理作用机制*
2023-01-04何天翼杜佳尚何志贤
钟 想,尹 旭,何天翼,杜佳尚,何志贤△
(1.南通大学附属医院甲乳外科/南通大学医学院,江苏 南通 226000;2.南京医科大学,江苏 南京 210000;3.南通大学附属医院甲乳外科,江苏 南通 226000)
乳腺囊性增生病又称为乳腺增生病,是一种内分泌紊乱所致的乳腺疾病,属于乳腺外科最常见疾病[1]。乳腺囊性增生病好发年龄为25~45岁,发病率为50%~70%[2]。目前,乳腺囊性增生病的主要病因及具体发病机制尚不明确,一般认为,主要是由于在周期性月经、妊娠、青春期及更年期间女性体内发生内分泌功能紊乱导致乳腺上皮和间质细胞增生及复旧不全所致[3]。乳腺囊性增生病患者主要临床表现为乳房肿块及周期性疼痛[4]。乳腺囊性增生病具有反复发作、迁延不愈等特征,很大程度上降低了患者生活质量。另外,据文献报道,该病与乳腺癌的发生具有一定相关性,乳腺囊性增生病患者发生乳腺癌的风险比普通人增加了4倍左右[5]。目前,针对乳腺囊性增生病西医主要采取密切随访、药物治疗及手术干预等治疗措施[6]。而中医在治疗乳腺囊性增生病方面也发挥着独特的优势,可在提高临床疗效的同时减少西医用药剂量,改善机体免疫功能。
夏枯草别名“乃东”,最早记载于《神农本草经》,具有辛、苦、寒、无毒等特征[7]。关于夏枯草的功效,《本草分经》[8]记载:“解内热,散结气,消瘿,治目珠夜痛,久服伤胃。”夏枯草作为一味历史悠久的中药材,入肝经,是散结止痛的好药。中药理论认为,乳腺囊性增生病属“乳癖”范畴,因肝郁气滞所致,故夏枯草对治疗此病具有独特的优势。李杰茹等[9]临床试验结果显示,夏枯草对乳腺囊性增生病具有明显的疗效。虽然夏枯草药已广泛用于临床治疗,但其治疗乳腺囊性增生病的药理分子作用机制尚未明确。目前,网络药理学已成为研究中药药理作用机制的热门方法,主要涉及中药活性成分筛选、通路作用机制阐述及中药配伍机制的探索等方面[10]。网络药理学通过生物信息技术构建疾病-基因-靶点-药物互作网络,阐述药物对疾病干预的药理作用机制。本研究联合运用网络药理学及分子对接技术分析了夏枯草活性成分,预测了夏枯草治疗乳腺囊性增生病的作用靶点及信号通路,进一步阐述了夏枯草治疗乳腺囊性增生病的相关分子机制,旨在为后期的临床试验提供基础理论依据。
1 资料与方法
1.1研究对象 将通过美国TCMSP数据库搜索夏枯草中有效成分信息及其对应的作用研究靶点,运用GeneCards、OMIM、PharmGkb、DrugBank数据库获取相关乳腺囊性增生病的临床疾病靶点作为研究对象。
1.2方法
1.2.1收集中药成分及靶点 利用TCMSP数据库(https://tcmspw.com/tcmspsearch.php)[11]检索夏枯草活性成分。根据毒药物动力学原理设定2个筛选条件,即口服生物利用度(OB)≥30%、类药性(DL)≥0.18,进一步筛选夏枯草活性成分,利用所得到的潜在活性成分在该数据库中检索其对应靶点。通过Perl软件将所得的蛋白名转化为对应的基因名,整理得到夏枯草有效成分的所有靶点。
1.2.2获取乳腺囊性增生病相关疾病靶点 采用GeneCards数据库(https://www.genecards.org)[12]、DurgBank数据库(https://www.drugbank.ca)[13]、OMIM数据库(https://omim.org)[14]、PharmGKB数据库(https://www.pharmgkb.org)[15],并以breast cystic hyperplasia为关键词检索其在数据库中的相关疾病靶点,将数据导入Excel16.0软件,取去交集删除重复靶点,得到乳腺囊性增生病的疾病靶点。以human为主要筛选条件,通过Uniprot数据库将所得乳腺囊性增生病的疾病靶点的蛋白名转化为基因名。
1.2.3构建疾病-中药活性成分-交集靶点网络模型 为探究夏枯草中活性成分作用于乳腺囊性增生病的对应靶点,通过Perl语言分析得到乳腺囊性增生病疾病靶点与夏枯草活性成分对应靶点的交集靶点,并绘制韦恩图;再将此中药的活性成分与相互作用的交集靶点数据导入Cytoscape 3.9.0软件构建疾病-中药活性成分-交集靶点网络并进行进一步的拓扑分析,以研究夏枯草活性成分治疗乳腺囊性增生病的药理作用机制。
1.2.4构建核心基因的蛋白质互作网络(PPI) 将乳腺囊性增生病的相关疾病靶点与夏枯草活性成分对应的靶点交集数据导入STRING数据库[16],按multiple proteins及Homo sapiens检索,并隐藏游离节点,得到PPI。下载STRING数据库中蛋白质-蛋白质互作的tsv格式文件,将所筛选的蛋白节点建立对应关系并整理在Excel16.0软件中,利用Cytoscape3.9.0 软件进行可视化,用CytoNCA插件筛选核心靶点,基于核心基因构建相应的PPI。
1.2.5基因本体(GO)富集分析及京都基因与基因组百科全书(KEGG)通路富集分析 利用R语言对疾病和药物的交集靶点进行GO富集分析及KEGG通路富集分析,分别选取前10、20个条目,绘制气泡图和柱状图,得到夏枯草治疗乳腺囊性增生病所参与的生物学过程、分子功能、细胞成分及影响的主要信号通路。
1.2.6中药关键活性成分与疾病核心靶点的分子对接验证 运用PubChem数据库下载中药活性成分的3D结构,并通过Chem3D软件实现中药活性成分能量最小化。在PDB数据库检索获取靶点的蛋白3D结构。利用SYBYL-X 2.0软件进行分子结构处理和分子对接。
2 结 果
2.1中药有效活性成分及靶点 最终得到11个活性成分。见表1。将所得蛋白靶点通过perl语言转化为186个基因靶点。
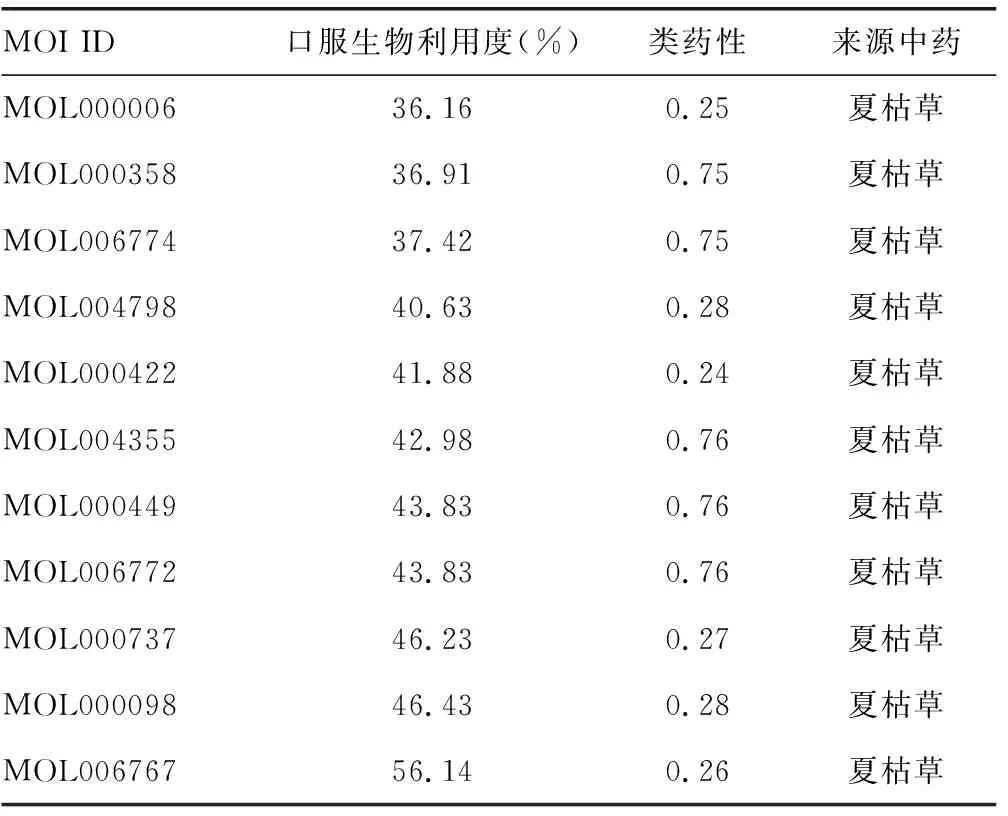
表1 夏枯草中药活性成分情况
2.2乳腺囊性增生病相关疾病靶点筛选 共得到2 699个疾病相关靶点。见图1。
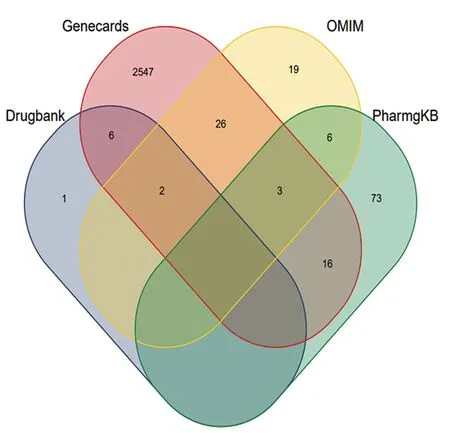
图1 各数据库中乳腺囊性增生病的相关靶点
2.3疾病-中药活性成分-交集靶点网络 共得到交集基因靶点141个,是夏枯草治疗乳腺囊性增生病的作用靶点。见图2。基于Perl语言,分析141个交集基因与夏枯草11个活性成分,导入Cytoscape3.9.0软件并构建“疾病-中药活性成分-交集靶点”网络。见图3。共有152个节点和252条边。与该点连接的边的数量、度值越大,颜色越深,三角形的形状越大,表示该节点与其他节点作用越广泛,在该网络中夏枯草有11种活性成分,分别为仙人掌黄素(Vulgaxanthin-I,MOL006767)、β-谷甾醇(beta-sitosterol,MOL000358)、7-豆甾烯酸(stigmast-7-enol,MOL006774)、菠菜甾醇(Spinasterol,MOL004355)、豆甾醇葡萄糖苷(poriferasterol monoglucoside,MOL006772)及木犀草素(luteolin,MOL000006)等。预测夏枯草是通过这11种活性成分对乳腺囊性增生病起疗效的。

图2 疾病与中药共同靶点韦恩图

图3 疾病-中药活性成分-靶点网络图
2.4夏枯草治疗乳腺囊性增生病PPI及核心基因 将141个交集靶点数据导入STRING数据库获得PPI信息,应用Cytoscape3.9.0软件将初始PPI可视化。见图4。初始PPI共141个节点,2 420个条边。节点代表夏枯草有效成分治疗乳腺囊性增生病的基因靶点,靶点间的相互度值越大则颜色越深,表明该节点越重要。进一步利用CytoNCA插件筛选核心靶点,取24种算法的交集基因。见图5。获得最终的核心靶点NFKBIA、VEGFA、CCND1、MYC等,说明夏枯草是可能通过这些乳腺囊肿增生病对应的疾病靶蛋白发挥治疗作用的。

图4 交集蛋白PPI
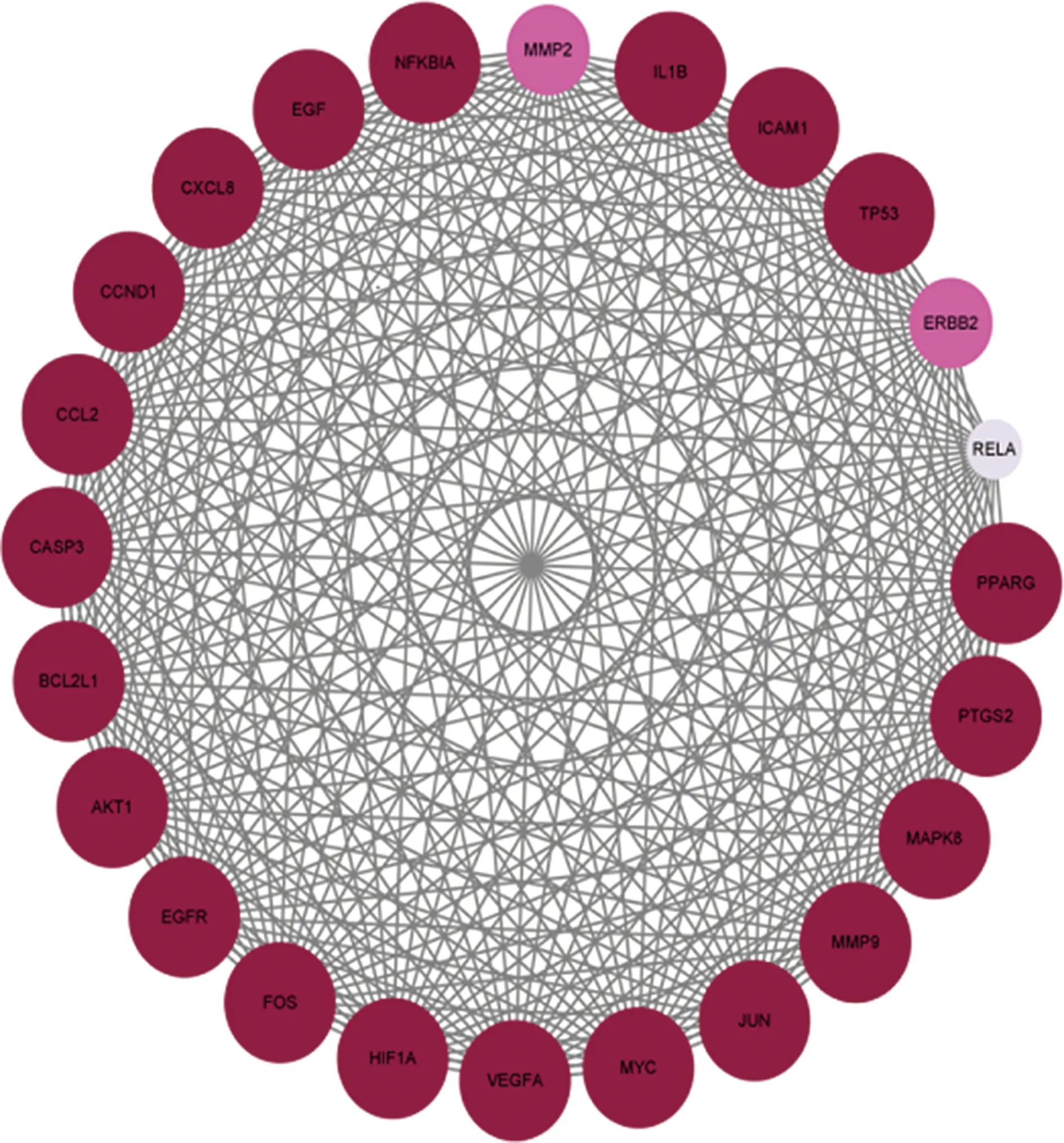
图5 核心靶蛋白获取
2.5GO富集分析 通过R语言将疾病和中药交集靶点按P值<0.05、Q值<0.05进行GO富集分析得到生物过程、分子功能及细胞组成的前10条目绘制气泡图。见图6。其中生物学过程中主要涉及异源刺激过程、脂多糖代谢、氧化应激反应、化学应激反应等;在细胞成分中主要涉及膜筏、膜微结构域、细胞器外膜等;在分子功能中主要涉及DNA结合转录因子活性、RNA聚合酶Ⅱ-特异性DNA结合转录因子活性、类泛素蛋白连接酶及核受体活性等。

图6 中药与疾病交集靶点GO富集分析(前10条目)
2.6KGEE富集分析 通过R语言将疾病和中药的交集靶点按P值<0.05、Q值<0.05进行KEGG富集分析得到前20通路进而绘制条形图。见图7。与乳腺囊性增生病密切相关的通路有晚期糖化终末产物-晚期糖化终末产物受体(AGE-RAGE)信号通路、肿瘤坏死因子(TNF)信号通路、白细胞介素-17(IL-17)信号通路等。选取KEGG富集中与乳腺囊性增生病密切相关的环磷酸腺苷(cAMP)通路映射作用靶点。见图8。表明夏枯草可能是通过上述通路对乳腺囊性增生病起治疗作用的。
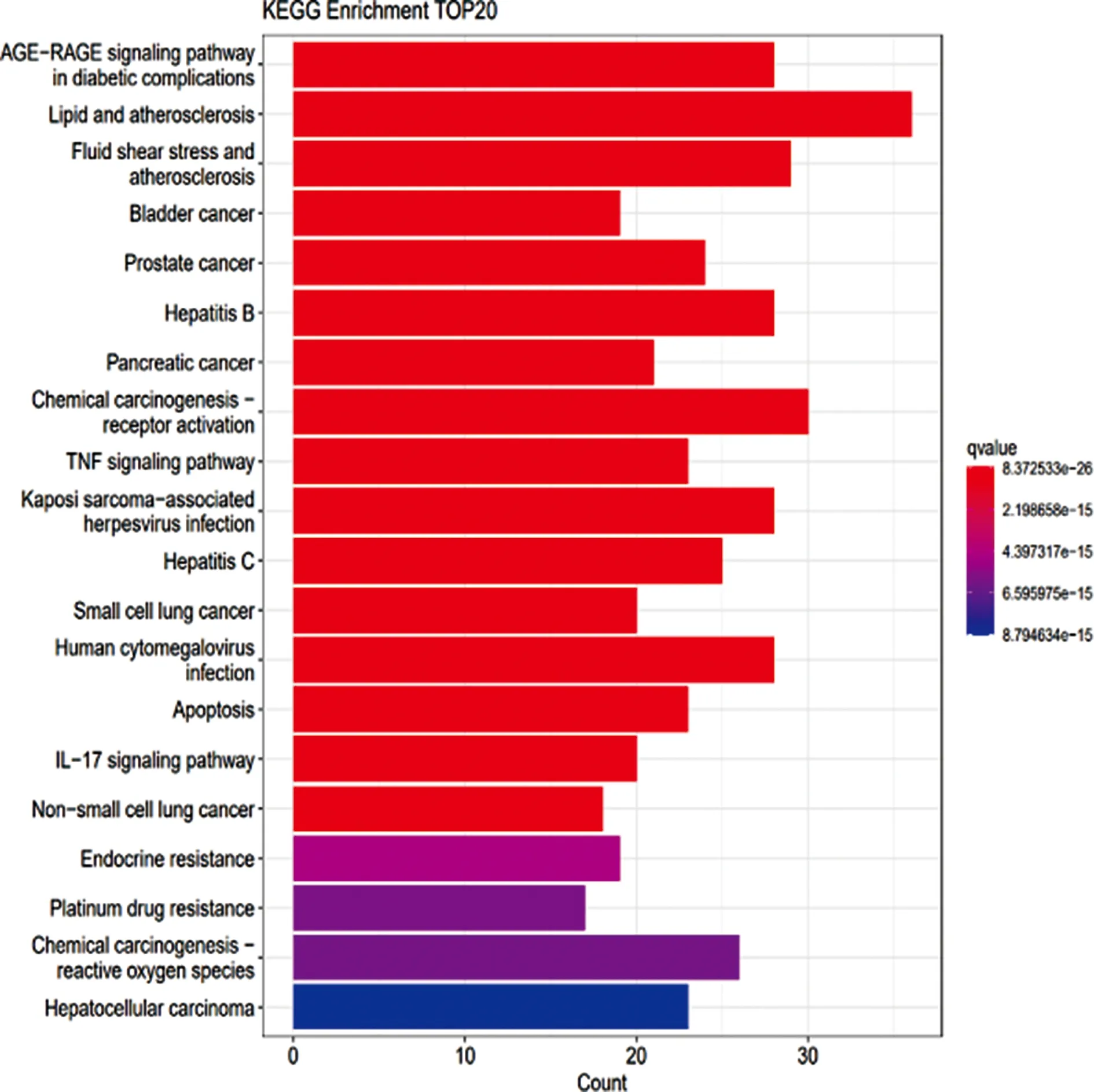
图7 中药与疾病交集靶点KEGG信号通路富集分析(前20)
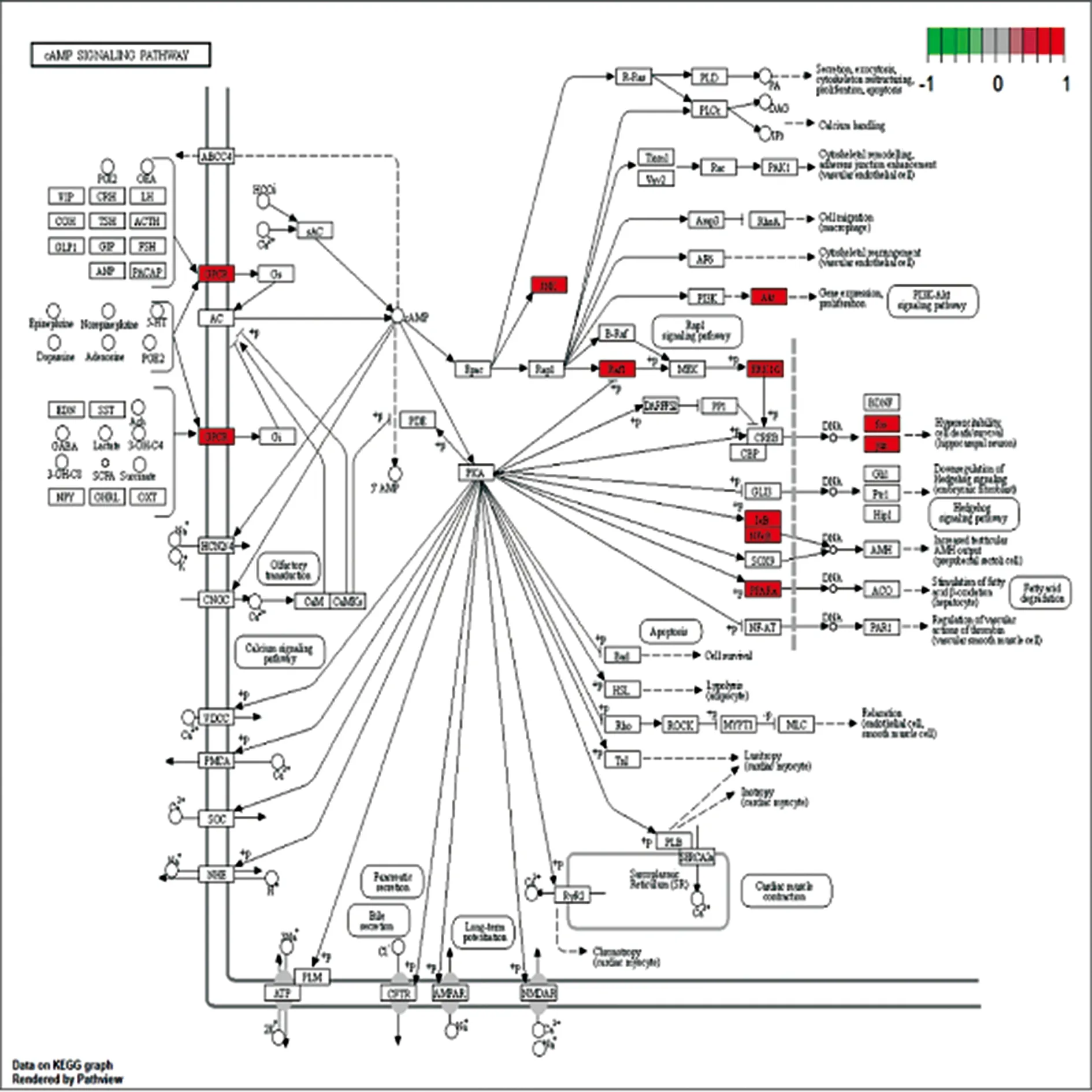
图8 cAMP信号通路(红框代表共同基因)
2.7分子对接技术预测中药活性成分和疾病靶点结合能力 利用SYBYL-X 2.0软件将疾病-中药活性成分-交集靶点所得到的的夏枯草治疗乳腺囊性增生病的11个活性成分与NFKBIA、VEGFA、CCND1及MYC等24个核心靶点进行分子对接,其中对接前4的活性成分与主要核心蛋白对接的总分结果见表2。这4组蛋白与中药活性成分对接的总分均大于7分,表明夏枯草与其有较强的结合能力。其中仙人掌黄素与靶蛋白结合效果最佳,丝/苏氨酸蛋白激酶1(AKT1)是能与夏枯草中活性成分结合的最优靶蛋白。AKT1受体蛋白与仙人掌黄素(总分为8.35分,与氨基酸残基A/ARG25、A/ARG23、A/ARG86、A/ASN53、A/LYS14有5个氢键连接)见图9A。丝裂原激活蛋白激酶8(MAPK8)受体蛋白与仙人掌黄素(总分为7.59分,与氨基酸残基A/SER34、A/LYS55、A/ASP169、A/ASN114有4个氢键连接)见图9B。环加氧酶2(PTGS2)受体蛋白与豆甾醇葡萄糖苷(总分为8.32分,与氨基酸残基A/GLN457、A/HIS214、A/GLN454有3个氢键连接)见图9C。酪氨酸激酶受体2(ERBB2)受体蛋白与β-谷甾醇(总分为7.88分,B/ASN697、B/ARG696、B/GLU698、B/ARG716)见图9D。上述配体化合物均能良好地包埋在受体靶蛋白的活性口袋中。

表2 夏枯草治疗乳腺囊性增生的11个活性成分与主要核心蛋白分子对接得分(分)
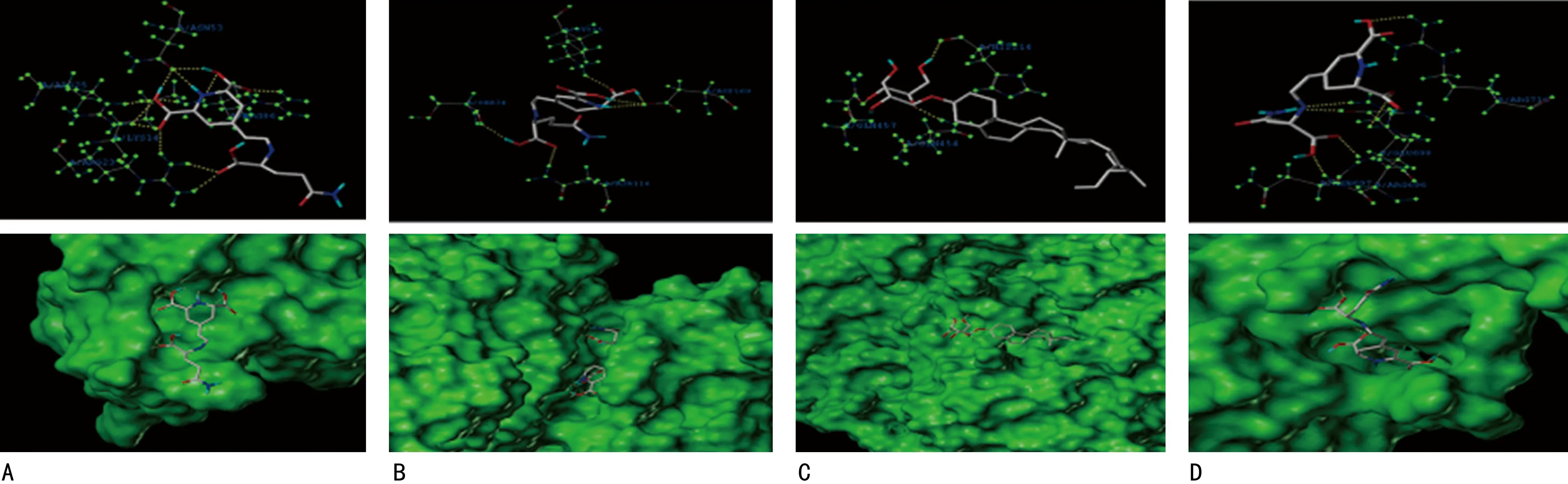
A.仙人掌黄素与ATK1;B.仙人掌黄素与MAPK6;C.豆甾醇葡萄糖苷与PTGS2;D.β-谷甾醇与ERBB2。图9 夏枯草中关键活性成分与PPI核心靶蛋白分子对接情况
3 讨 论
中医对乳腺囊性增生病的研究有很长的历史渊源,早在战国时期的《中藏经》中就已有记载[17]。之后明朝时期的《外科活人定本》首次提出了“乳癖”这一概念,并且明确了其与乳房肿块的关系。目前,依据中医学脏腑经络理论及临床治疗经验将乳腺囊性增生病的发病机制主要归结于以下方面,即肝气郁结、肝郁脾虚、肾元气损及冲任失调[18]。夏枯草是一味药理作用广泛且历史悠久的中药,在明代时期的《滇南本草》就已有关于夏枯草作为常用中药材的记载[19]。目前,有研究表明,夏枯草具有清肝泻火、明目、散结消肿等功效,时常被用于乳腺囊性增生病的治疗[20]。国内在研究夏枯草治疗乳腺囊性增生病的过程中发现其可以明显提高三苯氧胺的疗效,降低西药不良反应,减轻患者心理及生理负担[21]。然而,目前国内外尚未见有关夏枯草治疗乳腺囊性增生病的活性成分、作用靶点及信号通路等具体作用机制的文献报道。所以,本研究旨在揭示夏枯草治疗乳腺囊性增生病的药理分子作用机制。
本研究通过联合采用网络药理学及分子对接技术分析其作用机制,结果显示,夏枯草共有11个活性成分对乳腺囊性增生病具有关键治疗作用,如仙人掌黄素、β-谷甾醇、7-豆甾烯酸、豆甾醇葡萄糖苷及木犀草素等;186个作用基因靶点。搜索得到乳腺囊性增生疾病靶点共2 699个;经分析获得141个交集靶点基因。进而构建了疾病-有效成分-交集靶点网络,分析了有效成分与靶点、靶点与疾病的相互作用关系,为阐述夏枯草对乳腺囊性增生病治疗机制提供了参考依据。
疾病-有效成分-交集靶点网络显示,仙人掌黄素、β-谷甾醇、槲皮素、木犀草素及山柰酚相配对的靶点较多,可看作是夏枯草治疗乳腺囊性增生病的主要活性成分。β-谷甾醇是一种植物甾醇,具有抗炎、抗氧化衰老及抗癌等功效[22]。有研究表明,β-谷甾醇可通过影响磷酸肌醇-3激酶/蛋白激酶B (PI3K/Akt)信号通路抑制乳腺癌细胞增殖[23]。而本研究结果显示,夏枯草在治疗乳腺囊性增生病的过程中PI3K/Akt信号通路也处于抑制状态,表明很有可能是夏枯草中的β-谷甾醇通过影响PI3K/Akt信号通路从而达到对乳腺囊性增生病的治疗效果。仙人掌黄素具有抗炎的作用,可抑制细胞色素C氧化酶5活性及表达,进而阻断花生四烯酸代谢过程,发挥抗炎作用[24]。槲皮素是具有多种生物学功能的一类黄酮类化合物,可抗肿瘤、抗炎、抗氧化应激等[25]。有研究表明,槲皮素在治疗乳腺疾病方面也有较好的效果[26]。说明夏枯草中的活性成分可能通过抗炎、抗氧化、抗肿瘤及抑制增生发挥治疗乳腺囊性增生病的疗效。
本研究通过CytoCNA插件对PPI中交集靶点筛选得到有AKT1、PTGS2、MAPK8及TP53等24个核心靶点。预测其可能是夏枯草治疗乳腺囊性增生病的主要靶点。AKT1是PI3K下游的一个重要靶蛋白,可促进乳管上皮细胞增殖,抑制其凋亡[26]。MAPK8可提高成纤维细胞增殖能力[27]。在乳腺囊性增生病的发病进程中MAPK8可能参与了乳腺的不全修复。细胞色素C氧化酶2/PTGS2通过生成前列腺素发挥调节炎性反应的关键作用,一些研究已表明,炎症刺激可明显提高PTGS2表达水平[28-29]。上述靶点的明确揭示了夏枯草治疗乳腺囊性增生病的作用机制,也为今后新药的制作提供科学的理论依据。
本研究通过KEGG信号通路富集分析显示,夏枯草可通过影响AGE-RAGE信号通路、TNF信号通路、IL-17信号通路、cAMP信号通路发生对乳腺囊性增生病的疗效。很多种生物学过程与AGE-RAGE信号通路有关,如炎性反应、氧化应激及纤维化等[30]。夏枯草治疗乳腺囊性增生病主要涉及氧化应激这一生物过程。本研究结果显示,夏枯草的有关活性成分可通过AKT1和MAPKs影响AGE-RAGE信号通路,进而抑制正常乳腺上皮细胞生长。目前,对AGE-RAGE信号通路的研究一般局限于糖尿病及冠状动脉粥样硬化等,所以,对乳腺疾病,此信号通路还有很大的探索空间。TNF是一种促炎性细胞因子,也是其他细胞因子的关键调节因子,如IL-1β、IL-6、IL-8等。TNF主要参与炎症急性期反应的诱导和趋化[31]。有研究表明,夏枯草可能通过IL-1β、MAPK8、肉瘤病毒癌基因同源物、AKT1等核心靶点影响正常乳腺细胞中的TNF信号通路,进而发挥其对乳腺增生的抑制作用。IL-17信号通路也是一条参与炎性反应的明星通路[32]。核心靶点中的PTGS2可阻断IL-17信号通路的传导,发挥抗炎作用。通过上述信号通路分析显示,在夏枯草治疗乳腺囊性增生病过程中主要作用机制是抗炎及缓解自身氧化应激反应。
综上所述,本研究通过网络药理学及分子对接技术揭示了夏枯草治疗乳腺囊性增生病的药理作用机制。夏枯草中的仙人掌黄素、β-谷甾醇、7-豆甾烯酸、豆甾醇葡萄糖苷、木犀草素等活性成分可通过AKT1、MAPK8、PTGS2、ERBB2、IL-1β等核心靶点对AGE-RAGE信号通路、TNF信号通路、IL-17信号通路进行干预,提高正常乳腺上皮细胞抗炎和应对氧化应激能力,进而在一定程度上达到抑制乳腺增生的效果。然而,本研究仅在理论上探讨了夏枯草治疗乳腺囊性增生病的药理作用机制,尚有待于后期研究进一步证明。