采后黄金百香果失水规律及其与品质劣变的关系
2023-01-03罗振宇陈晓婷李雨函苏金强兰嘉滢林河通
罗振宇,陈晓婷,李雨函,汪 莹,苏金强,杨 静,兰嘉滢,倪 辉,4,张 珅, ,林河通
(1.集美大学海洋食品与生物工程学院,福建厦门 361021;2.福建省海洋生物增养殖与高值化利用重点实验室,福建厦门 361000;3.福建省热带作物科学研究所,福建漳州 363001;4.福建省食品微生物与酶工程重点实验室,福建厦门 361021;5.亚热带特色农产品采后生物学(福建农林大学)福建省高校重点实验室,福建福州 350002)
百香果(Passiflora eduliaSims)又称“西番莲”、“鸡蛋果”、“热情果”,百香果成熟和采收于温热季节,属于典型的呼吸跃变型果实,采后乙烯释放和呼吸作用极为旺盛,并且极易失水[1-2]。常温条件下,百香果在后熟完成时就会出现果皮皱缩、褐变等品质劣变现象[3],而黄果尤甚,导致其不耐贮运,货架期极短,制约了百香果的流通和经济价值[4]。虽然百香果完熟后口感最佳,但果皮通常已严重皱缩甚至溃烂,这种外观品质与内在食用品质形成的极不同步问题,给消费者造成了“百香果越皱缩越香甜”的印象,大大降低了百香果的商品价值[5]。因此,研究百香果采后失水规律,解析其与果实品质劣变的关系是十分必要的,可为百香果采后减损提供参考依据。
低场核磁共振技术(Low Field Nuclear Magnetic Resonance,LF-NMR)是一种利用氢质子弛豫时间分析水分状态和分布的检测方法[6],因其能够实现数据快速获取,并从分子层面监测食品中水分分布情况及迁移过程,近年来已被应用于食品贮藏和加工过程中组分和结构变化研究[7]。Chen等[8]利用LF-NMR技术实现油炸淀粉体系中水和油含量的同时测定和建模。贾哲等[9]采用LF-NMR结合PCA分析,确定了双斑东方鲀冷藏过程中水分分布与品质之间的相关性,发现随着水分流失,双斑东方鲀的持水能力、质地和鲜度降低,品质逐渐劣化。Yang等[10]利用LF-NMR成像技术,对鲜切苹果在4 ℃冷藏过程中的水分迁移进行了监测,发现随着贮藏时间的延长,苹果细胞液泡中水的流动性降低并向细胞质迁移。罗洁莹等[11]利用LF-NMR技术确立了鹰嘴蜜桃水分总信号幅度和含水率的关系,发现随着时间推移,鹰嘴蜜桃的自由水、结合水和不易流动水含量均减少,其中自由水的减少幅度最大,不易流动水次之,结合水最小。综上,LF-NMR作为新型无损检测光谱技术,在快速、直观反映食品水分相关品质方面具有巨大应用潜力。但目前关于利用LF-NMR技术研究采后果实水分变化的报道还较少,也尚未有研究涉及采后百香果失水与品质之间的关系。
本研究利用LF-NMR技术对采后黄金百香果果实在贮藏过程中的水分状态和分布进行观测,评价果实主要品质变化情况,探讨果实失水和品质劣变之间的关系,旨在揭示百香果果实在贮藏过程中的失水规律以及与失水相关的品质变化,为百香果果实商品化处理和贮藏保鲜技术的研究和应用提供科学参考。
1 材料与方法
1.1 材料与仪器
黄金百香果果实 采收于福建省热带作物科学研究所(漳州);丙酮、NaOH、CaCO3AR级,国药集团;所有试剂均为国产分析纯。
NMI20-060HH核磁共振成像分析仪 苏州纽迈分析仪器股份有限公司;TA.touch触屏式质构仪上海保圣实业发展有限公司;LE204E电子天平梅特勒-托利多仪器(上海)有限公司;T6新世纪-紫外可见光分光度计 北京普析通用仪器有限责任公司;PSX-330H恒温恒湿箱 宁波莱福科技有限公司;ZWY-240恒温培养振荡器 上海智城分析仪器制造有限公司;DZF-6050真空干燥箱 上海精宏仪器设备有限公司;3051H果蔬呼吸测定仪 上海精密仪表有限公司;TS7700分光测色仪 深圳市三恩时科技有限公司;RX-5000αATAGO全自动台式折光仪 日本ATAGO(爱拓)中国分公司。
1.2 实验方法
1.2.1 原料处理与贮藏条件 黄金百香果果实于八至九成熟时采收,采收后立即运至集美大学海洋食品与生物工程学院实验室,选择果形端正、大小一致,色泽均匀、无病虫害和机械损伤的果实进行试验。果实经清洗后晾干,打孔包装,于25 ℃,相对湿度90%环境下贮藏,贮藏期内每隔2 d取样,进行拍照观察和相关指标测定。
1.2.2 测定指标及方法
1.2.2.1 呼吸强度 参照Chen等[12]的方法,采用果蔬呼吸测定仪测定,将黄金百香果果实放入呼吸室中,计算单位时间内CO2浓度的变化,分别在采后12、18、24、48 h测定CO2浓度,并于贮藏3 d后每隔2 d测定一次,结果以mg CO2/kg·h表示。
1.2.2.2 核 磁 共 振(Magnetic Imaging Resonance,MIR)T1加权成像 参照吴靖娜等[13]的方法,将不同贮藏时间的果实样品置于磁场中心进行检测,线圈直径:60 mm;观测范围(FOV):100 mm×100 mm;扫描次数(Average):8;重复时间(TR):2000 ms;回波时间(TE):18.125 ms。图片经MIR图像处理软件进行映射、降噪和伪彩处理。
1.2.2.3 横向弛豫时间(T2)反演谱的采集 参照贾哲等[9]的方法,利用LF-NMR中的Carr-Purcell-Meiboom-Gill(CPMG)脉冲序列对样品的横向弛豫时间(T2)进行检测,偏移频率(SW):200 kHz;重复时间(TW):5000 ms;累加次数(NS):8;回波数(NECH):320。随后,利用NMRT2反演软件获得T2反演谱,以图谱中峰面积的积分计算结果表示不同水分状态的含量。
1.2.2.4 果实失重率 参照帅良等[14]的方法进行测定,取10个果实,采用称重法,以0 d果实质量与每测定点果实质量差值占初始质量的百分比计算,结果以质量分数(%)表示。
1.2.2.5 果皮含水量 采用直接干燥法测定,去除果皮内部白色海绵层,沿赤道面取样2~3 g,于真空干燥箱内烘至恒重。结果以质量分数(%)表示[15]。
1.2.2.6 果皮色泽 参照郭靖等[16]的方法,使用分光测色仪沿果实赤道面随机、均匀取3点测定亮度值(L*)、红绿值(a*)和黄蓝值(b*),计算色调角h°。
1.2.2.7 叶绿素和类胡萝卜素含量 参照吕静祎等[17]的方法稍加修改,称取1.0 g百香果果皮于80%丙酮溶液中研磨,分别测定提取液在波长663 nm和645 nm处的吸光值,计算叶绿素含量,并于波长440 nm处测定类胡萝卜素含量,结果均以mg/g表示。
1.2.2.8 可溶性固形物含量 参照Le等[18]的方法,取滤布挤压出的百香果果汁2滴于折光仪上,读取数据并记录,重复10次,结果以%表示。
1.2.2.9 可滴定酸含量 参照Chen等[19]的方法,用直接滴定法进行测定,取10个百香果果浆,三层纱布过滤,定容到50 mL容量瓶中,静置30 min,用标定后的0.01 mol/L NaOH溶液进行滴定,结果以%表示。
1.2.2.10 硬度 参照李涵等[20]的方法,取10个百香果果实,于赤道面处采用质构仪进行全质构下压测试,前速度3.0 mm/s,测试速度2.0 mm/s,测试后速度4.0 mm/s,间隔时间2.0 s,目标模式形变量10%,接触点压力5 gf,结果以N表示。
1.2.2.11 果实腐烂率 参照Oliveira等[21]的方法,将表皮病变腐烂面积超过30%的果实定义为腐烂果,腐烂率以腐烂果数占总果实数的百分比表示。
1.3 数据处理
以上指标测定均重复3次,使用Microsoft Office Excel 2019和IBM SPSS Statistics 26对数据进行分析,并通过Origin 2021进行相关性、主成分分析和图像处理。
2 结果与分析
2.1 黄金百香果贮藏期间呼吸强度的变化
百香果作为呼吸跃变型果实,与猕猴桃[22]、李子[23]、芒果[24]等果实相似,采收后存在明显的后熟特征,此类果实采后外观、质地与风味品质转变过程与呼吸强度密切相关,因此呼吸速率是其后熟衰老进程中品质变化节点的重要标志。如图1所示,黄金百香果呼吸强度在采后1 d内迅速升高,出现第一次呼吸高峰,1~2 d降低后再度上升,4 d时出现第二次呼吸高峰,峰值可达172.96 mg CO2/kg·h,高峰过后6~7 d缓慢下降,7~9 d较快降低,9~18 d变化不大,但仍保持在较高水平。这些结果表明黄金百香果在常温贮藏期间代谢活动极为旺盛,易导致品质迅速变化,并且根据呼吸强度变化可将贮藏期间果实的生理状态大致分为成熟期(0~6 d)、完熟期(6~12 d)和衰老期(12~18 d)。
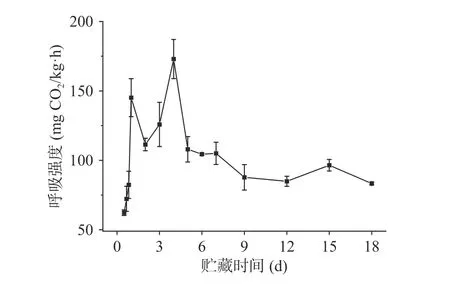
图 1 黄金百香果贮藏期间呼吸强度的变化Fig.1 Changes in respiratory intensity of harvested golden passion fruit during storage
2.2 黄金百香果贮藏期间的失水规律
2.2.1 黄金百香果贮藏期间外观和内部水分分布变化 新鲜果蔬含水量高,采后失去水分供给,由于蒸腾作用和生理代谢消耗不断失水,使果实呈现表面光泽消失、形态萎蔫、表皮皱缩等失鲜状态[25]。由图2A可知,黄金百香果采收时表皮以青绿色为主,外观饱满有光泽。贮藏9 d时果实达到成熟状态,表皮转至金黄色,果实外观饱满,但果蒂已出现萎蔫。贮藏18 d后,果实整体保持金黄色,但局部出现褐变,外观呈明显失水状态,果形不规则,果皮严重皱缩,果蒂干枯。上述果实外观品质变化与果实贮藏期内呼吸强度变化(图1)所揭示的生理周期相符。

图 2 黄金百香果贮藏期间外观和水分分布变化Fig.2 Changes in appearance and water distribution of harvested golden passion fruit
图2B和2C显示了MIR图像中果实贮藏期间纵切面和横切面的质子密度变化,直观反映了黄金百香果在贮藏过程中内部水分分布,绿色明亮程度越高表示质子密度越高,即该区域水分含量越高。由图2B和2C可以看出,贮藏初期黄金百香果果浆部分呈鲜亮绿色,饱满致密,果皮部分成像明显,说明果实水分分布较为均匀。随着贮藏时间的延长,绿色部分逐渐变暗淡,果实内部空心部分面积逐渐扩大,果皮成像衰减;贮藏末期,果浆成像面积缩小,果心部分出现明显中空,果皮成像不连续,表明黄金百香果果皮和内部均出现严重失水,与果实外观表现一致。

图 3 黄金百香果果实采后水分状态T2反演谱(A)、不同状态水含量变化(B)和水分PCA分析图(C)Fig.3 The inverse spectrum of water states (A) and their content changes (B) of harvested golden passion fruit with PCA analysis (C)
2.2.2 黄金百香果贮藏期间水分状态及其含量变化
生鲜果蔬中的水分可根据流动性以及与细胞内物质的结合程度分为自由水、不易流动水和结合水,且三者之间可以相互转化。自由水在细胞间和细胞内可以自由流动,既可参与生化反应,也可充当介质,在果蔬水分中占比最大,通常是蒸腾失水的主要部分[26]。结合水在细胞内与可溶性蛋白质、糖、亲水胶体等物质以氢键等形式牢固结合,不流动也不直接参与代谢活动,但有助于维持组织形状、硬度和弹性。不易流动水介于自由水和结合水之间,在果蔬组织水分中占比较小[27]。LF-NMR技术可分析被检样品中的氢质子离子信号,通过T2反演谱信号的幅值反映样品中水分的信号强度,并以T2反演谱横向弛豫时间长短变化区分样品中的水分状态。如图3A所示,T2弛豫时间总体可以分为三段:T21(0.01~10.00 ms)、T22(10.00~100.00 ms)和T23(100.00~10000.00 ms),其各自弛豫时间长短表示不同状态水分流动性强弱,即T21、T22和T23分别代表样品中的结合水、不易流动水和自由水。图3B为结合水、不易流动水和自由水的含量,分别以A21、A22和A23表示,并以它们的加和A2T为总水分含量。由图3B中可以看出,黄金百香果果实总水分含量在贮藏期间不断显著下降(P<0.05),其中自由水含量(A23)占比高于其它两种状态水分,并且在贮藏期间呈先缓慢下降随后下降加快的趋势,在三种水分中含量降幅最大。结合水(A21)是黄金百香果果实中含量第二高的水分,在贮藏期间呈逐渐减少的趋势,且在贮藏后期减少较快;不易流动水含量(A22)在果实贮藏0~12 d期间无明显变化,随后略有增加,在第15 d出现峰值。因此,可认为自由水是黄金百香果失水的主要部分;结合水含量占比次之,在贮藏期内也逐渐降低,说明果实已出现深度失水;不易流动水含量在贮藏期间变化幅度不大,可能与果实深度失水导致结合水向不易流动水转化有关。上述结果与在鲜枣[28]、李子[29],梨[30]等果实中检出的水分组成及采后各状态水分含量变化趋势相似。
图3C为根据采后黄金百香果不同贮藏时间的LF-NMR弛豫特性指标降维后的PCA图,其中PC1和PC2贡献率为98.6%,表明降维后的数据能够很好地表征原始数据。由图中可以看出,黄金百香果采后不同贮藏时间下水分状态的特征值相距较远,表明随着贮藏时间变化,果实水分状态差异明显;随着贮藏时间延长,水分特征得分值在PC1方向逐渐远离贮藏初始(0 d)分值,在贮藏前9 d,得分分布在PC1正半轴,随着贮藏延长至9 d以后,分值移向PC1负半轴,说明此时果实水分状态已出现较大变化;贮藏末期(15~18 d),主成分得分处于PC1负半轴,说明此时黄金百香果水分状态同贮藏初期相比已经产生显著变化。
2.2.3 黄金百香果贮藏期间失重率和果皮水分含量变化 如图4所示,黄金百香果失重率在贮藏前12 d逐渐升高,随后快速上升,贮藏18 d时达到17.94±0.98%。黄金百香果果皮含水量在贮藏前9 d缓慢下降,9~18 d下降较快,整个贮藏期间降幅达5.51%。由此可知,黄金百香果在贮藏期间失水情况与T2反演谱结果一致,其采后失水在果实衰老阶段加快,并且果皮失水明显,是整果失水的重要阶段。结合黄金百香果采后不同贮藏期的生理状态以及自由水和结合水含量变化情况,可认为其采后失水与成熟衰老进程密切相关,不仅可引起果实内部结构、外观和质量的显著变化,还可造成生理代谢活动变化,影响果实各方面品质。

图 4 黄金百香果果实在贮藏期间失重率和果皮水分含量的变化Fig.4 Changes of weight loss rate and peel moisture content in golden passion fruit during storage
2.3 黄金百香果贮藏期间的品质变化
2.3.1 黄金百香果贮藏期间果皮色差和色素含量变化 果实表皮色泽是衡量果实商品品质及消费者接受程度的直接依据,也是果实采后成熟过程的显著标志,通常与果实表皮中叶绿素降解,花青素、类胡萝卜素等色素物质积累有关[31],并且后熟过程中代谢水平旺盛时,颜色转变也较快。而细胞深度失水时,细胞结构难以维持,导致正常的代谢作用受破坏,物质转化的分解方向作用加强[32]。
由图5A可以看出,采后黄金百香果L*值在贮藏前3 d迅速升高,3~15 d未出现较大变化,15~18 d略微下降,说明果实表面亮度在贮藏初期迅速升高,随后较为稳定,在贮藏末期有所降低;图5B和图5C表明,果实表面a*和b*值在贮藏0~3 d期间迅速升高,此时a*值为负,说明在0~3 d果实表皮以绿色为主,同时迅速由绿转黄;a*和b*值在6~18 d上升趋势较缓,表明在贮藏中后期果皮黄色逐渐加深。由图5D可以看出,黄金百香果表皮h°值在贮藏0~9 d快速升高,随后无明显变化,表明在贮藏前期果实表皮色调发生明显转变,果实完熟转色后,表皮色调较为稳定。由图5E可知,采后黄金百香果在贮藏过程中果皮叶绿素含量不断下降,在18 d时仅有0.0142 mg/g;而果皮类胡萝卜素含量在0~6 d迅速升高,6~12 d迅速降低,随后缓慢下降。上述结果表明,黄金百香果在采后成熟过程中(0~6 d),果皮叶绿素和类胡萝卜素含量的明显变化使表皮颜色由青绿色转向金黄色,同时亮度和色调均快速上升;在贮藏后期(9~18 d),类胡萝卜素含量迅速降低,百香果果皮保持金黄色,果皮亮度和色调变化较小。此外,结合黄金百香果后熟期间果实自由水和果皮水分含量降低较慢,而贮藏后期二者均快速降低的趋势(图3B和图4),可推断贮藏前期较少的果实失水维持了果皮色素合成与降解,保持了果实鲜亮的外观色泽;而在贮藏后期,随着果实衰老和严重失水,果皮叶绿素继续降解,类胡萝卜素分解方向增强,果皮亮度和色调有所降低。
2.3.2 黄金百香果贮藏期间TSS和TA含量的变化采后果实滋味变化与呼吸作用和蒸腾失水密切相关[33]。随着呼吸跃变型果实后熟的进行,淀粉等大分子碳水化合物水解,水溶性糖含量增加,果实达到最佳食用品质[34]。同时,糖和有机酸作为呼吸代谢的主要基质,随果实贮藏期延长逐渐消耗,也可影响呈味[35]。此外,细胞失水导致的水解酶活性升高也会增加糖等呼吸基质浓度,促进呼吸作用,加速物质消耗;另一方面,原生质中可溶性物质含量较高时,细胞持水力较强,不易失水,质子密度也较高[36]。如图6所示,黄金百香果果浆的TSS含量在贮藏0~3 d略有升高,3~6 d快速下降,随后缓慢降低;而果浆TA含量在贮藏0~3 d下降较快,3~6 d略有升高,随后波动下降,整体变化幅度不大。因此,采后黄金百香果果浆呈味物质含量变化主要出现在贮藏前期(0~6 d),在此期间果实出现呼吸高峰(图1),进入成熟阶段,TSS含量增加,TA含量快速降低,逐渐达到最佳食用风味,而MIR成像中质子密度较高(图2),失水较慢(图3)。据此认为,果实在成熟阶段保有较为充足的水分状态,对果实滋味形成无明显影响。在贮藏中后期,果实TSS和TA含量缓慢下降,滋味变化不明显。这可能是由于随着果实完熟和衰老,呼吸强度保持在较高水平,失水加快,促进了物质消耗,从而使TSS和TA含量下降,进一步导致细胞持水力降低,而较快的失水则一定程度上维持了可溶性糖和酸的水平。

图 5 黄金百香果果实贮藏期间果皮色差和色素含量变化Fig.5 Changes of chromatic aberration and pigment content of pericarp in golden passion fruit during storage

图 6 黄金百香果果实贮藏期间TSS和TA含量的变化Fig.6 Changes of TSS and TA contents in golden passion fruit during storage
2.3.3 黄金百香果贮藏期间硬度和腐烂率变化 失水可造成植物体水分胁迫,产生大量活性氧,攻击细胞膜系统、细胞器及蛋白质等生物大分子,引发代谢失调,加快品质劣变[37]。从细胞形态上来说,水分散失可导致细胞膨压下降,引起细胞变形、质壁分离,进而导致组织结构和质地特性改变,发生形变、皱缩[30]。此外,结合水虽较难流动,但可在果实表皮组织中大量存在,赋予组织一定的形状、硬度和弹性,因此当果实深度失水时,结合水含量的降低也会促进质地的下降[38]。上述失水导致的生理和代谢变化均可促进果实耐贮性和抗病性下降,加速果实衰老和腐烂。通常,组织脱水萎蔫程度越大,腐烂率就越高[39]。由图7A可知,黄金百香果硬度在贮藏0~15 d迅速下降,15~18 d略有降低。结合果实失水情况分析,可认为果实采后成熟衰老阶段,硬度随着自由水、结合水以及果皮含水量降低而快速下降,在贮藏末期(15~18 d)可能由于严重失水干缩从而降幅较小。如图7B所示,黄金百香果采后前3 d果实未出现腐烂,6 d起随着果实进入完熟而出现腐烂,贮藏后期(9~18 d)腐烂率显著升高(P<0.05),18 d时达到33%。由此推测,黄金百香果贮藏后期自由水和结合水快速丧失,引发的深度失水加速了代谢失调和结构特性改变,从而加剧果实衰老以及耐贮性和抗病性下降,导致果实迅速腐烂。

图 7 黄金百香果果实采后贮藏期间硬度和腐烂率的变化Fig.7 Changes of firmness and rotting rate of golden passion fruit during storage

图 8 黄金百香果采后不同状态水与采后品质相关性分析Fig.8 Correlation analysis of different water states and fruit quality factors of harvested golden passion fruit
2.4 黄金百香果果实采后水分状态及果实品质相关性分析
对贮藏期内不同状态水与采后黄金百香果果实品质指标进行Pearson相关性分析,结果如图8所示,所有指标按相关性高低排列,其中颜色越深代表相关性越高。由图8可以看出,在贮藏期内,黄金百香果果实的结合水(A21)、自由水(A23)与总水分(A2T)含量之间呈显著正相关(P<0.05),并均与果实失重率显著负相关(P<0.05),进一步验证了黄金百香果采后失水、失重与自由水和结合水的关系。在果实外观色泽方面,果皮叶绿素含量在贮藏期内分别与果皮a*值、b*值呈显著负相关(P<0.05),与果实自由水含量和果皮水分含量呈显著正相关(P<0.05);而针对不同贮藏时期色素与色差值变化的相关性分析表明,果皮类胡萝卜素含量在前6 d与果皮a*值和b*值呈正相关,同时在6~18 d与果实自由水含量和果皮水分含量呈正相关,由此可知引起果皮色泽改变的叶绿素和类胡萝卜素含量变化与不同贮藏时期的水分含量有关。滋味方面,果实自由水和结合水含量在贮藏期内与TSS含量变化呈显著正相关(P<0.05),与TA含量变化呈正相关;此外,由图1和图6可知,呼吸强度与TSS和TA含量在完熟期和衰老期(贮藏6~18 d)分别呈正相关,表明呼吸作用和水分含量变化可能同为滋味变化的主要因素。在果实质地与总体品质方面,贮藏过程中果实硬度变化与结合水、自由水与总水分含量之间均呈显著正相关(P<0.05);而果实腐烂率不仅与果皮含水量和硬度变化呈显著负相关(P<0.05),还与果实失重率呈显著正相关(P<0.05),从数理统计上验证了黄金百香果失水对果实质地和总体品质劣变的促进作用。
3 结论
本研究利用LF-NMR在黄金百香果果实中鉴别出结合水、不易流动水和自由水三种水分状态,并观察其采后水分分布变化,发现果实在常温贮藏过程中的严重失水以自由水散失为主,其含量减少了14.98%,贮藏后期结合水流失加快,与贮藏初期相比减少了3.66%,并且失水程度与果实采后成熟、衰老进程相关。在贮藏前期,果实失水较少,果实硬度降低,果实完成后熟,达到最佳品质状态,极少出现腐烂;而在贮藏后期,果实深度失水,引起代谢失调,影响果实外观色泽、细胞和组织结构特性,最终导致果实耐贮性和抗病性下降,加速品质劣变。因此,控制采后失水是百香果在商品化处理和贮运流通环节保鲜的关键核心问题之一,其深层次失水机制、调控机理以及控制措施值得深入研究。LF-NMR技术能够实现果实采后失水及水分状态的快速、无损检测,在采后果蔬品质研究与保鲜技术评价方面具有很好的应用前景。
