功能性椰子植物酸奶贮藏过程中功能成分及活性的变化
2023-01-03赵晓明张玉锋赵松林
赵晓明,宋 菲 ,张玉锋,赵松林,王 挥
(1.中国热带农业科学院椰子研究所,海南文昌 571300;2.劲牌有限公司,湖北大冶 435100;
3.海南省椰子深加工工程技术研究中心,海南文昌 571339)
随着经济和生活水平的提高,人们越来越重视健康饮食。酸奶由于具有易消化吸收、抗过敏、改善肠道菌群平衡等功效,且具有良好的口感和风味而受到消费者的广泛青睐。但对于乳糖不耐症者或者由于饮食偏好而想要非乳制品酸奶的素质主义者来说,无乳糖的非乳制品植物酸奶便成了最优选择。植物酸奶不含胆固醇和乳糖,产品质构特性与传统酸奶大体相似,在健康和实现资源可持续利用方面,是传统乳制品酸奶的理想替代品。因此,植物酸奶成为了近些年研究的热点。
植物酸奶,也称为非乳制品植物性酸奶,是在含有一定蛋白质的植物和(或)其制品为原料的基础上进行乳酸菌发酵加工制成的酸奶产品[1]。目前关于植物酸奶的研究主要由基于椰子或大豆的产品主导,并且主要集中于工艺研究。Wang等[2]利用黄大豆和鹰嘴豆为原料,然后加入0.5%的非乳制品酸奶发酵剂,混合后于42 ℃下发酵16 h,研制出鹰嘴豆植物酸奶。马文艺[3]利用未经加工处理的豌豆提取液和大豆浆为原料(调整蛋白质浓度为2.5%),加入0.004%的直投式发酵剂进行发酵分别制备出豌豆植物酸奶和大豆植物酸奶。Pachekrepapol等[4]研究了木薯淀粉对椰子酸奶感官、乳酸菌活力以及流变学特性的影响,结果表明木薯淀粉的添加可以改善椰子酸奶品质。韩喜艳等[5]利用椰浆为原料发酵制备出风味口感良好、理化性质优良的椰子植物酸奶。这些研究都丰富了植物酸奶产品种类。最近表明,利用植物资源对酸奶进行强化不仅可以提高酸奶的质量特性,还可以提高酸奶的功能活性[6]。椰子水作为优质的植物原料,具有较好的营养健康特性,例如抑菌、抗氧化、降血糖、抗炎及保护心脏等作用[7-9],加入到植物酸奶中可以起到协同增效作用,提高酸奶的抗氧化和降血糖功效。
课题组前期以椰浆和浓缩椰子水为原料,通过乳酸菌发酵制备了功能性椰子植物酸奶,并对加工工艺进行了优化,同时初步探讨了抗氧化活性[1]。在此基础上,本文进一步研究功能性椰子植物酸奶贮藏过程中的抗氧化与降血糖活性变化。分析贮藏过程中多酚和黄酮含量的变化,并通过自由基清除能力、还原力、抑制脂质过氧化能力、铜离子螯合能力来评价酸奶在贮藏过程中的抗氧化活性,采用α-葡萄糖苷酶和α-淀粉酶活性抑制率评价其降血糖活性,同时与对照酸奶进行对比。本研究为功能性植物酸奶的开发提供理论与技术支撑。
1 材料与方法
1.1 材料与仪器
原榨椰浆 海南文昌南椰实业有限公司;浓缩椰子水 上海欣融食品原料有限公司;添加剂(乙酰化二淀粉磷酸酯、单硬脂酸甘油酯) 上海华宝孔雀香精有限公司;没食子酸 上海麦克林生化有限公司;芦丁 生工生物工程(上海)股份有限公司;菌种(保加利亚乳杆菌Lactobacillus bulgaricus、嗜热链球菌Streptococcus thermophilus) 西安千叶草生物科技有限公司;2,2-二苯基-1-苦基肼(DPPH) 梯希爱(上海)化成工业发展有限公司;2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)、新亚铜、硫代巴比妥酸、卵磷脂 上海阿拉丁生化有限公司;邻苯二酚紫 罗恩试剂有限公司;TPTZ(2,4,6-三吡啶基三嗪) 上海阿达玛斯试剂有限公司;邻苯三酚、PNPG(对硝基苯基-β-D-吡喃半乳糖苷)、3,5-二硝基水杨酸(DNS)、阿卡波糖 上海源叶生物科技有限公司;α-葡萄糖苷酶(来源于酿酒酵母,14.5 U/mg),α-淀粉酶(11 U/mg固体) 美国Sigma公司;其他试剂均为分析纯。
Thermo Fisher离心机 广州立诺自动化设备有限公司;Rolling Incubator QB-328旋转培养器 海门市其林贝尔仪器制造有限公司;卡士Couss CF-3500发酵箱 中山卡士电器有限公司;Varioskan Flash 全波长多功能酶标仪 美国Thermo公司。
1.2 实验方法
1.2.1 功能性椰子植物酸奶的制备 功能性椰子植物酸奶的制备参考赵晓明等[1]的方法。取鲜榨椰浆在低温12000 r/min的条件下离心15 min,按重量计算,除去一定质量的上层油脂,混合均匀后获得脂肪含量为10%的脱脂椰浆(蛋白质含量3.51%、还原糖含量1.03%、总糖含量4.92%)。将4%浓缩椰子水和添加剂(单硬脂酸甘油酯0.22%、乙酰化二淀粉磷酸酯0.13%)按相应比例加入到脱脂椰浆中,搅拌均匀,并在25 MPa的压力下均质后,进行热处理杀菌(65 ℃/30 min)。杀菌后冷却到40 ℃左右按接种量3%、接种比例为1:1的嗜热链球菌和保加利亚乳杆菌,然后在发酵箱中进行发酵8 h,发酵结束后迅速冷却至10 ℃以下,放入4 ℃的冰箱中后熟48 h,即得功能性椰子植物酸奶。其中对照酸奶为不添加浓缩椰子水,其他工艺与功能性椰子植物酸奶一致。于第0、7、14、21、28 d分别测定对照酸奶和功能性椰子植物酸奶的各项指标。
1.2.2 酸奶提取液的制备 酸奶提取液参考文献[10]中的方法进行制备并略作修改。取20 g酸奶样品,用20 mL蒸馏水稀释,在旋转培养器中连续搅拌30 min,然后再在4 ℃、10000 r/min的条件下离心10 min,离心结束后迅速取出,收集上清液并用滤膜过滤(0.22 μm),滤液冷冻储存在-20 ℃直至分析。
1.2.3 含量的测定
1.2.3.1 总酚含量的测定 采用福林酚-比色法测定总酚含量,参考刘梦瑶[11]方法并略做修改。准确取0.5 mL的酸奶提取液于试管中,加入2.5 mL福林酚试剂,充分混匀并静置反应5 min,再加入2 mL 7.5%Na2CO3溶液,混匀后室温下反应60 min,于波长765 nm处测吸光值。以没食子酸(0~1.4 mg/mL)为标准品作标准曲线,其中以没食子酸浓度为横坐标,吸光值为纵坐标,得到的标准曲线方程为y=77.903x-0.9877,R2=0.9993。根据标准曲线计算酸奶样品中的总酚含量。
1.2.3.2 黄酮含量的测定 采用亚硝酸钠-硝酸铝比色法测定黄酮含量,参考Zhang等[12]方法并略做修改。取0.5 mL的样品于试管中,加入50 μL 5%亚硝酸钠,室温反应6 min后,再加入100 μL 10%的三氯化铝,反应5 min,最后再加入0.5 mL 1 mol/L的氢氧化钠,在波长500 nm处测吸光度。以芦丁(0~1 mg/mL)为标准品绘制标准曲线,其中芦丁浓度(mg/mL)为横坐标,吸光值为纵坐标,得到的标准曲线方程为y=0.211x+0.0042,R2=0.9987。根据标准曲线计算酸奶样品中的黄酮含量。
1.2.4 抗氧化活性的测定
1.2.4.1 DPPH自由基清除活性 DPPH自由基清除活性的测定参考赵晓明等[1]的方法。在2 mL试管中分别加入1 mL 2 mg/mL酸奶样品提取液和1 mL 0.1 mmol/L的DPPH溶液,摇匀,室温下暗处放置30 min后,在5000 r/min下离心5 min,取上清液于517 nm处吸光度。其中样品对照组以等体积无水乙醇代替DPPH溶液,对照组以等体积蒸馏水代替样品溶液,每组实验平行3次。计算公式如(1)所示。

1.2.4.2 ABTS自由基清除活性 ABTS自由基清除活性的测定参考张玉锋等[13]的方法,并稍作修改。取3 mg/mL的酸奶样品提取液0.5 mL与4 mL的ABTS工作液(5 mL 7 mmol/L的ABTS溶液与88 μL 140 mmol/L过硫酸钾混匀,室温避光静置12~16 h后,用无水乙醇稀释至734 nm处的吸光值为0.70±0.02,即得ABTS工作液)充分混匀后,30 ℃水浴10 min后,以5000 r/min离心5 min,取上清液测定734 nm处的吸光值。其中对照组和样品对照组分别以等体积无水乙醇代替样品溶液和ABTS工作液,每组实验平行3次。计算公式如(1)所示。
1.2.4.3 羟基自由基清除活性 OH自由基清除活性测定参考张玉锋等[13]的方法,并稍作修改。在10 mL试管中依次加入1 mL的6 mmol/L硫酸亚铁溶液和1 mL的6 mmol/L水杨酸-乙醇溶液;再依次加入1 mL 8 mg/mL的酸奶样品提取液与1 mL的6 mmol/L的过氧化氢溶液,摇匀后室温静置30 min后,测定510 nm处吸光度。其中以等体积蒸馏水代替H2O2溶液作为样品对照组,以等体积蒸馏水代替样品溶液作为对照组,每组实验平行3次。计算公式如(1)所示。
1.2.4.4 超氧阴离子自由基清除活性 超氧阴离子自由基清除活性的测定参考信亚伟[14]的方法,并稍作修改。取0.9 mL的0.05 mol/L pH8.2的Tris-HCl放置于室温20 min,然后加入30 mg/mL的样品提取液0.2 mL,再加入80 μL 7 mmol/L的邻苯三酚溶液,混匀,置于室温反10 min,然后加入2滴10 mol/L浓盐酸终止反应,于325 nm处测定吸光值。其中对照组以蒸馏水代替样品,空白组以蒸馏水代替邻苯三酚,每组实验平行三次。计算公式如(1)所示。
1.2.5 还原力的测定
1.2.5.1 总还原力的测定 总还原力的测定参考戴梓茹等[15]的方法。采用铁氰化钾法检测还原力,取1.0 mL 35 mg/mL的样品,先后向其中加入0.5 mL pH6.6的磷酸盐缓冲液,0.5 mL 1%铁氰化钾溶液,混匀,置于50 ℃水浴20 min,加入0.5 mL 10%三氯乙酸以及0.1 mL 0.1%三氯化铁,混匀静置10 min,于700 nm测吸光值,以蒸馏水为空白,吸光值越高,表明还原力越强,抗氧化效果越好。
1.2.5.2 铁离子还原力 铁离子还原力的测定参考Muniandy等[16]的方法,并稍作修改。FRAP试剂由0.3 mmol/L醋酸缓冲液(pH3.6),20 mmol/L FeCl3·6H2O溶液和10 mmol/L TPTZ溶液混合而成,其中醋酸缓冲液:FeCl3·6H2O:TPTZ=10:1:1(v/v/v)。测定时将0.1 mL 25 mg/mL的样品与0.8 mL FRAP溶液依次添加到具塞试管中,充分混合后在室温下避光静置30 min,在593 nm处测定吸光度,以蒸馏水调零,吸光值越高,表明抗氧化效果越好。
1.2.5.3 铜离子还原力 铜离子还原力的测定参考Karadirek等[17]的方法,并稍作修改。取25 μL 40 mg/mL样品溶液于2 mL离心管中,并加入5 mmol/L的硫酸铜溶液250 μL、7.5 mmol/L的新铜溶液250 μL、1 mmol/L pH7.0的醋酸铵缓冲液250 μL以及250 μL的蒸馏水,混匀后置于室温反应30 min,在450 nm处测吸光度,以蒸馏水为空白,吸光值越高,表明抗氧化效果越好。
1.2.6 抗脂质过氧化能力 酸奶中抗脂质过氧化能力参考曹炜等[18]的方法。在10 mL的玻璃试管中加入0.2 mL的脂质体液体和0.5 mL 40 mg/mL样品溶液,混匀,再分别加入50 mmol/L FeSO4溶液50 μL和0.05 mol/L(pH=7.4)的磷酸缓冲液2.25 mL,然后置于37 ℃水浴中温育40 min,每10 min振摇一次。水浴完成后,分别向各管加入1 mL 10%三氯乙酸和1 mL 0.8%硫代巴比妥酸,混匀,置沸水中水浴15 min,冷却后8000 r/min的条件下离心8 min,取上清液在532 nm处测定吸光度。其中对照组以蒸馏水代替样品溶液,样品对照组以磷酸缓冲液代替FeSO4溶液。其中各酸奶样品提取液的测定浓度均为40 mg/mL。
1.2.7 铜离子螯合能力 酸奶铜离子螯合能力的测定参考沈刚[19]的方法并稍作修改。取1 mL 50 mmol/L的乙酸钠缓冲溶液,加入l00 μL 5 mmol/L CuSO4和100 mL 50 mg/mL的样品溶液,混合均匀后静置反应10 min,再向其中添加80 μL 4 mmol/L的邻苯二酚紫溶液,摇匀后反应20 min,于632 nm波长处测定吸光度。其中对照组以蒸馏水代替样品,样品对照组以蒸馏水代替CuSO4溶液。计算公式如下:


1.2.8 降血糖活性的测定
1.2.8.1α-葡萄糖苷酶抑制能力 参考张玉锋等[20]的方法,并稍作修改。在10 mL试管中分别加入0.4 mL浓度为10 mg/mL的酸奶样品提取液、0.4 mL 0.04 U/mL酶液和0.4 mL的PBS(pH6.8,0.1 mol/L),在37 ℃的水浴锅中加热5 min;再分别加0.2 mL 0.5 mmol/L的pNPG溶液,混匀,继续在37 ℃水浴锅中加热30 min,取出再加0.5 mL 0.2 mol/L的Na2CO3溶液,混匀。室温下静置5 min后,以5000 r/min离心5 min,取上清液于405 nm波长处测定吸光值。以磷酸盐缓冲液作为空白调零,以磷酸盐缓冲液分别代替对照组中的样品,空白对照组中的酶液和样品,样品对照组中的酶液,每组实验平行3次。计算公式如下:
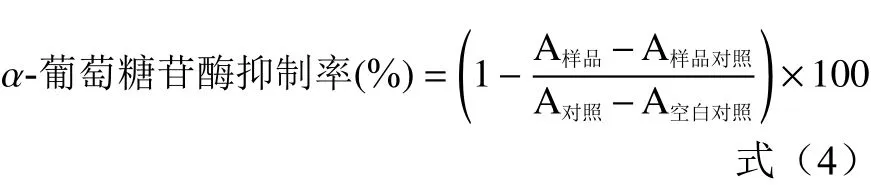
1.2.8.2α-淀粉酶抑制能力 参考张玉锋等[20]的方法,并稍作修改。将0.5 mL浓度为30 mg/mL的酸奶样品提取液与0.5 mL 1 U/mL的α-淀粉酶溶液混合,并加入0.5 mL PBS(pH6.9,0.1 mol/L),在温度37 ℃的水浴锅中水浴10 min;加入0.5 mL 1%的可溶性淀粉,继续在37 ℃水浴10 min;加入1 mL DNS试剂终止反应,并立即在水浴锅中用沸水浴5 min,灭酶。待冷却到室温后,加入10 mL的蒸馏水稀释,测定540 nm处吸光度。以磷酸盐缓冲液作为空白调零,以磷酸盐缓冲液分别代替对照组中的样品,空白对照组中的酶液和样品,样品对照组中的酶液,每组实验平行3次。计算公式如下:
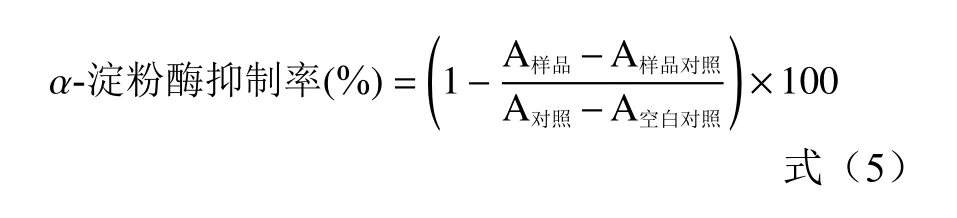
1.3 数据处理
所有实验均做三次平行,用SPSS(21.0)统计软件对所有数据进行单因素方差分析(ANOVA),用Excel(2016)对数据进行作图,每项分析的结果均以平均值±标准差表示。P<0.05表明在统计学上有显著性差异。
2 结果与分析
2.1 酸奶贮藏过程中总酚和黄酮含量的变化
2.1.1 总酚含量的变化 贮藏期间各酸奶样品的总酚含量变化如图1所示。从图1中可以观察到,两种酸奶在0~28 d内总酚含量均呈现出显著下降趋势(P<0.05),贮藏期间,功能性椰子植物酸奶和对照酸奶提取液的总酚含量分别从初期的(790.16±30.77)μg/mL、(495.82±28.09)μg/mL下降到末期的(248.38±19.09)μg/mL、(113.45±24.31)μg/mL,整个期间的降幅分别为68.57%、77.08%。Qiu等[21]研究添加玫瑰花提取物制作的酸奶和对照酸奶冷藏至21 d时的多酚含量也显著降低(P<0.05);Cho等[22]研究表明添加橄榄叶热水提取物的酸奶样品的总酚含量也随着储存时间的延长而降低,与本研究趋势一致。酸奶总酚的降低一方面可能是由于在冷藏储存期间,在乳酸菌存在下聚合酚类物质的分解所导致的[23];另一方面也有可能由于活性酚类化合物与蛋白之间的相互作用,以及酸奶中某些热、光或氧敏感酚类物质在贮藏过程中的降解所引起[24]。以上结果表明,贮藏期间,功能性椰子植物酸奶中总酚类物质的含量随着贮藏时间的增加逐渐降低,但其含量和稳定性均高于对照酸奶。

图 1 酸奶贮藏期间总酚含量的变化Fig.1 Changes of polyphenol content in yogurt during storage
2.1.2 黄酮含量的变化 贮藏期间各酸奶样品提取液的黄酮含量变化如图2所示。从图2中可以观察到,功能性椰子植物酸奶的黄酮含量在前14 d变化不大,14~21 d显著下降(P<0.05),从(95.59±4.58)μg/mL降低至(75.01±2.04)μg/mL,后期略有升高,但变化差异不大(P>0.05),整个贮藏末期较初期相比,降低了12.31%。在0~28 d内,对照酸奶的黄酮含量略降低,从(75.72±2.56)μg/mL降至(64.09±2.47)μg/mL,下降幅度为15.37%。上述结果表明,贮藏期间功能性椰子植物酸奶的黄酮含量虽有所下降,但仍高于对照酸奶。

图 2 酸奶贮藏期间黄酮含量的变化Fig.2 Changes of flavonoid content in yogurt during storage
2.2 酸奶贮藏过程中抗氧化活性的变化
酚类化合物可作为抗氧化剂,通过其提供氢或电子的能力导致链式反应的终止,或通过螯合过渡金属离子从而终止Fenton反应[16]。直接清除自由基的化合物被称为初级抗氧化剂,而通过Fenton反应防止自由基形成的化合物被称为次级抗氧化剂,可通过测定自由基清除能力和还原力反映样品的主要抗氧化性能,测定金属螯合能力反映样品的次要抗氧化性能[16]。由于酸奶样品的总抗氧化能力可能是由多种反应机制导致的,单一的抗氧化测定可能无法完全准确反映样品的抗氧化能力,因此,本研究使用自由基清除能力、还原力、抗脂质过氧化能力及铜离子螯合能力四种不同的方法来评估功能性椰子植物酸奶和对照酸奶的抗氧化活性。
2.2.1 自由基清除率的变化 酸奶贮藏期间自由基清除率(DPPH、ABTS、羟基及超氧阴离子自由基)的变化见图3。由图3可知,随着储藏时间的延长,功能性椰子植物酸奶的DPPH、ABTS、OH及O2-自由基清除活性表现出相似的变化规律,都是先升高后降低。在贮藏0~7 d,功能性椰子植物酸奶的DPPH、ABTS、羟基自由基的清除能力显著升高(P<0.05),并在第7 d时活性达到了整个贮藏期内的最大值,分别为51.27%±1.83%、97.49%±0.09%、82.74%±1.67%,随后都逐渐降低。两种酸奶的超氧阴离子自由基清除能力在第14 d时达到最大,在14~28 d呈显著下降趋势(P<0.05),其中功能性椰子植物酸奶在14 d较0 d相比,其活性增幅为17.77%。自由基清除活性的降低,可能是因为在贮藏过程中,酸奶样品中的蛋白-多酚类物质发生共和与非共和结合作用,使得体系中能够参与自由基清除反应的游离态多酚类物质含量减少[25]。也有研究称乳蛋白的交联作用阻碍其酚环上羟基等活性基团的供电子能力[26],从而使抗氧化活性随之降低。李郭浪等[27]报道了山药山楂酸奶随着贮藏时间的延长,其抗氧化活性也是先增高后降低,与本文研究结果一致。总体上看,功能性椰子植物酸奶在贮藏过程中对四种自由基清除率均显著高于对照酸奶,可能是由于椰子水中的多酚、多糖及蛋白类等抗氧化成分发挥了作用。

图 3 酸奶贮藏期间DPPH(a)、ABTS(b)、羟基(c)、超氧阴离子(d)自由基清除率的变化Fig.3 Changes of DPPH (a), ABTS (b), hydroxyl (c), superoxide anion (d) radical scavenging rates in yogurt during storage
2.2.2 还原力的变化 酸奶贮藏过程中还原力的变化如图4所示,从图中可以观察出两种酸奶随着贮藏时间的增加,总还原力、铜离子还原力以及铁离子还原力变化趋势均不一致,在储藏0 d时,功能性椰子植物酸奶的总还原力、铜离子还原力、铁离子还原力均显著高于对照酸奶(P<0.05)。功能性椰子植物酸奶和对照酸奶的总还原力的吸光度在7 d时达到最大,随后略有下降;铜离子还原力在21 d呈现最低值,贮藏末期又有所提高,末期较初期相比,保留率分别为66.37%、51.25%。功能性椰子植物酸奶的铁离子还原力在0~21 d逐渐降低,到28 d又显著增高(P<0.05),这与铜离子还原力的变化趋势一致。分析以上结果可以得知,整个贮藏期间,酸奶的总还原能力、铜离子和铁离子还原能力均有所下降,其中功能性椰子植物酸奶的三种还原力都高于对照酸奶。Vital等[28]研究添加平菇水提物的低脂酸奶的铁离子还原力等抗氧化活性随着贮藏时间的延长而逐渐降低,Pan等[29]研究添加石榴汁粉的酸奶的铁离子还原力和DPPH自由基清除能力也着贮藏时间的延长而逐渐下降,均与本研究结果趋势一致。

图 4 酸奶贮藏期间总还原力(a)、铜离子还原力(b)、铁离子还原力(c)的变化Fig.4 Changes of total reducing power (a), reducing power of copper ions (b) and reducing power of iron ion (c) in yogurt during storage
2.2.3 抗脂质过氧化能力的变化分析 生物膜的主要成分是蛋白质和磷脂,其中磷脂含有多不饱和脂肪酸,最容易发生脂质过氧化,而脂质过氧化是引起许多疾病的重要因素之一。在本文中,Fe2+被用作脂质过氧化的起始因子,而卵磷脂脂质体被用作研究酸奶提取物抑制脂质过氧化能力的模型[18]。贮藏过程中酸奶的抗脂质过氧化能力变化如图5所示,从图中可以观察到,功能性椰子植物酸奶的抗脂质过氧化能力在0~7 d显著增高(P<0.05),从38.58%±3.09%增长至61.68%±2.33%,增加幅度为59.88%,在7~14 d没有显著性变化(P>0.05),在14~28 d显著降低(P<0.05),从63.31%±2.33%降到41.93%±2.09%,降幅为33.77%,其中28 d与0 d相比,没有显著变化(P>0.05),但略增长8.68%;对照酸奶的抗脂质过氧化能力在第14 d达到最大,为42.99%±1.68%,到贮藏末期28 d结束时仅为18.22%±2.14%。综合以上结果可以得出,功能性椰子植物酸奶在贮藏过程中的抗脂质过氧化能力的变化情况与自由基清除能力、还原力变化情况大致相同,贮藏后期活性均有所下降 ,且功能性椰子植物酸奶活性大于对照酸奶。
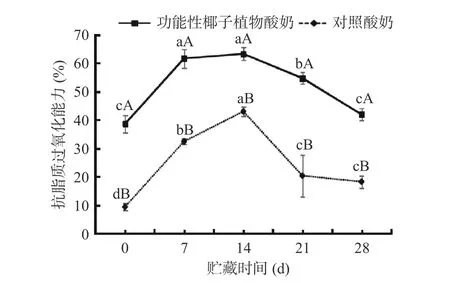
图 5 酸奶贮藏期间抗脂质过氧化能力的变化Fig.5 Changes of anti-lipid peroxidation ability in yogurt during storage
2.2.4 铜离子螯合能力的变化分析 抗氧化剂可以分为三种不同的机制,即电子转移(ET)、氢原子转移(HAT)和金属螯合,其中金属螯合包括Fe2+、Cu2+和Zn2+。金属的螯合能力被认为是评估抗氧化活性的次要机制化合物,最近的一些研究也证明了金属,特别是Fe2+和Cu2+,能参与抵消一些非传染性退行性疾病,如阿尔茨海默氏症、帕金森氏症和威尔逊氏症以及心血管疾病[30]。如图6所示,两种酸奶对铜离子的螯合能力随着贮藏时间的延长,呈现出先降低后增高的趋势。功能性椰子植物酸奶的铜离子螯合能力在0~14 d内显著下降(P<0.05),从83.32%±2.89%降至29.24%±3.82%,其中在14~21 d时,无显著变化(P>0.05);21~28 d时,酸奶螯合能力逐渐上升(P<0.05),到贮藏末期升至57.07%±8.89%。但总体上,两种酸奶在不同贮藏期的铜离子螯合能力变化规律相似,整体呈下降趋势,但功能性椰子植物酸奶的螯合率始终大于对照酸奶。根据Oh等[31]的研究报道,添加植物提取物的酸奶具有更高的抗氧化活性,这很可能是植物提取物的植物化学成分和微生物代谢活动的结果,而且储存过程中微生物的持续生长也有可能会改变一些酚类化合物,从而增加抗氧化活性。因此,补充植物提取物的酸奶具有与高抗氧化活性相关的潜在健康益处。

图 6 酸奶贮藏期间铜离子螯合能力的变化Fig.6 Changes of chelating capacity of copper ions in yogurt during storage
2.3 酸奶贮藏过程中降血糖活性的变化
糖尿病是由遗传性或获得性胰岛素分泌不足以及器官对分泌胰岛素的反应性降低引起的代谢性疾病。治疗糖尿病的一种有效方法是降低餐后高血糖,通过抑制消化道中的碳水化合物水解酶(如α-淀粉酶和α-葡萄糖苷酶)来延缓葡萄糖的吸收,这些酶的抑制剂(如阿卡波糖)会延迟碳水化合物的消化并延长整体碳水化合物的消化时间,导致葡萄糖吸收率降低,从而减缓餐后血糖升高[32]。因此,本文通过α-葡萄糖苷酶和α-淀粉酶活性抑制试验来评价酸奶样品的体外降血糖活性。
如图7所示,两种酸奶样品都表现出α-葡萄糖苷酶和α-淀粉酶抑制活性,随着贮藏时间的增加,α-葡萄糖苷酶的抑制作用呈增加趋势,然而α-淀粉酶的抑制作用呈下降趋势。功能性椰子植物酸奶的α-葡萄糖苷酶抑制率在0~14 d没有显著性变化(P>0.05),在14~21 d时显著增长(P<0.05),从43.76%±4.17%增至53.30%±2.92%,增幅为21.80%,21~28 d变化不显著(P>0.05)。而对照酸奶在7 d内没有显著变化,后期显著升高,到28 d时达到最大抑制率,为45.66%±2.50%。在0~7 d,功能性椰子植物酸奶的α-淀粉酶抑制活性虽没有显著差异(P>0.05),但还是略增长了3.92%,而对照酸奶明显下降;7~14 d,两种酸奶的α-淀粉酶抑制率均有所下降,分别从79.33%±1.08%、15.77%±0.63%降至55.23%±1.01%、14.33%±1.73%,整个期间下降幅度分别为43.65%、10.00%。

图 7 酸奶贮藏期间α-葡萄糖苷酶(a)、α-淀粉酶(b)抑制率的变化Fig.7 Changes of α-glucosidase (a) and α-amylase (b)inhibition rates during yogurt storage
本研究表明,整个贮藏过程中,功能性椰子植物酸奶对α-葡萄糖苷酶和α-淀粉酶抑制率均高于对照酸奶。Ni等[33]研究表明浆果酸奶、黑加仑果渣酸奶以及对照酸奶对α-葡萄糖苷酶的抑制能力随着贮藏时间的增加而提高;Qiu等[21]研究添加食用玫瑰花提取物的酸奶样品的α-葡萄糖苷酶的抑制能力也随着时间的延长而提高,均与本文研究一致。Shori[24]研究孜然籽和香菜提取物制备的酸奶的α-淀粉酶抑制活性在0~7 d增长,在14 d后显著降低,与本文对功能性椰子植物酸奶的研究结果一致。有人提出非糖类化合物可能通过疏水相互作用与酶的活性位点结合来发挥其抑制活性[34],但其确切机制尚不清楚。除此之外,浓缩椰子水中酚类物质的存在可能有助于更好地抑制α-葡萄糖苷酶和α-淀粉酶。研究表明椰子水具有降血糖活性[7],这可能对α-葡萄糖苷酶和α-淀粉酶抑制活性有直接影响。
3 结论
本研究通过对功能性椰子植物酸奶和对照酸奶贮藏过程中多酚、黄酮含量和抗氧化、降血糖活性的测定分析,结果发现,两种酸奶的多酚含量随着贮藏时间的增长而逐渐降低,功能性椰子植物酸奶的黄酮含量在0~14 d时没有显著变化(P>0.05),但随后也有所降低,整个期间,功能性椰子植物酸奶的多酚和黄酮含量明显高于对照酸奶。贮藏28 d较0 d,功能性椰子植物酸奶的ABTS自由基清除率和抗脂质过氧化能力没有显著差异(P>0.05),DPPH、羟基和超氧阴离子自由基清除率、总还原力、铁离子和铜离子还原力、铜离子螯合能力、α-淀粉酶抑制率均有所降低,α-葡萄糖苷酶抑制率增高,且功能性椰子植物酸奶在抗氧化及降血糖活性上仍整体大幅度优于对照酸奶,一定程度上验证了添加椰子水有利于提升酸奶的抗氧化、降血糖活性,也表明了功能性椰子植物酸奶在经过较长的贮藏期后仍然可以保持较好的活性。但引起活性变化的具体原因及机制需要进一步的研究。
