猴头菌与人参双向固体发酵菌质体外抗氧化活性分析
2023-01-03王淑敏万茜淋陈长宝
唐 敏,冷 悦,王淑敏,万茜淋,王 欢,陈长宝
(长春中医药大学吉林省人参科学研究院,吉林长春 130117)
猴头菌(Hericium erinaceus)隶属担子门(Basidiomycota)伞菌纲(Agaricomycetes)红菇目(Russulales)猴头菌科(Hericiaceae)猴头菌属(Hericium)[1],具有一定的抗氧化、抗菌、抗衰老、抗肿瘤和神经保护、抗炎等作用[2-3]。作为我国传统的“药食同源”的大型真菌,因其具有重要的食用价值和药用功效而受到了消费者的广泛喜爱。人参(Panax ginsengC.A.Mey.)为多年生宿根阴性草本双子叶植物,是我国传统的名贵中药材,具有抗癌、抗肿瘤、抗焦虑和保肝护肝、保护心脑血管等活性作用,具有显著的药理活性和极高的药用价值[4-8]。
双向固体发酵是以中药材或中药材残渣为药性基质,利用药用真菌的生物活性分解代谢药性基质中的纤维、蛋白质、糖类等成分为自身提供生长所需的营养及能量,使药用真菌在药性基质的基础上通过次生代谢产物发酵对中药材的活性成分进行修饰改造,得到新的药效活性成分的一种新型发酵技术[9-10]。双向发酵过程中,真菌自身丰富的酶系统,可将药性基质中的纤维素类物质水解,从而为发酵基质的生长代谢提供能量,同时发酵基质中的营养成分也可为真菌的营养生长提供必要的养分[11-14]。朱蕴兰等[15]对蛹拟青霉与金针菇菇柄双向固体发酵后菌质的活性物质含量及抗氧化活性进行了探究,发现菌质中多糖比未经发酵的金针菇菇柄中的含量高,且经过发酵后的菌质的抗氧化活性也有所提升。
猴头菌作为自然界中一种珍贵的大型药食两用真菌,在固体发酵过程中,可通过多种次生代谢产物可对固体基质的物质基础进行改造,从而提高基质中活性物质含量。如,刘明明等[16]利用猴头菌与小麦固体培养基进行双向发酵,发现猴头菌发酵组明显提高了小麦基质中蛋白质的含量。另有研究表明,猴头菌与玉米蛋白粉的发酵产物的抗氧化活性明显增高[17]。人参经微生物固体发酵后的,其发酵产物更利于人体消化吸收。由原型人参皂苷转化得到的稀有人参皂苷Rg2、Rg3具有更高效的抗焦虑、抗炎、抗癌活性作用[18-20]。
人参已被发现含有多种活性成分,如皂苷、多糖、黄酮、挥发油等[21]。其中,人参多糖约占人参干重的10%,是人参中最丰富的活性物质,具有免疫调节、抗氧化、抗癌、消炎等作用[22]。李万丛等[23]的实验结果表明,人参经酿酒酵母发酵后,多糖的含量及活性均有一定提升。猴头菌多糖具有神经调节、抗炎、抗癌、维持胃肠道稳态以及抗氧化等多种生理活性[24]。秦培鹏等[25]优化提取方法后得到了8.87%的猴头菌多糖。YAN等[26]用不同溶剂萃取猴头菌中多糖,并对各组分多糖的抗氧化活性进行了比较研究,结果发现,提取溶剂对猴头菌多糖的结构、单糖组成、分子量等理化性质有显著的影响,其中柠檬酸提取的多糖组分具有更强的DPPH清除能力。多酚也是一类重要的抗氧化活性成分,但其在猴头菌中含量远低于猴头菌多糖[27],因此本研究主要针对发酵菌质中的多糖进行抗氧化活性分析。目前,应用猴头菌与人参进行的双向固体发酵,其发酵菌质多糖活性如何,尚未见报道。因此,本实验采取猴头菌与人参进行双向发酵,得到不同培养天数的发酵菌质。为进一步探究发酵菌质中所含营养成分,对发酵菌质及人参药性基质中的多糖及蛋白质含量进行动态跟踪,采用分级醇沉的方法进一步探究发酵菌质中活性多糖的动态变化,并对其抗氧化活性进行研究。希望通过本文的实验结果,为下一步研究发酵菌质多糖的药理作用提供理论背景,为深入开发猴头菌与人参的药用价值奠定基础。
1 材料与方法
1.1 材料与仪器
人参 吉林省怡生对外贸易有限公司;猴头菌吉林省生物研究所张金亭研究员赠予;葡萄糖、蛋白胨、磷酸二氢钾、硫酸镁、酵母粉、琼脂粉 国药集团化学试剂有限公司;2,2-联氮-二(3-乙基苯并噻唑-6-磺酸)二铵盐(ABTS)、过硫酸钾、2,4,6-三吡啶基三嗪(2,4,6-Tri(2-pyridyl)-s-triazine,TPTZ) 上海源叶生物科技有限公司;水杨酸、无水乙醇 北京化工厂。
SLI-700型恒温培养箱 上海爱朗仪器有限公司;FDU-2110型冷冻干燥机 东京理化器械株式会社;YXQ-LS-50A型压力蒸汽灭菌器 上海博迅实业有限公司;SW-CJ-2F型洁净工作台 苏州安泰空气技术有限公司;ZQZY-85CNS 型振荡培养箱 上海知楚仪器有限公司;BT 25s型电子分析天平 赛多利斯科学仪器(北京)有限公司;M200 Pro型多功能酶标仪 瑞士TECAN集团公司;A11B S025型粉碎机 德国IKA仪器设备有限公司。
1.2 实验方法
1.2.1 菌种培养 将保存于4 ℃冰箱的猴头菌菌种在无菌条件下转接到PDA固体培养基(葡萄糖20 g、蛋白胨10 g、KH2PO42 g、MgSO4·7 H2O 1 g、琼脂粉18 g、蒸馏水1 L)中,于26 ℃恒温黑暗条件下培养,待猴头菌菌丝布满培养基表面,进行猴头菌液体菌种的培养。取固体培养物转接于液体培养基中(葡萄糖20 g、蛋白胨10 g、KH2PO42 g、MgSO4·7 H2O 1 g、蒸馏水1 L),接种量7%,在26 ℃、160 r/min的黑暗条件下培养10 d,至培养基中含有大量黄色菌球时,终止液体发酵。
1.2.2 双向固体发酵菌质的制备 参照文献[28],将人参药材粉碎,过16目筛后装至培养瓶,每瓶装入20 g,加适量水,混匀,121 ℃高压灭菌30 min,待人参基质冷却至室温后,接入猴头菌液体菌种,接种量10%,室温避光培养。培养至第30 d时,猴头菌菌丝布满整个药性基质且形成了明显的菌蕾结构,为发酵终点。取出发酵菌质,40 ℃烘干,密封保存。
1.2.3 不同醇沉组分多糖的制备 准确称取10 g菌质样品,料液比为1:20 g/mL,提取温度为95 ℃,每次1 h,提取2次,过滤,合并滤液,60 ℃水浴浓缩提取至原体积的1/4。在浓缩液中加入一定量的无水乙醇使得乙醇体积分数分别达到40%、70%、90%,4000 r/min离心30 min,收集沉淀,得到3个不同菌质多糖级分(HEP-40、HEP-70、HEP-90)。以粉碎后不接种猴头菌液体菌种的人参药材为对照组,按同种方法进行醇沉,得到3个人参对照组多糖(PGP-40、PGP-70、PGP-90)。分别对上述6组多糖进行真空冷冻干燥,密封保存,备用。
1.2.4 不同醇沉多糖组分中总糖含量测定 根据文献[29]稍作改动,采用苯酚-硫酸法测定总糖含量。标准曲线制作:将烘干至恒重的无水葡萄糖配制为0.1 mg/mL的标准液,精确移取0、0.2、0.4、0.6、0.8、1 mL,并用蒸馏水补足至1 mL,振荡混匀。依次加入5%苯酚1 mL,硫酸5 mL,混匀,沸水浴5 min,冷却至室温,取出。以蒸馏水为空白,于490 nm波长处测定吸光值。标准回归方程为:Y=3.4372X+0.0042,R2=0.9980。待测样品如上条件进行测定,根据标准曲线计算总糖含量。
1.2.5 不同醇沉多糖组分中还原糖含量测定 参考文献[30]稍作修改,采用3,5-二硝基水杨酸比色法测定总还原糖(DNS)。标准曲线制作:将烘干至恒重的无水葡萄糖配制为1 mg/mL的标准液,精确移取0、0.2、0.4、0.6、0.8、1 mL,以蒸馏水补足至1 mL,震荡混匀。加入DNS溶液2 mL,混匀后,沸水浴5 min,冷却至室温,加入蒸馏水9 mL,混匀。以蒸馏水为空白,于540 nm波长处测定吸光度。标准回归方程为:Y=0.4615X-0.0079,R2=0.9989。待测样品如上条件进行测定,并根据标准曲线计算还原糖含量。
1.2.6 不同醇沉多糖组分中蛋白质含量测定 利用考马斯亮蓝法[31]测定多糖样中蛋白质含量。依次吸取0.05 mg/mL蛋白质标准溶液0、0.2、0.4、0.6、0.8、1 mL,分别加蒸馏水补足至1.0 mL,相当于含有血清蛋白的质量依次为 0、10、20、30、40、50 μg。加入4 mL考马斯亮蓝溶液,充分振荡5 min,于波长595 nm处测定吸光值。以蛋白质的质量(μg)为横坐标,以吸光度值为纵坐标,绘制蛋白标准曲线得出回归方程。标准回归方程为:Y=0.945X-0.0044,R2=0.9977。待测样品中的蛋白质含量测定方法同上。
1.2.7 不同醇沉多糖组分抗氧化活性评价
1.2.7.1 DPPH自由基清除率测定 按文献[32-33]方法,取不同质量浓度的样品溶液与DPPH溶液各2 mL,振荡摇匀,室温条件下避光放置30 min,于波长517 nm处测定吸光值。按下式计算DPPH自由基清除率X。
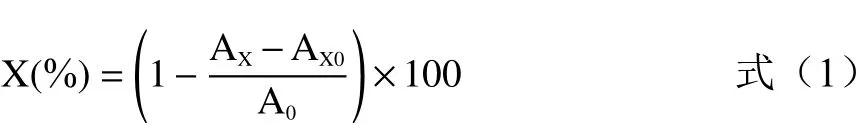
式中:AX为样品吸光值;AX0为显色剂本底吸光值;A0为空白吸光值。
1.2.7.2 羟自由基清除率测定 参考文献[34]中的方法进行测定,取1.0 mL上述多糖样品与1.0 mL(9 mmol/L)FeSO4,1.0 mL 9 mmol/L水杨酸-乙醇溶液,再加入1.0 mL(9 mmol/L)H2O2混合,摇匀,37 ℃水浴30 min后,于510 nm波长处测定AX,用1.0 mL水代替样品测定A0,用1.0 mL水代替H2O2测定AX0。清除率按上述公式(1)计算。
1.2.7.3 ABTS自由基清除率测定 参考文献[35]的方法进行ABTS自由基清除能力的测定。取上述多糖样品溶液0.2 mL与ABTS工作液2.0 mL(2.45 mmol/L的K2S2O8溶液2.5 mL与7 mmol/L的ABTS溶液2.5 mL混合均匀,测定A734nm,为0.70±0.02,即得ABTS工作液)混合均匀,振荡30 s,室温避光放置6 min后测定其在734 nm波长处的吸光度。清除率按上述公式(1)计算。
1.3 数据处理
通过GraphPad Prism 9软件作图并进行数据分析。所有实验重复3次,数据均以平均值±标准差表示,P<0.05表示差异具有显著性,P<0.01表示差异极显著,P<0.001表示差异具有高度统计学意义。
2 结果与分析
2.1 不同醇沉多糖组分中总糖、还原糖含量
通过图1、图2可知,随乙醇浓度增加,总糖含量下降,还原糖含量上升。即HEP-40和PGP-40中总糖含量最高。还原糖含量变化趋势与总糖含量变化趋势相反,即HEP-90和PGP-90中还原糖含量最高。随发酵时间延长,菌质多糖组分中总糖含量呈现出缓慢上升下降、再上升再下降的过程。其中,总糖含量在第9 d峰值,HEP-40可达0.98 mg/g,HEP-70可达0.93 mg/g,HEP-90可达0.77 mg/g,PGP-40可达1.03 mg/g,PGP-70可达0.90 mg/g,PGP-90可达0.65 mg/g。由数据可知,与PGP-40、PGP-70、PGP-90的含量相比,HEP-40、HEP-70、HEP-90的含量分别下降了4.85%、上升了3.33%和18.46%。HEP-40与PGP-40组分中的总糖含量在发酵前期呈现了显著差异(P<0.05);HEP-70与PGP-70组分中的总糖含量在发酵第18、21、27、40 d时呈现了显著差异(P<0.05);在发酵第9、12、27、40 d时,HEP-90与PGP-90组分中的总糖含量具有高度显著差异(P<0.001)。
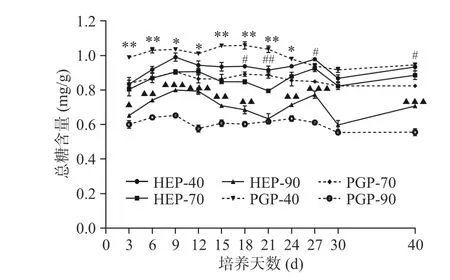
图 1 不同醇沉多糖组分中总糖含量测定Fig.1 Determination of total sugar content in different alcohol precipitation polysaccharide components
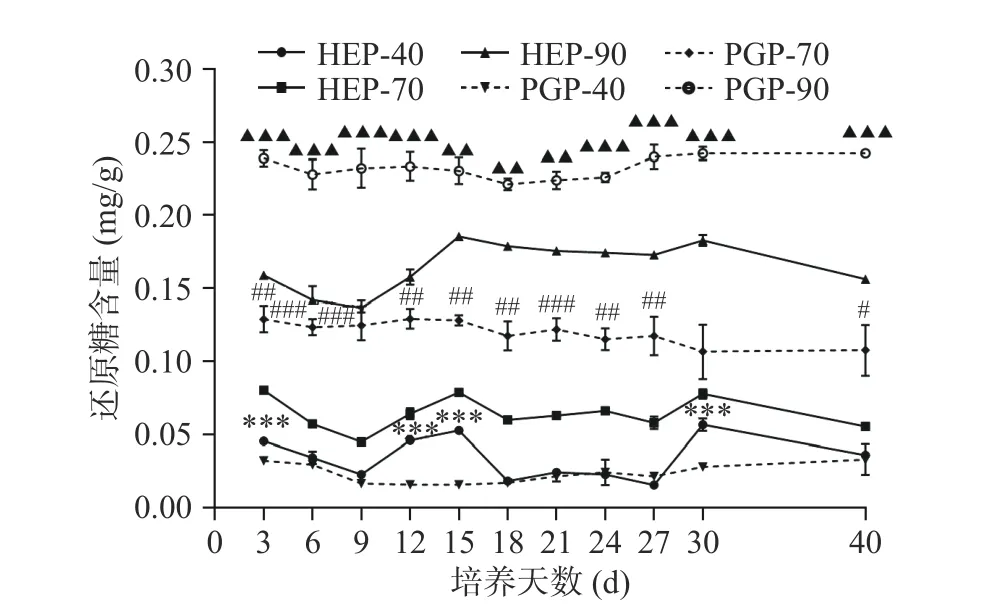
图 2 不同醇沉多糖组分中还原糖含量测定Fig.2 Determination of reducing sugar content in different alcohol precipitation polysaccharide components
HEP-40、HEP-70与HEP-90组分还原糖的含量在第 9~15 d,第 27~30 d 呈上升趋势,第 30~40 d呈下降趋势。HEP-40与PGP-40组分中的还原糖含量仅在发酵第3、12、15、30 d时呈现了高度显著性差异(P<0.001);HEP-70与PGP-70组分中的还原糖含量在发酵前期差异极显著(P<0.01);在整个发酵过程中,HEP-90与PGP-90组分中的还原糖含量均呈现了极显著差异(P<0.01)。当发酵至第30 d时,HEP-40可达0.06 mg/g,HEP-70可达0.08 mg/g,HEP-90可达0.18 mg/g,PGP-40可达0.03 mg/g,PGP-70可达0.11 mg/g,PGP-90可达0.24 mg/g。对比PGP-40、PGP-70、PGP-90的含量,HEP-40、HEP-70、HEP-90的还原糖含量分别上升了100%、下降了27.27%和25%。对比HEP与PGP组分总糖与还原糖含量变化可以发现,菌质发酵使得人参基质中的还原糖及总糖含量呈现动态变化,且40%醇沉组分表现为还原糖含量升高,而70%与90%醇沉组分表现为还原糖含量降低。而总糖变化趋势与之相反。
2.2 不同醇沉多糖组分中蛋白质含量
不同醇沉多糖组分中蛋白质含量测定结果如下图3所示,结果表明蛋白质主要集中在90%醇沉组分中,其次是70%醇沉组分和40%醇沉组分。HEP-40与PGP-40组分中的蛋白质含量在发酵第9、21、30、40 d时差异极显著(P<0.01);HEP-70与PGP-70组分中的蛋白质含量在发酵第9、21、30、40 d时差异高度显著(P<0.001);在发酵第12、30、40 d时,HEP-90与PGP-90组分中的蛋白质含量均呈现了极显著差异(P<0.01)。由蛋白质含量变化特征表明,当发酵至第12~15 d时,蛋白质含量均处于第一个上升期,发酵至第21 d左右时,各醇沉组分均达到第二个小幅度的上升期。当发酵至40 d时,菌质组蛋白质含量达到峰值,HEP-40、HEP-70、HEP-90分别可达0.15、0.24、0.54 mg/g,PGP-40、PGP-70、PGP-90分别可达0.11、0.13、0.46 mg/g。对比PGP-40、PGP-70、PGP-90的含量,HEP-40、HEP-70、HEP-90的含量分别上升了36.36%、84.62%、17.39%。通过以上数据可知,发酵后菌质组中的蛋白质含量明显提高,且与PGP-70相比,HEP-70中蛋白质的含量相对较高。
2.3 不同醇沉多糖组分的抗氧化活性测定结果
2.3.1 DPPH自由基清除率 不同醇沉多糖组分对DPPH自由基的清除率测定结果如下图4所示,随醇沉浓度的增加,各醇沉组分的DPPH自由基的清除活性由高到低为90%醇沉组分>70%醇沉组分>40%醇沉组分。对比PGP组,HEP组对DPPH自由基的清除能力更强,HEP组各醇沉组分在发酵至第24 d时对DPPH自由基的清除能力均有较好的效果,HEP-40、HEP-70、HEP-90的清除率分别为37.66%、60.06%、73.58%,与PGP-40、PGP-70、PGP-90相比,分别增长了16.46%、23.08%、5.11%。HEP-40与PGP-40组分的DPPH自由基清除率在发酵第12、24 d时差异极显著(P<0.01);HEP-70与PGP-70组分的DPPH自由基清除率在发酵第40 d时差异高度显著(P<0.001);在发酵第3 d时,HEP-90与PGP-90组分的DPPH自由基清除率呈现了极显著差异(P<0.01)。
2.3.2 羟自由基清除率 HEP组及PGP组对羟自由基的清除率测定结果如下图5所示。由图可知,各不同醇沉组分的清除能力高低为90%醇沉组分>70%醇沉组分>40%醇沉组分。HEP-40与PGP-40组分的羟自由基清除率在发酵第3、6、18、21、27、30、40 d时差异极显著(P<0.01);HEP-70与PGP-70组分的羟自由基清除率在发酵第3 d及第6 d时差异高度显著(P<0.001);在发酵第3、6、9、18、27、30、40 d时,HEP-90与PGP-90组分的羟自由基清除率差异高度显著(P<0.001)。通过对比HEP组的羟自由基清除率发现,发酵至12~18 d、24~30 d时为HEP组清除能力的上升期。当发酵至第40 d时,HEP-40、HEP-70、HEP-90的清除率分别为33.71%、54.32%、94.90%,与PGP-40、PGP-70、PGP-90相比,各醇沉组分对羟自由基清除率分别增加了50.70%、1.05%、35.80%。
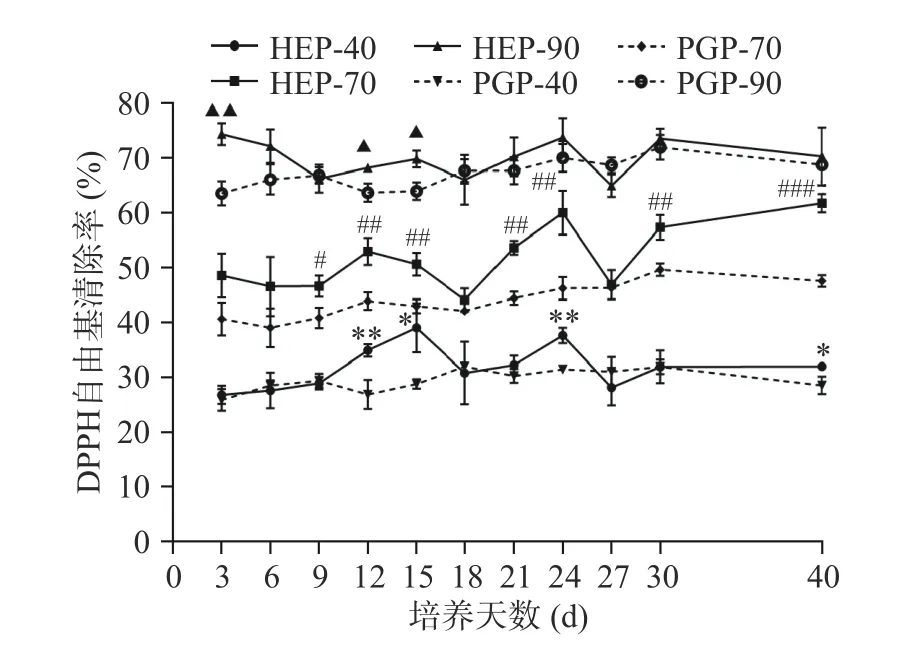
图 4 不同醇沉组分对DPPH自由基清除率测定Fig.4 Determination of the scavenging rate of DPPH free radicals by different alcohol precipitation components

图 5 不同醇沉组分对羟自由基清除率测定Fig.5 Determination of OH radical scavenging rate of different alcohol precipitation components
2.3.3 ABTS自由基清除率 不同醇沉组分对ABTS自由基的清除率测定结果如下图6所示,各醇沉组分对ABTS自由基的清除能力为90%醇沉组分>70%醇沉组分>40%醇沉组分。对HEP组对ABTS自由基的清除率分析得知,当菌质发酵至第12~18 d、第27~30 d时,为HEP组清除能力的上升期。当发酵至第40 d时,HEP组的清除能力达到峰值,HEP-40、HEP-70、HEP-90的清除率分别为44.83%、87.90%、98.90%,与PGP-40、PGP-70、PGP-90相比,各醇沉组分对ABTS自由基的清除率分别增加了21.72%、29.46%、2.06%。HEP-40 与 PGP-40 组分的 ABTS 自由基清除率在发酵第40 d时差异极显著(P<0.01);HEP-70与PGP-70组分的ABTS自由基清除率在发酵第40 d时差异高度显著(P<0.001);在发酵第27 d时,HEP-90与PGP-90组分的ABTS自由基清除率差异高度显著(P<0.001)。

图 6 不同醇沉组分对ABTS自由基清除率测定Fig.6 Determination of ABTS radical scavenging rate of different alcohol precipitation components
3 讨论与结论
猴头菌与人参多糖均具有降血糖、保肝护胃、抗氧化、抗肿瘤等功能,本文初探了菌质不同醇沉组分的活性变化[36-38]。通过对PGP组和HEP 组进行分级醇沉,得到了不同发酵时期的PGP-40、PGP-70、PGP-90和HEP-40、HEP-70、HEP-90组分,测定了其总糖、还原糖、蛋白质的含量,以及ABTS自由基、羟自由基、DPPH自由基的清除率。
通过对比不同醇沉浓度下的多糖含量变化发现,40%醇沉组分中总糖含量最高,而还原糖、蛋白质则是90%醇沉组分中含量最高。除此以外,总糖及还原糖含量的周期变化趋势也有所差异。综合分析发现,经猴头菌发酵的90%醇沉组分与未经发酵的人参基质相较,总糖与蛋白质含量有所升高,而还原糖含量有所降低,这说明了猴头菌与人参双向固体发酵后,基质营养成分发生了改变,这种改变也使得其生物活性有所提升。对比各醇沉组分的自由基清除率发现,HEP组的抗氧化能力呈现先下降再上升、再下降再上升的变化趋势,且基本在发酵至40 d时,清除率达到峰值。对比HEP组与PGP组醇沉多糖,发现发酵后菌质抗氧化活性较对照组均有提高,说明猴头菌-人参双向发酵可提升人参活性成分的抗氧化活性,这可能是由于猴头菌在发酵过程中分泌出多种胞外酶及次生代谢产物,对人参基质中多糖侧链等产生了影响,使得抗氧化活性得以提升[39]。纵观整个发酵期,当菌质发酵至第12 d和第30 d左右时,其抗氧化能力均有一定幅度的上升趋势。对比各醇沉组分的清除率发现,同浓度下各醇沉组分对自由基的清除能力强弱为ABTS自由基>羟自由基>DPPH自由基。
通过本文的物质含量及抗氧化能力的数据表明,通过猴头菌与人参进行双向发酵后,菌质中的活性物质含量增高且活性增加。该结论与MRMA等[40]的研究结果一致,利用黑曲霉及和米曲霉对葡萄渣进行固态发酵,两种真菌都提高了提取物的活性物质含量及抗氧化活性。LIU等[41]选用灰树花真菌发酵脱脂米糠水提取物,并分析了发酵产物的抗氧化活性及其对NO产生的影响,发现发酵产物对羟基和DPPH自由基的清除率比未发酵产物显著提高,发酵至第9 d时NO的产生也显著提高。通过分析HEP组活性物质含量及抗氧化活性变化得知,猴头菌与人参进行双向发酵过程中,自身存在着生长发育的周期性。希望通过本文初步探索结果,总结不同发酵时期活性物质含量及活性的动态变化规律,为日后更好的开展相关实验工作提供理论背景,为充分挖掘猴头菌-人参固体双向发酵过程中更多药效物质的变化规律及药用价值奠定基础。同时,希望通过本文的实验结果,为同属药食同源的猴头菌与人参在保健食品的开发上提供良好的数据支撑。但本文仍存在不足,对菌质中药效活性物质的作用机理及药理活性研究的并不透彻,也希望通过未来的实验研究,加强对菌质中药效物质的探索,提高猴头菌与人参的商业价值。
