蒙古黄芪多糖对注意缺陷多动障碍模型大鼠前额叶神经元的影响*
2023-01-02蔚立涛赵秉宏关明杰
李 鑫,蔚立涛,赵秉宏,高 磊,关明杰
(1.内蒙古科技大学包头医学院公共卫生学院2019级研究生,内蒙古 包头 014040;2.内蒙古科技大学包头医学院公共卫生学院2018级研究生;3.内蒙古科技大学包头医学院公共卫生学院)
注意缺陷多动障碍(attention deficit and hyperactivity disorder,ADHD)又称多动症,是学龄前、学龄期儿童常见的一种神经发育障碍性疾病,以注意力集中时间短、多动或冲动为核心特征。患儿常伴随学习成绩差、社会功能受损,并且较正常儿童易出现各种认知障碍、情绪障碍等问题。据研究报道,儿童ADHD如没有及时干预治疗,约有65 %的症状会持续到成年,对儿童自身及其家庭,以及社会产生负面影响[1]。研究发现,脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)在大脑中的含量极为丰富,且对大脑的正常发育及生理功能具有重要意义。大脑中BDNF的异常表达会导致认知功能障碍[2]。研究发现BDNF/酪氨酸激酶受体B(tyrosine kinase receptor B,TrkB)/环磷腺苷效应元件结合蛋白(cAMP-response element binding protein,CREB)通路作为BDNF调节认知功能障碍的主要途径,当BDNF/TrkB/CREB通路存在异常时,同样会引起神经元损伤及认知功能障碍[3]。此外,CREB的异常表达与认知功能障碍也具有关联性,CREB的激活可使新的突触形成增多并增加学习记忆相关性蛋白表达[4]。因此,BDNF/TrkB/CREB通路的异常与ADHD具有相关性。
蒙古黄芪作为我国传统中药材之一,具有补气升阳、益卫固表等药理作用。多糖作为蒙古黄芪主要有效成分,是蒙古黄芪发挥药理作用的重要物质之一。蒙古黄芪多糖是一种具有多靶点生物活性的大分子物质,研究表明其具有抗炎、调节血糖、免疫调节、抗氧化等作用,是目前国内外研究的热点。本课题组围绕蒙古黄芪对ADHD的防治作用及机制展开相关研究,前期研究发现蒙古黄芪多糖可减少大鼠前额叶神经元损伤,影响多巴胺通路中多巴胺的合成及清除。本研究在原有研究的基础上,探讨蒙古黄芪多糖对ADHD模型大鼠(SHR大鼠)行为的影响及BDNF/TrkB/CREB mRNA的影响,进一步明确蒙古黄芪多糖防治ADHD的作用机制。
1 材料与方法
1.1材料
1.1.1药物 蒙古黄芪多糖(简称多糖),采用水煮醇沉法提取,醇沉法(95 %乙醇)富集。具体方法参考本课题组前期蒙古黄芪多糖提取方法,通过UV检测蒙古黄芪多糖含量为98.12 %[5]。静灵口服液从辽宁东方人药业有限公司购入,哌甲酯专注达从西安杨森制药有限公司购入。
1.1.2仪器与试剂 试剂:尼氏染色液(北京索莱宝),二甲苯(天市永大化学试剂有限公司),中性树胶(北京中杉金桥生物技术有限公司),无水乙醇(天津市永大化学试剂有限公司),TRNzol总RNA提取试剂(天根生化科技有限公司),PrimeScriptTMRT reagent Kit with gDNA Eraser、SYBR®Premix Ex TaqTMⅡ、DL2000 DNA Marker(TaKaRa),ELISA试剂盒(武汉纯度生物科技有限公司)。仪器:光学显微镜(日本OLYMP-US),石蜡切片机(德国莱卡),电脑生物组织摊烤片机(浙江省金华市科迪仪器设备有限公司),涡旋振荡仪(海门市其林贝尔仪器制造有限公司),离心机(Eppendorf),分光光度计(Thermo scientific)、凝胶成像系统(上海天能科技有限公司),荧光定量PCR仪(Applied Biosystems),水迷宫实验、旷场实验由泰盟软件有限公司研制开发。
1.2方法
1.2.1动物及分组 SHR大鼠20只、Wistar大鼠5只,均为SPF级,雄性,4周龄,体质量50~70 g。实验动物均饲养在屏障动物房内,温度、湿度适宜,12 h昼夜交替,自由饮水。实验动物从北京维通利华实验动物技术有限公司购入[SCXK(京)2016-0006]。
所有大鼠适应性喂养3 d,将20只SHR大鼠采用完全随机设计的方法分为4组,分别为模型组、多糖组、哌甲酯组、静灵口服液组(静灵组),5只/组;5只Wistar大鼠为对照组。大鼠灌胃给药,共4周,灌胃量10 mL/kg。给药组分别给予多糖0.15 g/kg、哌甲酯2.0 mg/kg、静灵口服液10 mL/kg,对照组和模型组给予10 mL/kg生理盐水。
1.2.2行为学实验 在给药4周末进行,将旷场实验箱的底部分为50 cm×50 cm的九宫格,定义为外围区域、中心区域。实验正式开始前使大鼠适应周围环境。30 min后将大鼠放入中心区域,通过视频系统记录5 min内大鼠的站立次数、理毛次数、粪便次数。
水迷宫实验于给药第4周初进行,于每日上午8点进行水迷宫实验。将圆形水池人为划分为4个象限,平台位于第一象限内,每次实验时将大鼠轻柔地放入水池,记录大鼠在一定时间内找到平台的用时。记录大鼠在2 min穿越平台数、穿越象限数、游泳速度,以此分析各组大鼠的空间记忆和学习的能力。每次实验后及时将大鼠放入干燥温暖的环境,确保大鼠正常生理状态。
1.2.3尼氏染色 大鼠处死后取脑组织在冰上分离前额叶,置于4 %多聚甲醛中固定。制作石蜡切片,石蜡切片脱蜡于蒸馏水;在60 ℃预热的1 %甲苯胺蓝染色液中染色40 min;蒸馏水清洗;取70 %和80 %乙醇各浸洗2 min;95 %乙醇分化,显微镜下控制分色,直至清晰显示出尼氏小体为止,背景淡蓝色为宜;无水乙醇脱水,二甲苯透明,中性树胶封固。
1.2.4Real-time PCR检测大鼠前额叶BDNF、TrkB、CREB mRNA的表达 用TRNzol RNA提取法提取大鼠前额叶RNA,紫外分光光度法检测RNA浓度和纯度,经逆转录合成cDNA,反应条件25 ℃ 10 min,42 ℃孵育50 min,85 ℃ 10 min。Real-time PCR反应条件:预变性,95 ℃,5 min;变性,95 ℃,10 s;退火,60 ℃,40 s;延伸95 ℃,15 s;变性、退火、延伸各循环40次,建立熔解曲线,所有样本均设3个复孔。采用2-△△CT法计算目的基因的相对表达量。
1.2.5ELISA法检测血清中IP3、FosB、c-Fos水平 大鼠经腹腔注射3 %戊巴比妥钠进行麻醉。腹主动脉采血2 mL,静置2 h,3 000 r/min离心10 min,取血清,采用ELISA法检测血清IP3、FosB、c-Fos水平,操作严格参照试剂盒说明书(武汉纯度生物科技有限公司)。取试剂盒内96孔板,依次设标准孔、样品孔、空白孔,标准孔、样品孔分别加入标准品、待测样本,空白孔除外。各孔按照说明书加入酶标试剂,孵育1 h后,取洗涤液进行5次洗板,然后进行显色处理,上机测定。
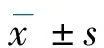
2 结果
2.1水迷宫实验结果 结果表明,各组大鼠游泳速度接近,各组间差异无统计学意义(P>0.05),表明各组大鼠游泳能力相近。模型组较对照组穿越平台数、穿越象限数减少,但差异无统计学意义(P>0.05)。多糖组、哌甲酯组、静灵组较模型组穿越平台数、穿越象限数增多,但差异无统计学意义(P>0.05)。见表1。

表1 大鼠水迷宫实验结果
2.2旷场实验结果 与对照组相比,模型组较站立次数、理毛次数增加(P<0.05);与模型组相比,多糖组、哌甲酯组、静灵组站立次数减少(P<0.05),各给药组之间站立次数差异无统计学意义(P>0.05);与模型组相比,多糖组、静灵组理毛次数减少(P<0.05);与哌甲酯组相比,多糖组理毛次数减少(P<0.05);模型组粪便粒数较其他四组增多,但差异无统计学意义(P>0.05)。见表2。

表2 大鼠旷场实验结果(n=5)
2.3尼氏染色结果 对照组神经元尼氏体较多,神经细胞结构完整,尼氏体、细胞核染色清晰,边界分明。模型组尼氏体数目减少,细胞结构受损,核膜偏倚、碎裂、不清晰。蒙古黄芪多糖组、哌甲酯组、静灵组神经元尼氏体较多,细胞结构完整,核仁清晰。见图1。

图1 大鼠前额叶尼氏染色(400×)
2.4血清IP3、FosB、c-Fos检测结果 与对照组相比,模型组IP3水平提高(P<0.05);与模型组相比,多糖组、哌甲酯组IP3水平降低(P<0.05);多糖组、静灵组IP3水平高于哌甲酯组(P<0.05);模型组较对照组FosB水平降低,多糖组、哌甲酯组、静灵组较模型组FosB水平增高,但差异无统计学意义(P>0.05);模型组c-Fos水平高于对照组(P<0.05),多糖组、哌甲酯组、静灵组c-Fos水平低于模型组(P<0.05),多糖组c-Fos水平高于哌甲酯组(P<0.05)。见表3。

表3 大鼠血清IP3、FosB、c-Fos结果
2.5大鼠前额叶BDNF、TrkB、CREB mRNA的检测结果 与对照组相比,模型组大鼠前额叶BDNF mRNA、TrkB mRNA表达水平降低(P<0.05);多糖组、静灵组BDNF mRNA表达水平较模型组提高(P<0.05),哌甲酯组与模型组相比差异无统计学意义(P>0.05),多糖组、静灵组较哌甲酯组表达升高,但差异无统计学意义(P>0.05)。模型组较对照组TrkB mRNA表达减少(P<0.05),多糖组、哌甲酯组、静灵组TrkB mRNA水平与模型组差异无统计学意义(P>0.05)。对照组、多糖组较模型组CREB mRNA水平增高,但差异无统计学意义(P>0.05);哌甲酯组、静灵组CREB mRNA较模型组增高(P<0.05),哌甲酯组、静灵组较多糖组CREB mRNA增加,但差异无统计学意义(P>0.05)。见图2。

图2 大鼠BDNF、TrkB、CREB mRNA表达量结果(n=5)
3 讨论
经过多年研究,ADHD仍无确切病因因素及发病机制,认为该病是由生物-心理-社会因素共同作用的结果。目前有研究表明,前额叶功能低下成为ADHD可能病因因素之一[6]。ADHD患儿存在自我调节、注意控制和反应抑制能力等方面的功能障碍,而前额叶在反应抑制、工作记忆、注意力及自主控制等人类的高级神经活动中发挥重要作用[7]。蒙古黄芪作为我国传统的中药材之一,有两千多年的历史,其主要成分包括黄酮、皂苷、多糖及氨基酸等多种生物活性物质,其中多糖具有免疫调节、神经保护、抗炎等药理学作用[8-9]。目前研究表明蒙古黄芪多糖可明显改善抑郁模型大鼠的海马损伤及抑郁行为,进一步表明黄芪多糖对中枢神经系统具有药理作用[10]。
细胞凋亡是由基因调控的细胞正常死亡类型,具有重要的生物学意义。神经元异常数量的凋亡会导致机体出现学习、认知、记忆等功能障碍。ADHD患儿呈现前额叶功能受损、发育缓慢以及体积异常[11]。本研究结果显示,SHR大鼠焦虑程度增加,自发活动增多,学习记忆能力减弱。而多糖组、哌甲酯组、静灵组大鼠焦虑程度降低,自发活动减少,对大鼠学习记忆能力改善作用不明显。尼氏染色结果显示模型组大鼠前额叶尼氏体数目减少,神经元细胞结构受损,核膜出现偏倚、碎裂、边界不清晰的现象。与模型组相比,蒙古黄芪多糖组、哌甲酯组、静灵口服液组尼氏体较多,细胞神经元结构完整,核仁清晰。因此,模型组大鼠表现出行为的改变可能与大鼠前额叶神经元的损伤有关,蒙古黄芪多糖、哌甲酯、静灵口服液可不同程度地减少前额叶细胞损伤,因而改善大鼠的异常行为。
FosB与c-Fos共属于Fos蛋白家族,可与Jun蛋白家族二聚化形成活化蛋白(AP-1),调控细胞的生命活动。IP3作为影响细胞凋亡作用的重要载体蛋白,是FosB、c-Fos的上游信号通路因子,当体内损伤时,其表达量增高[12]。正常生理状态下,c-Fos在中枢神经系统内表达水平较低,当细胞受到内、外因素刺激后,可激活c-Fos基因转录,影响细胞的生长、分化及细胞内信号的传递[11]。本研究显示,蒙古黄芪多糖、哌甲酯、静灵口服液可降低大鼠体内IP3,对FosB无影响,有研究发现哌甲酯可提高SHR大鼠纹状体等特定脑区的FosB的表达[13]。针对c-Fos的研究发现蒙古黄芪多糖、哌甲酯、静灵口服液均可降低其水平,但有学者研究表明哌甲酯可提高前额叶皮层、前扣带皮层的c-Fos表达[14]。本研究结果显示,哌甲酯药理作用与以往研究不同,分析可能原因是本次检测样本为血清,与脑组织样本具有一定差异,具体原因仍需探究。本研究表明蒙古黄芪多糖对IP3、c-Fos具有影响作用,具体机制还需进一步研究。
BDNF作为神经营养因子蛋白家族的一员,参与未成熟神经元的增殖、分化、成熟和存活,在记忆形成过程中发挥重要作用[15]。TrkB是BDNF的高亲和力受体,BDNF-TrkB信号可调节神经元分化、突触形成以及结构和功能的变化[16]。TrkB激活后可引起Ras或磷脂酰肌醇3激酶(PI3K)的活化,活化的Ras通过激活丝裂原活化蛋白激酶(MAPK)/细胞外调节蛋白激酶(ERK)级联反应,导致CREB磷酸化[17]。CREB是一种参与大脑发育、神经存活和神经发生的主要转录因子,可引起BDNF磷酸化,从而调节BDNF的转录并影响学习和记忆过程[18]。本研究发现,蒙古黄芪多糖、静灵口服液可提高SHR大鼠前额叶中BDNF mRNA表达,哌甲酯、静灵口服液可提高CREB表达水平,三种药物对TrkB无影响作用,提示蒙古黄芪多糖、哌甲酯、静灵口服液可通过调节BDNF mRNA、CREB mRNA的表达,从而调节SHR大鼠前额叶BDNF/TrkB/CREB信号通路。
综上所述,大鼠在水迷宫及旷场实验中的行为改变,可能与蒙古黄芪多糖增加SHR大鼠前额叶中BDNF mRNA的表达进而调节BDNF/TrkB/CREB信号通路,降低IP3、c-Fos水平,减少前额叶神经元凋亡有关,但蒙古黄芪多糖对ADHD模型大鼠的作用效果不及哌甲酯。
