miR-125b-5p 调控HK2 抑制胆囊癌细胞增殖和糖酵解
2023-01-02王保全雷喜锋
张 玮,王保全,雷喜锋,王 旭,张 梁
(渭南市中心医院普外科,陕西 渭南 714000)
胆囊癌是常见的胆道恶性肿瘤。由于早期表现为腹痛和不适等非特异性症状,患者多于晚期才被确诊,错过了最佳的治疗时间,预后较差。据报道,胆囊癌患者的5 a 生存率仅为4.1%[1]。因此,寻找胆囊癌的生物标志物对其临床诊断和治疗十分关键。miRNA 是短链非编码RNA,通过与靶基因结合,调节转录和转录后水平的基因表达,进而参与多种生物过程。例如:过表达miR-1 231 可促进胆囊癌细胞的多西紫杉醇敏感性,减轻胆囊癌的恶性进展[2]。有氧糖酵解是肿瘤的标志,与肿瘤细胞的恶性生物学行为有关[3]。研究发现,miRNA 与有氧糖酵解密切相关[4-5]。mR-153 通过靶向抑制E3F3 抑制甲状腺癌的糖酵解[6]。miR-142 可糖酵解,抑制结直肠癌的转移[7]。miR-125b-5p 被报道在包括乳腺癌[8]、食管鳞状细胞癌[9]、肝细胞癌[10]在内的多种肿瘤中表达降低。然而,关于miR-125b-5p 在胆囊癌中的研究鲜有报道。因此,本研究将探讨miR-125b-5p 调控胆囊癌细胞增殖和糖酵解的作用机制。
1 材料与方法
1.1 实验材料
1.1.1 细胞人永生化胆囊上皮细胞(Human gallbladder epithelial cells,HGBEC,货号:CL-416h)、人胆囊癌细胞系GBC-SD(货号:CL-365h)、NOZ(货号:CL-315h)、HEK-293T(货号:CL-209h)细胞购自武汉赛奥斯生物科技有限公司。
1.1.2 主要试剂DMEM 培养基(货号:MED-1001)购自武汉赛奥斯生物科技有限公司。RPMI 1640(货号:PM150110B)培养基购自武汉Pricella。NC mimic、miR-125b-5p mimic 和miR-125b-5p mimic+pcDNA-NC 和miR-125b-5p mimic+pcDNAHK2 引物序列是由广州锐博生物科技有限公司合成。兔抗HK2、LDHA、PDK1、GAPDH 抗体以及山羊抗兔二抗购自Abcam。葡萄糖检测试剂盒(货号:ml095040)、乳酸含量试剂盒(货号:ml077360)、ATP 含量试剂盒(货号:ml092826)购自上海Mlbio。BCA 蛋白浓度测定试剂盒(货号:PC0020)、CCK-8 试剂盒(货号:CA1210)购自北京Solarbio。TRIzol 试剂(货号:R0016)和RIPA试剂(货号:P0013C)购自上海Beyotime。双荧光素酶试剂盒购自美国普洛麦格。
1.2 实验方法
1.2.1 细胞培养HGBEC 细胞培养在完全培养基中,GBC-SD 细胞培养在含10%胎牛血清、1%双抗的RMPI 1 640,NOZ 细胞接种在DMEM 培养基(10%胎牛血清和1%双抗)中。HEK-293T 细胞培养在含10%胎牛血清、1% L-谷氨酰胺、1%NEAA 和1%双抗的DMEM 培养基中。将培养基置于37 ℃、5% CO2的细胞培养箱中。
1.2.2 细胞转染取对数生长期的GBC-SD 细胞,根据Lipofectamine 2000 试剂盒说明书,分别将NC mimic、miR-125b-5p mimic 和miR-125b-5p mimic+pcDNA-NC 和miR-125b-5p mimic+pcDNAHK2 转染至GBC-SD 细胞中。转染48 h 后,通过实时荧光定量聚合酶链式反应(real time quantitative polymerase chain reaction,RT-qPCR)和Western blot 检测转染效率。
1.2.3 RT-qPCRTRIzol 试剂用于提取细胞中的总RNA,通过逆转录试剂盒合成cDNA,SYBR™Green PCR Master Mix 用于qPCR 测定。反应条件为:95 ℃ 15 s,95 ℃ 5 s,60 ℃ 30 s,共进行40个循环。U6 作为miR-125b-5p 的内参,GAPDH作为HK2 的内参。2-ΔΔCt法计算目标基因的相对表达水平。引物序列,见表1。

表1 引物序列Tab.1 Primer sequences
1.2.4 Western blot收集各组中的细胞,通过RIPA 缓冲液裂解细胞,BCA 试剂盒测定蛋白质浓度。将蛋白样品经10%十二烷基硫酸钠-聚丙烯酰胺凝胶进行分离,随后将蛋白质转移至聚偏二氟乙烯膜上,在5%脱脂牛奶溶液中封闭1 h。使用稀释后的一抗(HK2(1∶2 000)、LDHA(1∶2 000)、PDK1(1∶2 000)、GAPDH(1∶2 500))4 ℃过夜孵育,洗涤后加入二抗(1∶5 000)在室温中孵育1 h。ECL 化学发光试剂显示蛋白条带。化学发光信号凝胶成像仪采集图像,Image J 软件分析蛋白条带灰度值。GAPDH 作为实验内参。
1.2.5 细胞计数试剂盒-8(cell counting kit-8,CCK-8)采用CCK-8 试剂盒检测蛋白质的增殖活力。收集转染后的各组细胞,以6×103个/孔的密度接种至96 孔板中,在细胞培养箱中培养适当时间(0、24、48、72 h),并在对应时间点向每孔中加入CCK-8 试剂20 µL。孵育2 h 后通过酶标仪检测450 nm 处吸光度值。
1.2.6 葡萄糖摄取、乳酸生成以及ATP 水平检测以1×105的密度将细胞接种至12 孔板中,过夜培养后弃去细胞培养基,用PBS 洗涤细胞两地。将细胞接种至37 ℃含74~148 kBq/mL18FFDG 的葡萄糖细胞培养基中培养1h,PBS 洗涤细胞2 次,并加入0.5 M NaOH 1mL 用于裂解细胞。γ 计数器用于检测裂解物中的放射性。细胞内18FFDG 摄取标准化为相应细胞数的放射性读数[11]。
通过乳酸含量试剂盒和ATP 含量试剂盒用于测定乳酸生成量和ATP 的水平。根据试剂盒说明书,收集细胞上清液用于乳酸浓度测定,下层细胞沉淀裂解后用于测量ATP 的含量。
1.2.7 双荧光素酶报告基因实验将与miR-125b-5p 具有结合序列的野生型HK2 和突变型HK2 克隆到pGL3-control 载体中。将细胞接种至24 孔板中,分别将NC mimic、miR-125b-5pmimic 和HK2-WT 或HK2-MUT 转染至HEK-293T 细胞中。转染48 h 后收集细胞,利用双荧光素酶报告基因检测试剂盒通过TD-20/20 发光计检测双荧光素酶活性,以海肾荧光素酶活性作为内参。
1.3 统计学处理
所有数据均采用GraphPad Prism 8.0 分析和作图。数据表示为“均值±标准差”()。2组间比较采用t检验,多组间比较采用单因素方差分析。所有实验均进行3 次重复。P< 0.05 表示差异有统计学意义。
2 结果
2.1 miR-125b-5p 在胆囊癌组织和细胞中表达降低
收集人胆囊上皮细胞HGBEC 和胆囊癌细胞GBC-SD、NOZ,分别提取RNA,通过RT-qPCR测定miR-125b-5p 的表达,发现miR-125b-5p在GBC-SD 和NOZ 细胞中表达低于HGBEC 细胞(P< 0.000 1),见图1A,且在GBC-SD 细胞中表达更低。进一步通过TCGA 数据库预测发现,miR-125b-5p 在胆囊癌组织中的表达低于对应的癌旁组织(P< 0.01),见图1B。因此,推断miR-125b-5p 的低表达与胆囊癌的发生密切相关,且选择GBC-SD 细胞作为实验细胞进一步研究。
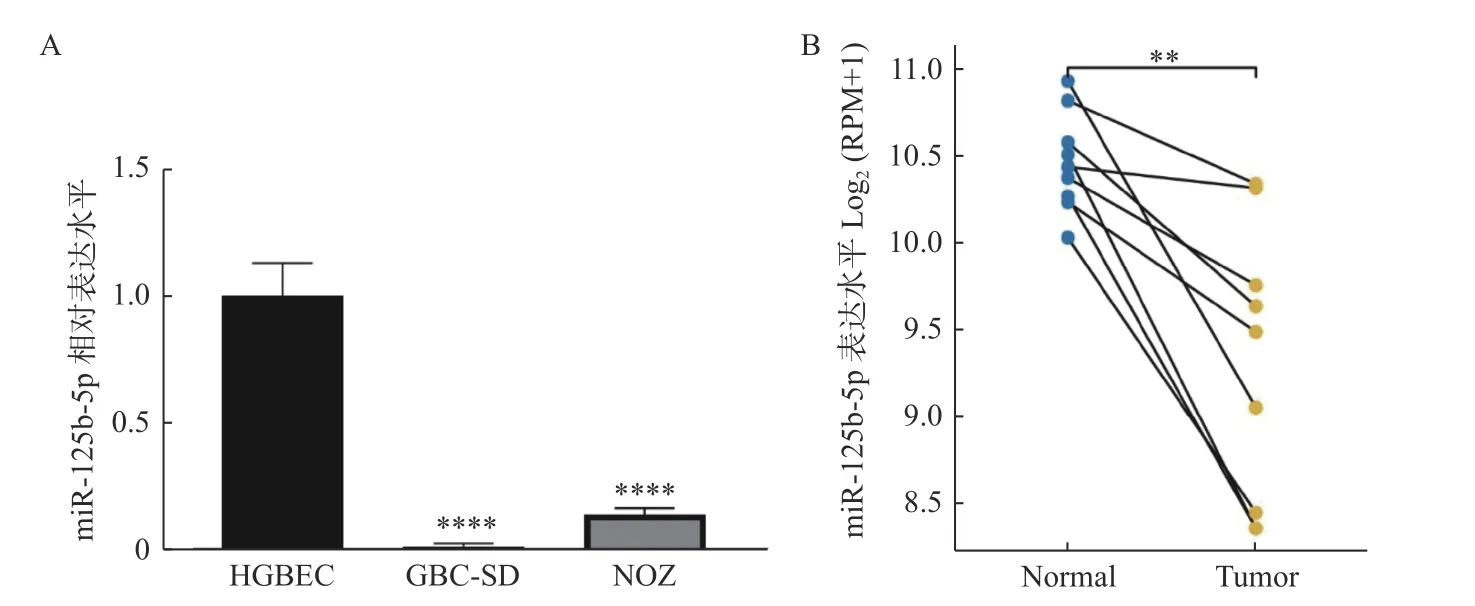
图1 miR-125b-5p 在胆囊癌细胞和组织中表达降低Fig. 1 The expression of miR-125b-5p was decreased ingallbladder carcinoma cells and tissues
2.2 过表达miR-125b-5p 抑制GBC-SD 细胞增殖和有氧糖酵解
为进一步探索miR-125b-5p 在胆囊癌中的调控作用,分别在GBC-SD 细胞中转染NC mimic和miR-125b-5p mimic,通过RT-qPCR 检测发现,NC mimic 组中miR-125b-5p 的表达与NC 组相比无统计学差异(P> 0.05),见图2A。转染miR-125b-5pmimic 组中miR-125b-5p 的表达明显高于NC mimic 组(P< 0.01)。CCK-8 显示,过表达miR-125b-5p 可明显抑制细胞的增殖活力(P<0.05),见图2B。糖酵解相关指标检测表明,过表达miR-125b-5p 组GBC-SD 细胞中乳酸生成量(P< 0.001),见图2C、葡萄糖消耗量(P< 0.05),见图2D 以及ATP 生成减少(P< 0.01),见图2E,LDHA(P< 0.01),见图2F 和G、PDK1(P< 0.001)和HK2(P< 0.000 1),见图2F 和图2G 蛋白表达降低。综上可知,过表达miR-125b-5p 显著抑制GBC-SD 细胞增殖以及有氧糖酵解。

图2 过表达miR-125b-5p 抑制GBC-SD 细胞增殖和有氧糖酵解Fig. 2 Over-expression of miR-125b-5p inhibited the proliferation and aerobic glycolysis in GBC-SD cell
2.3 miR-125b-5p 靶向负调控HK2
通过starBase 数据库预测发现HK2 与miR-125b-5p 存在靶向结合位点,见图3A,双荧光素酶实验结果表明过表达miR-125b-5p 可显著抑制HK2 野生型载体的荧光素酶活性(P< 0.01),见图3B,而对突变型HK2 载体的荧光素酶活性无明显作用(P> 0.05)。RT-qPCR 和Westernblot检测发现,HK2 mRNA(P< 0.000 1),见图3C 和蛋白(P< 0.000 1),见图3D 和图3E,水平在胆囊癌细胞系GBC-SD 和NOZ 中表达高于胆囊上皮细胞HGBEC,且过表达miR-125b-5p 显著抑制HK2 mRNA(P< 0.01),见图3F 和蛋白(P< 0.001),见图3G 和图3H 表达。由此说明miR-125b-5p靶向HK2,且负调控HK2 的表达。

图3 miR-125b-5p 靶向负调控HK2Fig. 3 miR-125b-5p targeted and negatively regulated HK2
2.4 miR-125b-5p 靶向HK2 抑制GBC-SD 细胞增殖和有氧糖酵解
进一步研究胆囊癌细胞中miR-125b-5p 对HK2 的调控机制,分别在GBC-SD 细胞中转染NC mimic、miR-125b-5p mimic、miR-125b-5p mimic+pcDNA-NC 以 及 miR-125b-5p mimic+pcDNA-HK2,RT-qPCR 检测发现,转染miR-125b-5p mimic+pcDNA-NC 组中HK2 mRNA 水平与miR-125b-5p mimic 组相比,差异无统计学意义(P> 0.05),转染miR-125b-5p mimic+pcDNAHK2 组中HK2 的表达高于miR-125b-5p mimic组(P< 0.05)。CCK-8 和糖酵解相关检指标测发现,同时过表达miR-125b-5p 和HK2 组中细胞增殖活力(P< 0.01),见图4B、乳酸生成(P< 0.01),见图4C、葡萄糖消耗(P< 0.05),见图4D、ATP生成(P< 0.05),见图4E,LDHA(P< 0.001),见图4F 和 图4G、PDK1(P< 0.001),见 图4F 和图4G,HK2(P< 0.000 1),见图4F 和图4G,蛋白表达显著高于miR-125b-5p mimic+pcDNANC 组。综上可知,过表达HK2 可逆转过表达miR-125b-5p 对细胞增殖和有氧糖酵解的抑制作用。
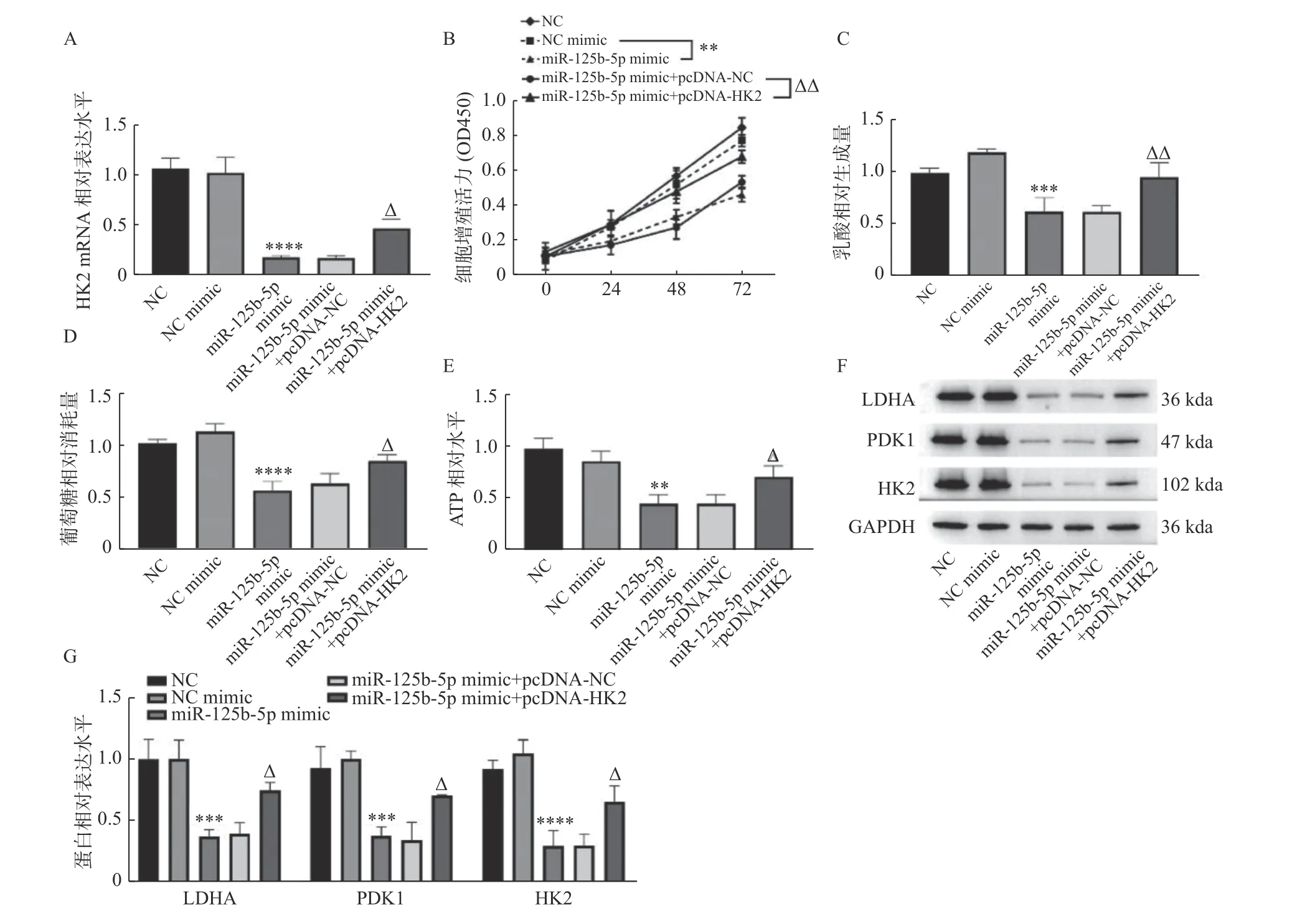
图4 miR-125b-5p 靶向HK2 抑制GBC-SD 细胞增殖和有氧糖酵解Fig. 4 miR-125b-5p inhibited theproliferationandaerobic glycolysis in GBC-SD cellby targeting HK2
3 讨论
胆囊癌是常见的胃肠道癌症,具有明显的地域差异。在高发地区,女性的发病率明显高于男性[12]。尽管诊断技术和治疗管理方面取得了很大的进步,但胆囊癌患者的预后仍然较差。研究可靠的生物标志物对胆囊癌患者的临床诊断和治疗至关重要。有氧糖酵解增强是肿瘤细胞的一个显著特征。虽然有氧糖酵解在产生ATP 方面效率低于无氧糖酵解,但它能促进增殖、抑制凋亡,产生信号代谢物,进而促进细胞在分子压力下的生存率。因此,研究胆囊癌中糖酵解的产生机制十分重要。
miRNA 在调节生长发育及其他重要的生物学功能中发挥重要作用。目前,大量miRNA 已被作为疾病的诊断生物标志物、癌症亚型的生物标志物以及治疗靶点进行研究[13]。miR-125b-5p 已被报道参与多种疾病的调控。例如:Jin 等[14]报道,敲降miR-125b-5p 可抑制RYBP 的表达,抑制胃癌细胞恶性生物学行为。骨髓间充质干细胞外泌体来源的miR-125b-5p 通过靶向抑制缺血性急性肾损伤中肾小管上皮细胞的P53 表达,从而促进肾小管修复[15]。本研究发现miR-125b-5p 在胆囊癌细胞中表达降低,过表达b 可显著抑制胆囊癌细胞GBC-SD 的增殖、乳酸生成、葡萄糖消耗、ATP 生成以及LDHA、PDK1 和HK2 蛋白表达。这与Yang 等[16]报道的结果一致,同时,证明过表达miR-125b-5p 可增加顺铂处理后的胆囊癌细胞的死亡,促进癌细胞的化疗敏感性。
己糖激酶2(hexokinase 2,HK2)是一种糖酵解酶,促进细胞中葡萄糖代谢,进而催化Warburg 效应。已经在多种癌症中观察到HK2 上调,促进肿瘤细胞的增殖、转移和耐药性[17-18]。在结直肠癌细胞中,上调HK2 可促进结直肠癌细胞的葡萄糖消耗和乳酸生成及癌细胞的耐药性[19]。在卵巢癌中,抑制HK2 表达可拮抗卵巢癌细胞的Warburg 效应,抑制卵巢癌发展进程[20]。过表达miR-9-1 显著降低HK2 蛋白水平,抑制了鼻咽癌细胞的增殖和糖酵解[21]。本研究中,发现HK2 是miR-125b-5p 的靶基因,且负调控HK2的表达。过表达HK2 可逆转过表达miR-125b-5p对胆囊癌细胞增殖和糖酵解的抑制作用。此外,HK2 也被报道在胆囊癌细胞中作为miR-143 的靶基因,与lncRNA PVT1 共同竞争和miR-143 的结合位点,促进胆囊癌细胞的增殖和转移[22]。
综上所述,胆囊癌组织和细胞中miR-125b-5p低表达,过表达miR-125b-5p 靶向抑制HK2 的表达,进而抑制人胆囊癌细胞GBC-SD 的增殖和有氧糖酵解,miR-125b-5p/HK2 分子轴的调控作用可为胆囊癌的临床诊断和治疗提供新的理论依据。
