红景天苷通过HIF-1α/NF-κB信号通路对阻塞性睡眠呼吸暂停低通气综合征大鼠炎症的调控作用
2023-01-02吴格怡黄心蔚郑美乔刘嘉慧
吴格怡 黄心蔚 郑美乔 刘嘉慧
阻塞性睡眠呼吸暂停低通气综合征(OSAHS)是一种以夜间反复间歇低氧为特征的疾病,其引起的多脏器损伤与氧化应激反应导致的炎症介质增加相关[1],研究表明,引起这一系列反应的途径为低氧诱导因子-1α(HIF-1α)/核因子-κB(NF-κB)信号通路[2]。OSAHS的慢性间歇低氧使HIF-1α/NF-κB信号通路激活,其下游炎症因子如肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)、白细胞介素-8(IL-8)增加,造成机体各种损伤[3]。红景天具有抗衰老、抗氧化应激、抑制炎症反应、增强免疫、清除氧自由基等作用。本研究旨在观察红景天苷通过HIF-1α/NF-κB信号通路对OSAHS大鼠炎症的调控作用。
1 材料与方法
1.1 试剂材料红景天苷(货号:BP1020-20mg)购自广州剪刀手基因科技有限公司,TNF-α(货号:JM-01587-R2)、IL-6(货号:JL18212-96T)、IL-8(货号:JM-04713H1-96T)、ELISA检测试剂盒均购自深圳市文乐生物科技有限公司,HIF-1α抗体(货号:YCKJ-RJ-038165)购自北京标谱检测科技有限公司,NF-κB抗体(货号:YCKJ-RJ-022161)购自广州誉嘉生物科技有限公司。
1.2 实验动物及造模购自广东省医学实验动物中心的标准雄性大鼠[许可证号 SCXK(粤)2013-0002]共56只,周龄(10±2)周,体重(230±20)g。按随机原则分为正常对照组、慢性间歇低氧组、红景天苷低剂量组、红景天苷高剂量组各9只,适应性喂养后开始造模。除正常对照组外,其余27只大鼠均放养于间歇低氧仓内,参照文献[4]中间歇低氧仓建造方法。增加仓内氮气时,仓内氧浓度下降,增加仓内氧气时,仓内氧浓度上升,间歇循环时间为8min。造模时间共8周,每天8h(9:00-17:00)。在造模的最后1周,每次入仓前,红景天苷低剂量组给予红景天苷20mg/kg,红景天苷高剂量组给予红景天苷100mg/kg腹腔注射,正常对照组、慢性间歇低氧组注射等量生理盐水,时间共7d。
1.3 取材及检测
1.3.1 取材 8周后36只大鼠均予腹腔注射10%水合氯醛麻醉,心脏采血,血液静置离心后,取上清液于-80℃冷藏以备ELISA检测。大鼠处死后剪取适量肺组织,于液氮中迅速冷却,-80℃冻存以备Western blot检测。
1.3.2 ELISA检测 取冷藏上清液,样品孔中加入待测上清液,封膜,4℃过夜后洗板。室温下加入一抗,封膜后孵育1h,再洗板3次;室温下加入二抗,封膜后孵育1h,再洗板3次。显色后终止反应,450nm波长吸光度检测TNF-α、IL-6、IL-8含量。
1.3.3 Western blot检测 取冻存肺组织,清洁后液氮下磨成粉末状,加入含PMSF的裂解液冰上裂解30min。成品移入离心管,4℃下15 000r/min离心20min,吸取上清细胞裂解液,BCA法检测蛋白浓度。沸水加热5min使蛋白变性,依次配胶,上样后电泳,PVDF膜转膜,TBST洗膜5min,用丽春红染膜,检测转膜效率。5%脱脂奶粉室温封闭1h,洗膜3次。TBST按比例稀释(HIF-1α 1:1000,NF-κB 1:1000,β-actin 1:2000)后加入一抗,摇床上4℃孵育过夜,复温后TBST洗膜3次;加入1:1000辣根过氧化物酶标记的羊抗兔 IgG二抗,摇床上4℃孵育过夜,复温后TBST洗膜3次。ECL发光液显影,定影液显色,底片曝光,扫描,分析结果。
1.4 统计学分析采用SPSS 22.0软件进行统计学分析,计量资料用均数±标准差(±s)表示,多组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠血清TNF-α、IL-6、IL-8水平比较与正常对照组比较,其余3组TNF-α、IL-6、IL-8水平均升高,差异有统计学意义(P<0.05);与慢性间歇低氧组比较,红景天苷低剂量组和红景天苷高剂量组TNF-α、IL-6、IL-8水平降低,差异有统计学意义(P<0.05);与红景天苷低剂量组比较,红景天苷高剂量组TNF-α、IL-6、IL-8水平降低,差异有统计学意义(P<0.05)。见表1。
表1 各组大鼠血清TNF-α、IL-6、IL-8水平比较(±s,n=9)
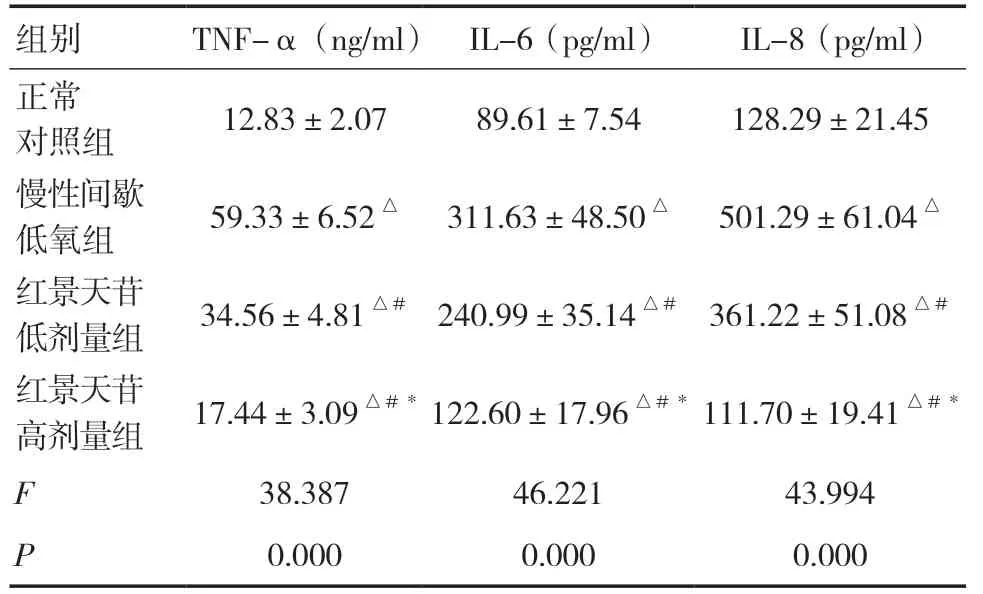
表1 各组大鼠血清TNF-α、IL-6、IL-8水平比较(±s,n=9)
注:与正常对照组相比,△P<0.05;与慢性间歇低氧组相比,#P<0.05;与红景天苷低剂量组相比,*P<0.05
2.2 各组大鼠肺组织HIF-1α和NF-κB蛋白表达比较与正常对照组相比,慢性间歇低氧组大鼠HIF-1α和NF-κB蛋白表达明显增加(P<0.05),而应用红景天苷腹腔注射后,红景天苷低剂量组和红景天苷高剂量组大鼠HIF-1α和NF-κB蛋白表达下调(P<0.05),红景天苷高剂量组下调更明显(P<0.05)。见表2、图1。
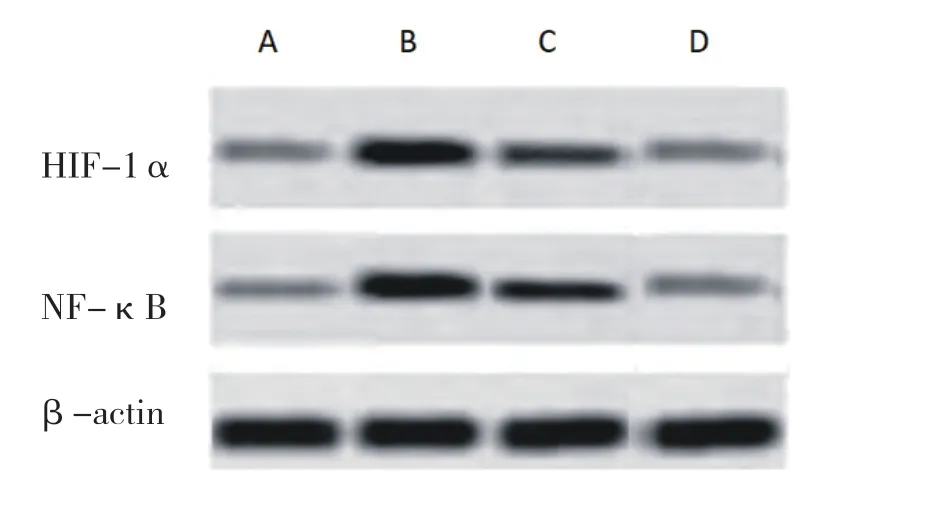
图1 各组大鼠HIF-1α和NF-κB蛋白表达比较
表2 各组大鼠HIF-1α和NF-κB蛋白表达量比较(±s)

表2 各组大鼠HIF-1α和NF-κB蛋白表达量比较(±s)
注:与正常对照组相比,△P<0.05;与慢性间歇低氧组相比,#P<0.05;与红景天苷低剂量组相比,*P<0.05
3 讨论
OSAHS是一种睡眠呼吸障碍性疾病,占睡眠呼吸疾病的70%以上[5],其因鼻咽等上呼吸道因素导致慢性间歇低氧而引起一系列问题。由于慢性间歇低氧,体内TNF-α、IL-6等炎症因子增加,而这些因子的增加也可加重上呼吸道阻塞,导致恶性循环[6]。
慢性间歇低氧大鼠体内的多种炎症因子包括TNF-α、IL-6、IL-8等均由NF-κB调控、转录。在生理状况下,NF-κB并不表达或表达很少,与其抑制因子(Inhibitor of NF-κB,IκB)结合,为无活性状态存在于胞浆中。疾病中的物理及化学因素刺激均可导致这种结合的分离,如病毒、细菌内毒素、氧化应激反应以及OSAHS的特征性改变-慢性间歇低氧。在这些变化刺激中,NF-κB与靶基因、增强子或早期炎症反应基因再结合,TNF-α、IL-6、IL-8等炎症因子大量产生。TNF-α是促炎因子,并且是机体免疫应答的重要因子,其过度应答聚集了大量中性粒细胞,继而上调IL-8的表达,IL-8可进一步趋化中性粒细胞,炎症反应更加严重[7]。
在疾病的发生发展过程中,HIF-1α/NF-κB信号通路具有重要作用。HIF-1α是HIF-1的一个亚基,受缺氧信号刺激激活NF-κB信号通路经典途径[8,9]。NF-κB是一种能与许多基因启动子κB序列结合而发挥转录功能的核因子[10]。有学者认为,OSAHS患者更多是先活化NF-κB而导致整个炎症途径的激活[11]:患者机体反复发作性缺氧导致氧化应激反应,体内的活性氧(ROS)可通过有丝分裂原激活NF-κB的磷酸化途径,使IκB蛋白降解,NF-κB解离,NF-κB活化并进入细胞核,与相应DNA序列结合,激活一系列如TNF-α、IL-6、IL-8下游炎症因子,加重炎症。HIF-1α同样可以刺激炎症因子增加,OSAHS患者脯氨酰羟化酶受到抑制,HIF-1α不能完全泛素化及羟基化[12],因此HIF-1α水平增加。而在缺氧状态下,细胞也可以通过PI3K/AKT/mTOR和Ras/MAPK等通路使HIF-1α表达增加[13,14]。同时,HIF-1α与NF-κB相互影响导致OSASH炎症的发生发展,内皮素-1(ET-1)可通过 HIF-1α激活 NF-κB途径参与 OSAHS相关血管重构[15];而NF-κB也可以反过来激活病灶部位的HIF-1α,HIF-1α通过诱导糖酵解酶导致内皮细胞(EC)过度增殖,促进这些部位的动脉粥样硬化和炎症[16]。
红景天苷是从中药红景天中提取的主要成分,具有抗衰老、抗缺氧、抗氧化应激、保护心肺组织等多种作用[17]。本研究显示,经红景天苷腹腔注射的大鼠NF-κB、HIF-1α蛋白表达均下降,且与红景天苷的剂量有关。红景天苷可作用于OSAHS患者的NF-κB及P38信号通路,达到抗炎效果[18],亦可使脯氨酰羟化酶活化而减少HIF-1α的产生[19]。完整的NF-κB信号通路有赖于HIF-1α的表达及调节水平[20]。根据本研究结果推测,红景天苷抑制HIF-1α的产生,并进一步抑制NF-κB的表达,从而下调TNF-α、IL-6、IL-8炎症因子的表达。
综上所述,HIF-1α及NF-κB在炎症过程中相互影响,红景天苷抑制其表达从而减少其下游炎症因子产生,达到保护OSAHS患者机体作用。而此过程中,HIF-1α/NF-κB信号通路作用机制及更多的靶因子仍有待进一步深入研究。
