哮喘患儿NR3C1及GLCCI1基因多态性的临床预测价值*
2023-01-02杨艳卢慧娜陈霞冯静贺颖张琼琼王舰辉
杨艳,卢慧娜,陈霞△,冯静,贺颖,张琼琼,王舰辉
(1.中国人民解放军陆军第九五八医院儿科,重庆 400020;2.重庆市中医院儿科,重庆 400021)
当前,儿童哮喘的发病率逐年上升,虽然许多药物[如吸入性糖皮质激素(ICS)]临床被批准用于治疗哮喘,但仍缺乏针对性。哮喘患者对ICS的反应存在个体差异,因为ICS应答约70%的变异由目标基因的遗传特征决定。近年来全基因组关联研究中发现的基因(如GLCCI1、FBXL7、T、ALLC、CMTR1)可能在哮喘诊断/治疗反应通路中发挥直接或间接作用。有研究提示,皮质激素诱导转录物1(GLCCI1)通过IL-13/periostin/TGF-β1信号通路调节哮喘气道重塑[1],糖皮质激素受体基因(NR3C1)的遗传变异与哮喘患者对ICS的反应密切相关[2]。为此,本研究中以重庆市两家医院儿科收治的哮喘患儿为研究对象,分析了NR3C1及GLCCI1基因多态性与ICS对患儿疗效的相关性,为临床医师制订个体化治疗方案提供参考。现报道如下。
1 资料与方法
1.1 一般资料
纳入标准:符合2016年中华医学会儿科学分会呼吸学组《儿童支气管哮喘诊断与防治指南》中诊断标准;临床资料完整。本研究经医院医学伦理委员会批准,患儿家属签署知情同意书。
排除标准:近1周内有呼吸道感染病史;自身免疫疾病、遗传代谢性疾病;合并慢性肾功能衰竭等慢性疾病;精神发育迟滞,无法配合本研究。
病例选择与分组:选取陆军第九五八医院和重庆市中医院儿科2020年12月至2022年1月收治的哮喘患儿40例,作为观察组;另选择此两家医院同期未诊断哮喘患儿43例,作为对照组。
1.2 方法
观察组患儿单次雾化吸入布地奈德混悬液(四川普锐特药业有限公司,国药准字H20213286,规格为每支2 mL∶1 mg)0.5~1 mg 4 h后,检测第1秒用力呼气容积(FEV1);然后予丙酸氟替卡松吸入气雾剂(Glaxo Wellcome S.A.,进口药品注册证号H20130189,规格为每揿50μg或125μg)经口吸入,每次1揿,每日2次,持续治疗3个月后,检测肺功能。对照组在相同时间点检测FEV1。
1.3 多重聚合酶链式反应(PCR)高通量测序(NGS)验证检测
于治疗前抽取患儿外周静脉血2 mL,抗凝、离心、分离后提取基因组DNA,置-80℃冻存。GLCCI1基因rs37973位点上游引物:5-'TCCCTACACGACGCTCTTCCGATCTACCACGAGCAGACCAATTTGA-3',下游引物:5'-AGTTCAGACGTGTGCTCTTCCGATCTAAATTTACCCCACAGTAAAG-3';NR3C1基因rs42423247位点上游引物:5-'TCCCTACACGACGCTCTTCCGATCTACTTGCAGGAACATTTGAACG-3',下游引物:5'-AGTTCAGACGTGTGCTCTTCCGATCTCAGTGAACAGTGTACCAGAC-3'。
PCR反应体系为20μL,内含Ready Reaction Premix 1μL,BigDye sequencing Buffer 3.5μL,引物终浓度为0.1μmol/L,PCR产物20 ng,超纯水定容至20μL。反应条件为:96℃变性1 min,96℃10 s、50℃5 s、60℃4 min,循环25次。PCR产物经纯化后,用基因测序仪测序。
1.4 观察指标
观察患儿的临床指标;基因型、等位基因的分布;不同基因型患儿治疗前后肺功能的改变情况。
1.5 统计学处理
采用SPSS 14.0统计学软件分析。计量资料以±s表示,行t检验;计数资料以率(%)表示,行χ2检验。P<0.05为差异有统计学意义。
2 结果
两组患儿临床指标见表1;不同位点基因型分布无显著差异(P>0.05),见表2;吸入ICS 3个月后各基因型的肺功能比较见表3(MMEF75/25为最大呼气中期流量,FVC为用力肺活量,FEF75为75%FVC水平的呼气流量)。观察组吸入ICS 4 h后FEV1明显改善(改善率>15%)患儿基因型分布见表4。
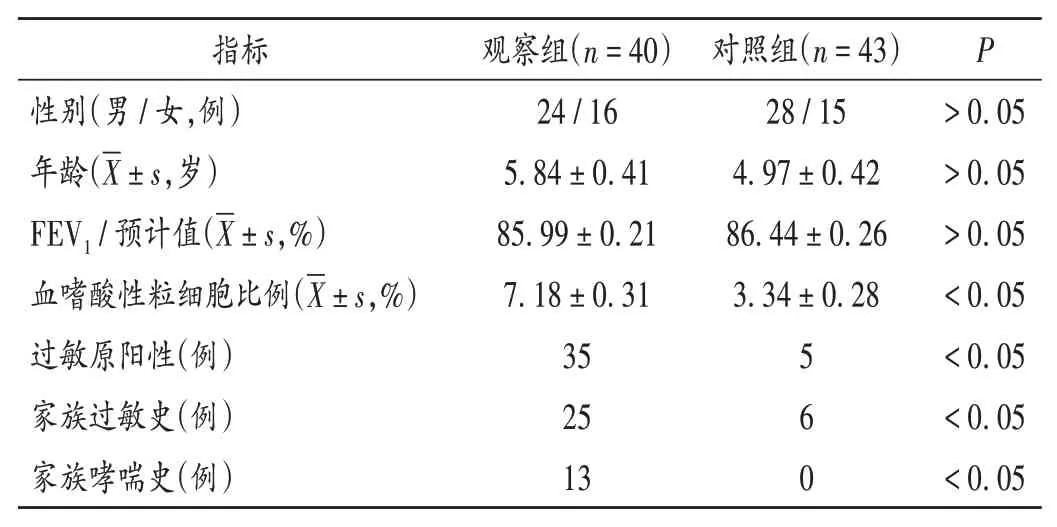
表1 两组患儿临床指标比较Tab.1 Comparison of clinical characteristics between the two groups
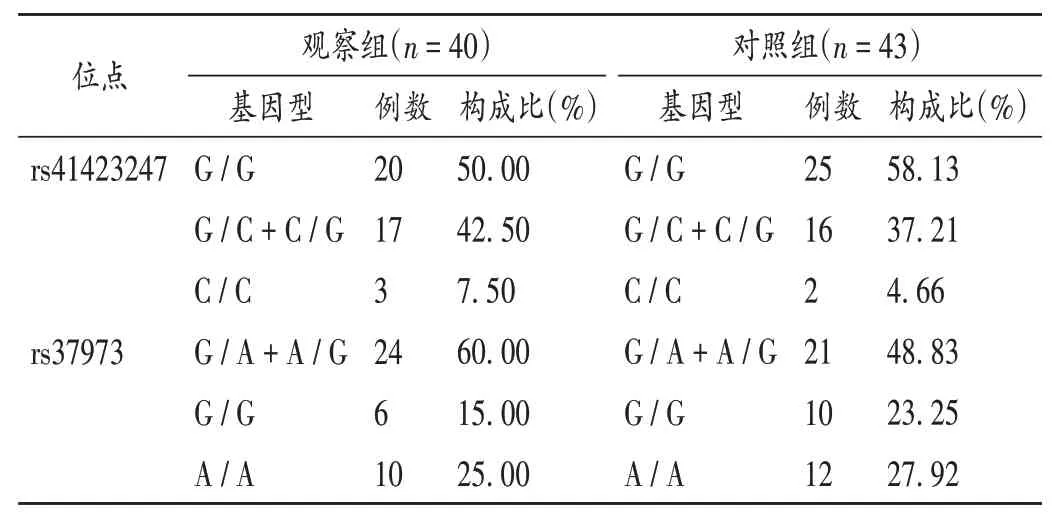
表2 两组患儿不同位点基因型分布Tab.2 Distribution of different loci genotypes in the two groups
表3 观察组各基因型患儿肺功能比较(±s)Tab.3 Comparison of pulmonary function of children with different genotypes in the observation group(±s)

表3 观察组各基因型患儿肺功能比较(±s)Tab.3 Comparison of pulmonary function of children with different genotypes in the observation group(±s)
注:与同位点同基因型治疗前比较,*P<0.01;与同位点C/C基因型比较,#P<0.05,##P<0.01。Note:Compared with the same locus genotype before treatment,*P<0.01;Compared with C/C genotype at the same locus,#P<0.05,##P<0.01.
位点rs41423247 rs37973基因型G/G G/C+C/G C/C G/G G/A+A/G A/A FEV1/预计值%治疗前68.77±4.53 66.98±5.09 76.33±3.65 64.42±3.94 68.91±4.53 70.76±9.97治疗3个月后93.11±3.25*93.11±3.15*80.94±3.46 91.47±2.47*93.44±3.90*93.44±6.30*MMEF75/25/预计值%治疗前74.38±3.40 74.12±4.22 75.84±1.77 72.26±3.95 74.78±3.90 73.77±2.32治疗3个月后96.72±3.90*95.74±3.65*78.21±1.67 94.06±3.49*96.66±5.00*94.14±7.99*FEV1/FVC变化(%)15.11±4.96##16.74±5.46#1.51±1.20 17.92±16.92 15.19±4.78 11.17±5.66 FEF75变化(%)19.18±6.39##16.98±6.15#1.84±1.34 11.98±5.26 19.66±5.78 17.29±9.11
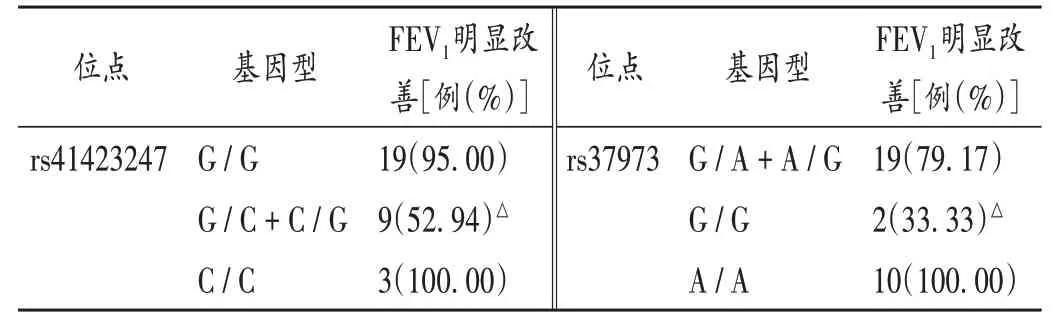
表4 观察组吸入ICS 4 h后FEV1明显改善患儿的基因型分布Tab.4 Distribution of genotypes in children with significantly improved FEV1 at 4 h after ICS inhalation in the observation group
3 讨论
ICS是控制和管理哮喘的一线药物,可提高哮喘患儿的FEV1,增加无症状天数,降低住院率及加重次数。但临床发现哮喘患者对ICS反应具有高度个体可重复性和个体差异性,且患者对ICS抵抗或不敏感是影响哮喘疗效的关键因素。哮喘患儿对ICS治疗反应的差异性不仅与气道炎症的类型有关,更基于药物基因组学的个体化差异,然而对哮喘药物遗传变异的分析仍存在较多难题。多种因素(如环境作用)和复杂的遗传背景(包括易感表型异质性)等使哮喘药物基因学研究复杂化。不同地区、不同种族等的单核苷酸多态性位点(SNP)各基因型对药物的敏感性均不同,这导致研究报道结果不一致,药物基因组学研究也将成为个体化精准用药的重要参考依据[3]。本研究中立足于重庆市两家医院收治的哮喘患儿,探讨与ICS作用机制密切相关的GLCCI1和NR3C1基因多态性对哮喘易感性及ICS疗效的预测作用。
国内外学者对多个影响哮喘患儿ICS反应SNPs的研究,已证实GLCCI1是主要候选基因。GLCCI1编码一种功能未知的蛋白,可表达糖皮质激素诱导蛋白水平并可能成为激素导致细胞凋亡的早期标记物。目前认为,GLCCI1基因位于第7号染色体短臂2区1带,内有8个外显子。既往对于rs37973位点的研究,初步确定G等位基因与治疗反应较差有关[4-5]。rs37973位点编码一种功能未知的蛋白质,导致哮喘患者对ICS治疗的反应降低。该SNP与rs37973 SNP在同一基因上存在完全连锁不平衡,从而影响GLCCI1基因的表达[1]。然而,另一项研究并未证实GLCCI1基因rs37973位点能预测对ICS治疗的反应[6]。TANTISIRA等[7]的研究表明,非西班牙裔白种rs37973纯合子GG基因型哮喘患者应用糖皮质激素治疗后FEV1的改善率仅为野生型的1/3[7],而RIJAVEC等[8]对208例成年哮喘患者研究发现,经过3个月ICS治疗后,GG基因型患者FEV1占预计值百分比明显高于AA+AG基因型患者,且这种基因依赖型的不同主要存在于非吸烟和过敏患者。因此认为,吸烟及过敏影响药物基因检测结果,而GG基因型患者可获得更好的ICS疗效。另外发现,GLCCI1基因变异可加速ICS治疗后肺功能改善,同样情况也发现在汉族人群[9-10]。HOSKING等[5]证实,GLCCI1基因rs37973位点不能作为白种哮喘患者ICS疗效预测的指标。郝珉等[11]研究发现,GLCCI1基因另一个SNP rs37972位点TT型患儿经12周的ICS治疗,FEV1和FEV1/FCV较治疗前无明显改善,说明该位点该基因型对ICS的疗效差。本研究中发现,两组GLCCI1基因rs37973位点3种基因型(GG,GA,AA)患儿发病率无明显差异。观察组经ICS治疗4 h后G/G基因型疗 效 较G/A+A/G及A/A基因型差,而3个月后该组3种基因型比较无明显差异。提示GLCCI1基因rs37973位点可能与儿童哮喘无明显相关性,且ICS长期治疗反应与该位点基因型(GG,GA,AA)相关性不明显。
糖皮质激素受体(GR)编码的基因NR3C1,位于5q31-32,包含8个内含子和9个外显子,编码800个氨基酸。GR是调节下丘脑-垂体-肾上腺轴(HPA)的关键作用点,而HPA轴亢进与NR3C1表达下调有关。NR3C1位于染色体,包含一簇细胞因子和其他免疫相关基因,包括白细胞介素(IL)-4、IL-5、IL-9、IL-13、粒细胞巨噬细胞集落刺激因子(GM-CSF)、CD14、白三烯C4合酶(LTC4S)等。有研究表明,rs41423247为哮喘等炎性疾病的易感位点。KESKIN等[12]证实,携带rs41423247纯合子G等位基因中重度哮喘患儿吸入高剂量ICS后FEV1可显著改善。另有研究表明,rs41423247位点C等位基因与保护HPA有关,CC基因型与促肾上腺皮质激素最高反应相关[2,13]。本研究中发现,rs41423247位点与哮喘易感性无明显相关,但观察组rs41423247 SNP G/C+C/G基因型患儿吸入ICS 4 h后FEV1改善≥15%比例较G/G及C/C基因型患儿明显降低。吸入ICS 3个月后rs41423247位点G/G及G/C+C/G基因型FEV1占预计值百分比、MMEF75/25占预计值百分比较治疗前明显改善,而等位基因C/C患儿吸入ICS 3个月后肺功能改善不显著。rs41423247 SNP G/G及G/C+C/G基因型患儿FEV1/FVC变化率、FEF75变化率与C/C基因型比较有显著差异(P<0.05)。提示rs41423247 SNP G/C+C/G基因型吸入ICS短期疗效较差,而C/C基因型对ICS长期治疗不敏感。本研究中还测定了对照组各基因型吸入ICS 4 h后肺功能变化情况,因FEV1改善≥15%病例数较少而未进一步统计。
综上所述,GLCCI1基因rs37973位点并非儿童哮喘易感因素,SNP G/G基因型患儿吸入ICS 4 h后FEV1改善≥15%比例较G/A+A/G、A/A基因型明显下降,而长期ICS治疗反应与基因型无明显相关性。NR3C1基因rs41423247位点与哮喘易感性无明显相关性,但G/C+C/G基因型患儿吸入ICS 4 h后FEV1改善≥15%比例较G/G及C/C基因型明显降低,而C/C基因型吸入ICS 3个月后FEV1/FVC变化率、FEF75变化率较G/G及G/C+C/G基因型显著降低。但本研究样本量较小,以后研究中将扩大样本量,且ICS的长短期疗效差异是否与基因型或环境因素(如抽烟、大气污染等)相关,也需进一步论证。
