盐酸拉贝洛尔片仿制制剂与参比制剂溶出曲线相似性研究*
2023-01-02郝丽娟徐艳梅苗会娟王春霞高燕霞
郝丽娟,徐艳梅,苗会娟,王春霞,高燕霞
(河北省药品医疗器械检验研究院·仿制药质量控制与评价重点实验室,河北 石家庄 050227)
盐酸拉贝洛尔收录于2018年版《国家基本药物目录》,用于治疗高血压和心绞痛,同时具有α1受体和β受体拮抗作用,因其不进入母胎循环,广泛用于治疗妊娠期高血压[1-2],与其他药物联用可取得较好妊娠效果[3-5],因此对其安全性和有效性均有更严格的要求。国家药品监督管理局(NMPA)网站显示,我国有8家企业具备生产盐酸拉贝洛尔片仿制制剂的资格,但均未开展该药的一致性评价工作,不符合“十三五”规划要求,亟须改进。本研究中以NMPA发布的仿制药参比制剂目录(第十批)为依据,按《普通口服固体制剂溶出度试验技术指导原则》[6],采用高效液相色谱(HPLC)法测定盐酸拉贝洛尔片仿制制剂和参比制剂(Aspen Japan K.K.公司)在4种溶出介质(水、pH1.2盐酸溶液、pH4.0醋酸盐缓冲液和pH6.8磷酸盐缓冲液)中的溶出度,采用相似性因子(f2)法[7-9]评价仿制制剂与参比制剂溶出曲线的相似性,为盐酸拉贝洛尔片仿制制剂的质量一致性评价工作提供参考。现报道如下。
1 仪器与试药
1.1 仪器
LC-20AT型高效液相色谱仪(日本Shimadzu公司);EDT-14Lx型智能溶出试验仪(上海仪真分析仪器有限公司);Logan UDT-814型智能溶出度试验仪(美国Logan公司);XS105型电子分析天平(梅特勒-托利多国际贸易<上海>有限公司,感量为0.01 mg);PB-20型酸度计(德国Sartorius公司)。
1.2 试药
盐酸拉贝洛尔对照品(美国TLC公司,批号为1744-096A1,含量99.8%);盐酸拉贝洛尔片(参比制剂,A厂,批号为2W4J,规格为每片50 mg);盐酸拉贝洛尔片(仿制 制 剂,B厂,批 号 分 别 为08181102,20170304,08180502;C厂,批号分别为180901,180201,180601;规格均为每片50 mg);乙腈为色谱纯,其余试剂均为分析纯;水为超纯水。
2 方法与结果
2.1 色谱条件
色谱柱:Agilent Eclipse XDB-C18柱(250 mm×4.6 mm,5μm);流动相:乙腈-0.1%磷酸溶液(25∶75,V/V);流速:1.0 mL/min;检测波长:230 nm;柱温:40℃;进样量:20μL。
2.2 溶出条件
依据日本橙皮书[10]、《普通口服固体制剂溶出曲线测定与比较指导原则》[11]、原国家食品药品监督管理总局药品审评中心药品体外溶出试验信息库[12],以桨法测定溶出度,条件为,转速50 r/min,溶出介质900 mL,温度(37±0.5)℃;选择的4种溶出介质分别为pH 1.2盐酸溶液(精密量取盐酸7.65 mL,加水稀释至1 000 mL混匀制成)、水、pH 4.0醋酸盐缓冲液(精密称定醋酸钠1.22 g,加2 mol/L醋酸溶液20.5 mL,加水溶解并定容至1 000 mL,摇匀制成)、pH 6.8磷酸盐缓冲液(精密量取0.2 mol/L磷酸二氢钾试液250 mL,置1 000 mL容量瓶中,再加入118 mL的0.2 mol/L氢氧化钠溶液,用水定容至1 000 mL制成);选择的取样时间分别为5,10,15,30,45,60,90,120 min。
2.3 溶液制备
对照品溶液:取盐酸拉贝洛尔对照品适量,精密称定,分别加4种溶出介质溶解并稀释制成质量浓度为1 mg/mL的对照品贮备液;再分别以4种溶出介质稀释成每1 mL中约含50μg的溶液,即得。
供试品溶液:取盐酸拉贝洛尔片仿制制剂和参比制剂样品各1片,分别平行12片,再分别以pH 1.2盐酸溶液、水、pH 4.0醋酸盐缓冲液、pH 6.8磷酸盐缓冲液为溶出介质,按2.2项下溶出条件进行溶出度试验。分别于2.2项下各时间点,取样10 mL(每次取样后均向溶出杯中补加相同体积相同温度的溶出介质),滤过,取续滤液作为供试品溶液。
空白对照溶液:以4种溶出介质为空白对照溶液。
2.4 方法学考察
系统适用性试验:取2.3项下对照品溶液、供试品溶液和空白对照溶液各适量,按2.1项下色谱条件进样测定,记录色谱图。结果盐酸拉贝洛尔色谱峰形较好,供试品溶液在与对照品溶液色谱相同保留时间处有相应色谱峰,且空白对照无干扰。详见图1。
图1 高效液相色谱图1.Labetalol hydrochloridea.Blank control solution b.Reference solution c.Test solutionA.Water B.pH 1.2 hydrochloric acid solution C.pH 4.0 acetate buffer solution D.pH 6.8 phosphate buffer solutionFig.1 HPLC chromatograms
线性关系考察:精密量取2.3项下对照品贮备液0.1,0.2,0.5,1.0,5.0,10.0 mL,分别置10 mL容量瓶中,再分别以4种溶出介质定容,取适量,按2.1项下色谱条件进样测定,记录峰面积。以峰面积(Y)为纵坐标、盐酸拉贝洛尔溶出量(X,μg/mL)为横坐标进行线性回归。结果在4种溶出介质中,盐酸拉贝洛尔溶出量均在10.11~1 011.00μg/mL范围内与峰面积线性关系良好。详见表1。

表1 不同溶出介质线性关系考察结果(n=6)Tab.1 Results of linear relation test of different dissolution media(n=6)
精密度试验:取盐酸拉贝洛尔参比制剂(批号为2W4J)粉末适量,精密称定,按2.3项下方法制备供试品溶液,按2.1项下色谱条件连续进样测定6次及连续10 d进样测定,记录峰面积,测定日内精密度和日间精密度。结果盐酸拉贝洛尔在pH 1.2盐酸溶液、水、pH 4.0醋酸盐缓冲液、pH6.8磷酸盐缓冲液中日内精密度结果的RSD分别为0.67%,0.41%,0.59%,0.48%(n=6),日间精密度结果的RSD分别为0.74%,0.53%,0.69%,0.71%(n=10),表明方法精密度良好。
稳定性试验:取盐酸拉贝洛尔参比制剂(批号为2W4J)粉末适量,精密称定,按2.3项下方法制备供试品溶液,分别于室温下放置0,1,2,4,6,8,12 h时,按2.1项下色谱条件进样测定,记录峰面积。结果盐酸拉贝洛尔在pH 1.2盐酸溶液、水、pH 4.0醋酸盐缓冲液、pH 6.8磷酸盐缓冲液中结果的RSD分别为0.53%,1.12%,0.70%,1.20%(n=7),表明供试品溶液室温放置12 h内基本稳定。
重复性试验:取盐酸拉贝洛尔参比制剂(批号为2W4J)粉末适量,精密称定,按2.3项下方法制备供试品溶液,平行6份,再按2.1项下色谱条件进样测定,记录峰面积。结果盐酸拉贝洛尔在pH 1.2盐酸溶液、水、pH 4.0醋酸盐缓冲液、pH 6.8磷酸盐缓冲液的平均含量分别为84.8%,98.1%,91.2%,75.4%,RSD分别为0.95%,0.67%,0.76%,0.86%(n=6),表明方法重复性良好。
2.5 耐用性试验
取2.3项下对照品溶液、供试品溶液和空白对照溶液各适量,按2.1项下色谱条件进样测定,记录峰面积。分别考察不同的流速、流动相中乙腈比例、柱温、色谱柱及液相色谱仪等因素对结果的影响。结果供试品溶液中盐酸拉贝洛尔的峰面积基本一致,表明色谱条件发生一定程度变化时本方法仍可满足试验要求,耐用性良好。
2.6 溶出度测定
分别取参比制剂和B厂、C厂仿制制剂(分别记为仿制试剂1,2)各1片,分别平行12片,按2.2项下溶出条件测定各取样时间点的累积溶出度,以溶出时间为横坐标、以各时间点12片样品累积溶出度的平均值为纵坐标绘制溶出曲线。详见图2。
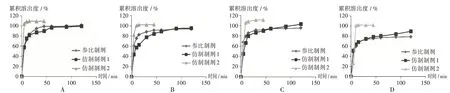
图2 盐酸拉贝洛尔片仿制制剂与参比制剂在不同溶出介质中的溶出曲线(n=12)A.Water B.pH 1.2 hydrochloric acid solution C.pH 4.0 acetate buffer solution D.pH 6.8 phosphate buffer solutionFig.2 Dissolution profiles of imitative and reference preparations of Labetalol Hydrochloride Tablets in different dissolution media(n=12)
采用f2法评价仿制制剂与参比制剂体外溶出曲线的差异。当f2值为50~100时,认为两条溶出曲线相似。在4种溶出介质中,分别以时间点5,15,45 min时的累积溶出度计算f2,结果见表2。可见,B厂样品以pH 1.2盐酸溶液和pH 6.8磷酸盐缓冲液为溶出介质时,所得溶出曲线与参比制剂具有相似性;C厂样品的4种溶出曲线与参比制剂均无相似性。

表2 仿制制剂与参比制剂溶出曲线相似性结果(n=12)Tab.2 Results of the f2 of the imitative preparation and reference preparation(n=12)
3 讨论
3.1 溶出方法及其优化
溶出度的测定,法定标准选择篮法,100 r/min[13],但美国药典41版和日本药局方第17版均采用桨法,50 r/min。篮法较适用于胶囊剂,依照原国家食品药品监督管理总局要求[11],对于小剂量片剂,采用桨法较为适宜,且50 r/min的溶出强度与人体内胃肠道蠕动强度更接近。因此,本研究中照此选择。
3.2 溶出仪选择
取B厂参比试剂,采用不同品牌溶出仪[仪真EDT-14Lx型智能溶出试验仪(上海仪真分析仪器有限公司)和UDT-814型智能溶出度试验仪(美国Logan公司)]进行试验,结果两者测定结果基本一致,溶出曲线基本相似。本研究中选择前者。
3.3 溶出介质选择
盐酸拉贝洛尔的解离常数为7.57(>3.0),视为碱性药物[7],选择溶出介质时应选择pH分别为1.0或1.2,3.0~5.0,6.8的溶液及水。NMPA推荐的盐酸拉贝洛尔参比制剂为日本Aspen公司产品,且日本橙皮书中盐酸拉贝洛尔片溶出曲线测定选择的溶出介质分别为pH 1.2,4.0,6.8的溶液及水。故本研究在此基础上,结合文献[11],选定文中所用4种溶出介质。
3.4 小结
盐酸拉贝洛尔片为我院2019年国家评价抽验品种,目前国内具有盐酸拉贝洛尔片批准文号的8个厂家均未开展一致性评价工作。本研究中参照相关文献[14-17],建立了测定盐酸拉贝洛尔片溶出度的方法,测定了仿制药在4种不同pH溶出介质中的溶出曲线。从溶出曲线和f2结果可得,在特定溶出介质中,B厂和C厂的仿制制剂溶出过快或过缓,与参比制剂不具有相似性,结合调研分析,可能是生产中崩解剂的种类和用量不同所致,提示生产企业在配方和工艺方面应予以改进。综上所述,该方法适用于盐酸拉贝洛尔片仿制制剂溶出度的测定,灵敏度高、准确度好,可为仿制制剂质量一致性评价提供参考。
