卡培他滨联合奥沙利铂动脉灌注介入治疗 晚期结肠癌并肝转移的疗效观察
2022-12-31斌巴秦元贵吕红艳
斌巴 秦元贵 吕红艳
结肠癌为临床位居前三位的消化系统恶性肿瘤,且近年我国结肠癌发病率呈现明显升高趋势[1]。鉴于结肠癌早期无明显不适,多数患者发现时即已处于中晚期,进而显著加大治疗难度,导致预后不良发生。结肠癌患者常见的转移方式包括经淋巴、血行和种植方式[2]。当前针对中晚期结肠癌患者治疗多以药物化疗为主,以达到控制患者病情、延长其生存时间,改善生活质量的目的[3]。目前临床应用的化疗药物多种多样,可供选择性较多,而选择何种药物以及给药方式对提高药物化疗效果十分重要[4]。研究提示[5],经肝动脉灌注化疗药物介入治疗能有效的提高局部药物水平,针对肝转移病灶具有显著价值。卡培他滨是目前可口服给药的一种新型抗瘤药物,口服后有效产物为氟尿嘧啶,具有明显的抗代谢氟嘧啶脱氧核苷酸作用,可抑制结肠癌肝转移病灶肿瘤细胞的分裂,干扰核糖核酸与蛋白质的合成,多用于紫杉醇耐药的晚期消化系统肿瘤以及晚期转移性乳腺癌的补救治疗[6]。本研究则主要探讨卡培他滨联合动脉灌注奥沙利铂化疗治疗晚期结肠癌并肝转移的临床疗效,现报告如下。
1 资料与方法
1.1 一般资料 选择2020 年10 月~2021 年6 月本院收治的晚期结肠癌并肝转移患者40 例为研究对象。入组患者均通过既往结肠及肝脏病理组织活检明确结肠癌并肝转移。按照随机数字表法分为对照组及观察组,各20 例。观察组:男16 例,女4 例;年龄38~ 64 岁,平均年龄(51.3±5.7)岁;结肠癌并肝转移病程1~4 个月,平均结肠癌并肝转移病程(2.5±0.8)个月。对照组:男15 例,女5 例;年龄39~65 岁,平均年龄(51.0±6.0)岁;结肠癌并肝转移病程1~4 个月,平均结肠癌并肝转移病程(2.4±0.8)个月。两组患者的一般资料比较,差异无统计学意义(P>0.05),具有可比性。
1.2 纳入及排除标准
1.2.1 纳入标准 签字同意接受经动脉介入奥沙利铂灌注治疗;定期接受门诊或电话随访;入组前均签署本研究相关知情同意书并申报医院伦理委员会批准;年龄38~65 岁;预计生存时间>1 个月。
1.2.2 排除标准 恶病质者;精神状况异常、确诊其他部位恶性肿瘤、生命体征不平稳者;对拟定药物过敏者;语言和(或)听力障碍者。
1.3 方法 两组患者均实施奥沙利铂动脉灌注介入治疗。奥沙利铂[齐鲁制药(海南)有限公司,国药准字H20203216]130 mg/m2,溶于50 ml 的5%葡萄糖溶液内,于介入引导下经肝动脉精确灌注,每21 天重复给药1 次,为1 个疗程。对照组于介入治疗1 周后给予氟尿嘧啶(上海旭东海普药业有限公司,国药准字H31020593)300 mg/m2,联用5 d,每次给药时间持续 24 h,缓慢静脉滴注,每21 天重复给药1 次,为1 个疗程。观察组于介入治疗后口服卡培他滨(齐鲁制药有限公司,国药准字H20133361)1250 mg/m2,餐后 30 min 内口服,每日早晚各1 次,连续口服14 d 后停用7 d,为1 个疗程。两组均连续治疗4 个疗程为1 个治疗周期。
1.4 观察指标及判定标准
1.4.1 比较两组肿瘤发展情况 1 个治疗周期后,比较两组肿瘤发展情况,包括肿瘤病灶增大、肿瘤病灶发生远处转移,均以影像学检查结果为标准进行综合评估。
1.4.2 比较两组治疗前后癌胚抗原和糖类抗原19-9水平 1 个治疗周期后,比较两组治疗前后癌胚抗原和糖类抗原19-9 水平,癌胚抗原检测采取酶联免疫吸附法进行测定,正常值<3 ng/ml,糖类抗原19-9 水平采取酶联免疫吸附法进行测定,正常值<31.3 U/ml。
1.4.3 比较两组不良事件发生情况 包括消化道不适、骨髓抑制、周围神经毒性反应、手足综合征。
1.4.4 比较两组生存率 随访12 个月,比较两组6、12 个月生存情况。
1.5 统计学方法 采用SPSS20.0 统计学软件进行统计分析。计量资料以均数±标准差(±s)表示,采用t 检验;计数资料以率(%)表示,采用χ2检验。P<0.05 表示差异具有统计学意义。
2 结果
2.1 两组肿瘤发展情况比较 1 个治疗周期后,观察组肿瘤病灶增大率为10.0%,肿瘤病灶发生远处转移率为15.0%,均低于对照组的45.0%、70.0%,差异具有统计学意义 (P<0.05)。见表1。

表1 两组肿瘤发展情况比较[n(%)]
2.2 两组治疗前后癌胚抗原和糖类抗原19-9 水平比较 治疗前,两组的癌胚抗原、糖类抗原19-9 水平比较,差异无统计学意义(P>0.05);治疗后,两组的癌胚抗原、糖类抗原19-9 水平均低于治疗前,且观察组的癌胚抗原(4.5±0.7)ng/ml、糖类抗原19-9(27.4±2.7)U/ml 均低于对照组的(6.3±1.2)ng/ml、(33.6±3.6)U/ml,差异具有统计学意义 (P<0.05)。见表2。
表2 两组治疗前后癌胚抗原和糖类抗原19-9 水平比较(±s)
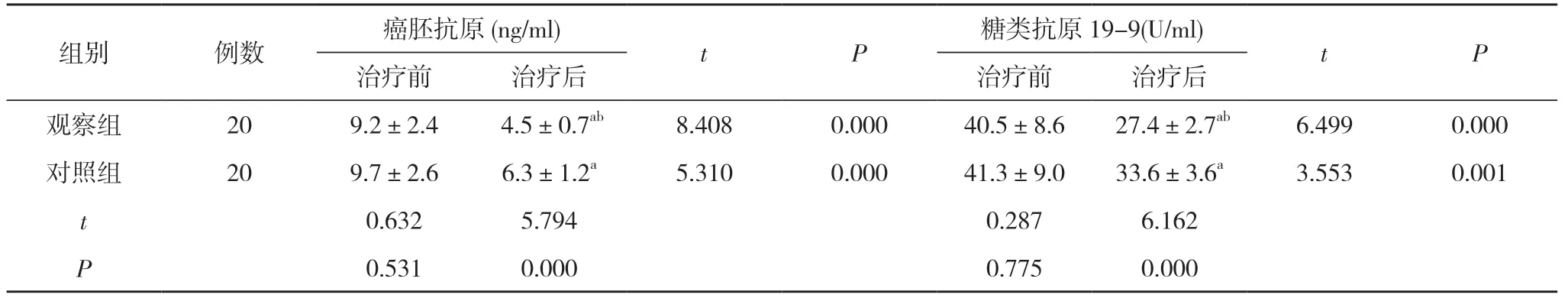
表2 两组治疗前后癌胚抗原和糖类抗原19-9 水平比较(±s)
注:与本组治疗前比较,aP<0.05;与对照组治疗后比较,bP<0.05
2.3 两组不良事件发生情况比较 观察组不良事件发生率10.0%低于对照组的55.0%,差异具有统计学意义 (P<0.05)。见表3。

表3 两组不良事件发生情况比较[n(%)]
2.4 两组生存率比较 观察组6 个月生存16 例(80.0%)、12 个月生存14 例(70.0%),对照组6 个月生存10 例(50.0%)、12 个 月生存4 例(20.0%)。观察组6、12 个月生存率均高于对照组,差异具有统计学意义 (P<0.05)。见表4。

表4 两组生存率比较[n(%)]
3 讨论
随着人们饮食结构及生活方式的改变,高脂、高蛋白及低纤维饮食比例增高等均可能导致结肠癌的发生率增高[7]。结肠癌作为一种发生于结肠上皮细胞的恶性肿瘤,其早期多无明显临床症状[8]。多数患者发现本病即处于晚期,治疗上首选手术治疗,然而多数晚期患者无法达到手术根治,故针对晚期患者多建议行药物化疗、生物治疗、免疫干预等综合治疗,其中化疗占据十分重要的地位[9]。尤其针对合并肝转移患者,临床常用的方法主要有静脉化疗、局部介入化疗等。但全身给予静脉化疗其毒副作用明显,尤其是骨髓抑制、消化道不适以及脱发等难以避免[10]。
对于结肠癌并肝转移患者,通过数字减影技术引导下针对肝动脉实施介入化疗药物灌注治疗,达到针对转移病灶供血动脉的超选择性治疗,显著提高了局部化疗药物浓度[11],具有一定临床效果但仍然对于合并肝转移病灶效果有限,无法彻底消除病灶,且需多次反复治疗,究其原因可能为肝内病灶多由肝动脉与门静脉双重血供[12]。同时肝脏本身具有十分丰富的血管网,而且可通过侧支循环进行血液供应,尤其是血运转移的肿瘤病灶容易形成小结节周围卫星灶[13]。故对于结肠癌并肝转移患者,在实施动脉灌注介入给药治疗同时还推荐使用全身化疗干预。
本研究针对结肠癌肝转移患者均实施动脉灌注介入给药治疗,对照组给予氟尿嘧啶全身化疗,观察组则应用卡培他滨。1 个治疗周期后,观察组肿瘤病灶增大率为10.0%,肿瘤病灶发生远处转移率为15.0%,均低于对照组的45.0%、70.0%,差异具有统计学意义 (P<0.05)。提示针对结肠癌肝转移患者在实施动脉灌注介入给药治疗基础上联合使用卡培他滨,对缩小肿瘤病灶,减少再发远处转移有积极作用。同时比较两组治疗前后癌胚抗原和糖类抗原19-9 水平发现,治疗后,两组的癌胚抗原、糖类抗原19-9 水平均低于治疗前,且观察组的癌胚抗原(4.5±0.7)ng/ml、糖类抗原19-9(27.4± 2.7)U/ml 均低于对照组的(6.3±1.2)ng/ml、(33.6± 3.6)U/ml,差异具有统计学意义 (P<0.05)。证实针对结肠癌肝转移患者实施动脉灌注介入给药治疗基础上联合使用卡培他滨,对降低机体癌胚抗原和糖类抗原19-9 等肿瘤标志物水平有重要价值。另外比较两组发生消化道不适、骨髓抑制、周围神经毒性反应以及手足综合征的比例发现,观察组不良事件发生率10.0%低于对照组的55.0%,差异具有统计学意义 (P<0.05)。说明针对结肠癌肝转移患者实施动脉灌注介入给药治疗基础上联合使用卡培他滨治疗,患者耐受度高,不良事件少。最后发现,观察组6、12 个月生存率分别为80.0%、70.0%,均高于对照组的50.0%、20.0%,差异具有统计学意义 (P<0.05)。进一步说明针对结肠癌肝转移患者实施动脉灌注介入给药治疗基础上联合使用卡培他滨,对提高患者生存率,延长患者生存时间有促进价值。
卡培他滨经胃肠道给予后可通过门静脉进入肝 脏[14],有效成分为5-脱氧-5-氟胞嘧啶核苷酸,并在胞嘧啶脱氨酶作用下形成5-脱氧-5-氟嘧啶[15],肿瘤病灶组织中持续释放氟尿嘧啶[16]。研究提示[17]卡培他滨在体内代谢过程中无细胞毒性,具有靶向针对性,显著确保肿瘤病灶中氟尿嘧啶浓度。口服给药后患者耐受性良好[18,19],是目前针对紫杉醇及蒽环类抗生素治疗耐受的晚期消化道肿瘤及其转移瘤的有效替代治疗方法[20]。
综上所述,针对结肠癌肝转移患者在动脉灌注介入奥沙利铂基础上口服卡培他滨,可缩小肿瘤病灶大小,减少远处转移率,降低肿瘤标志物水平,且不良事件少,对延长患者生存时间有重要意义。
