UiO-66-(COOH)2的合成及其对锂同位素吸附分离性能研究
2022-12-30刘缓缓张利峰
朱 妍,刘缓缓,王 迪,张利峰,唐 显
(中国原子能科学研究院 核技术综合研究所,北京 102413)
锂(Lithium, Li)是自然界中最轻的金属,锂元素具有两种稳定的同位素6Li和7Li,其天然丰度分别为7.42%和92.58%[1]。7Li在核领域中占有重要地位,7Li 的热中子吸收截面仅为 0.037 b,比6Li 的热中子吸收截面小近104倍,因而7Li 在核反应过程调控和设备维护中发挥着重要作用,如超纯7LiF可作为新一代熔融盐反应堆冷却剂的重要组分[2];为防止压水堆主回路容器腐蚀,用于调节主回路水pH的氢氧化锂(LiOH)要求7Li的丰度≥99.9%。因此,在核行业中7Li作为不可或缺的功能材料,对其分离方法研究具有重要的意义。
分离锂位素的方法可归为物理法和化学法,物理法包括电磁法、熔融盐电解法、 电子迁移法、分子蒸馏法和激光分离法等;化学法包括锂汞齐法、萃取法、离子交换色层分离法、分级结晶法、分级沉淀法等[3]。在分离锂同位素的过程中,物理法因过程复杂、生产设备昂贵、生产条件苛刻、能耗高、产量小等缺点,不适于工业化生产;而化学法具有分离体系简单、操作方便、单级分离效应明显和易级联等优点。目前对7Li的分离多为溶剂萃取法,萃取剂主要包括氮杂菲类和苯并喹啉类化合物,已公开的文献中分离系数约为1.019[4-5]。但溶剂萃取法由于溶剂原料成本高、合成困难,萃取体系较为复杂,难于操作等缺点,在工业运用上具有很大的局限性,故开发一种简单、高效,易操作、环境友好的7Li分离方法十分必要。
金属有机骨架(metal-organic frameworks, MOFs)材料是一类由金属离子或金属簇与多齿有机配体配位组装形成的具有周期性网络结构的晶态材料[6]。MOFs材料具有多孔性、超高比表面积[7]以及结构多样性的特点[8],且已广泛应用在吸附分离[9-10]方面,为其吸附金属锂离子与分离7Li创造可能。近几年才出现MOFs分离氢同位素(H2/D2)和硼同位素(10B/11B)的报道,目前国内外还未有关于MOFs材料分离7Li的公开文献报道。
本文通过水热法合成MOF 材料UiO-66-(COOH)2并进行表征,开展其对7Li的吸附分离实验研究。通过静态吸附分离实验探讨吸附时间、反应温度、溶液浓度等条件对UiO-66-(COOH)2锂离子吸附性能及同位素分离因子的影响,得到最大吸附量和分离因子,以期为7Li同位素的分离提一种供新的方法和思路。
1 实验部分
1.1 主要材料试剂与仪器
四氯化锆(ZrCl4):纯度≥99.9% ,阿拉丁;均苯四甲酸(PMA):纯度>98.0% ,梯希爱(上海)化成工业发展有限公司;丙酮:分析纯,国药集团化学试剂有限公司;碳酸锂(Li2CO3):分析纯,99.5%:麦克林公司;超纯水:18.2 Ω·cm,Milli-Q。
电子天平(0.01 mg~220 g):Sartorious;热重分析仪:TGA5500;扫描电子显微镜:蔡司G300;全自动比表面积及孔隙度分析仪:麦克ASAP2460;普通XRD射线粉末衍射仪:Ultima Ⅳ 日本理学;ICP等离子体发射光谱仪:iCAP 7400;多通道接收电感耦合等离子体质谱仪:Nu Plasma Ⅱ 英国UN Instruments公司。
1.2 实验方法
1.2.1UiO-66-(COOH)2合成 采用水热法合成UiO-66-(COOH)2[11],首先取2.3 g(0.01 mol)ZrCl4与4.3 g(0.017 mol)均苯四甲酸(PMA),分散在50 mL去离子水中,在高温、高压反应釜内以1 ℃/min的速率从室温升至100 ℃,保温24 h。自然冷却至室温后,得到白色凝胶状固体。用去离子水洗涤三次,除去其中的游离酸。随后将洗涤过的凝胶分散在超纯水中(凝胶与超纯水体积比约1∶4~1∶5),在反应釜内以0.5 ℃/min的速率从室温升至100 ℃,保温24 h。待自然冷却至室温后,分别用去离子水和丙酮洗涤三次。在70 ℃下干燥16 h,得到白色粉末3.26 g,收率90.5%,化学式示于图1。

图1 UiO-66-(COOH)2的结构式Fig.1 Structural formula of UiO-66-(COOH)2
1.2.2Li2CO3溶液配制 分别称取0.184 7、0.369 4、0.554 2、0.738 9、0.923 6、1.108 4 g Li2CO3固体,在50 mL烧杯中加入一定量去离子水,用玻璃棒搅拌至完全溶解,沿玻璃棒转移100 mL容量瓶,定容摇匀。分别得到浓度为0.025、0.05、0.075、0.100、0.125、0.015 mol/L的Li2CO3溶液。
1.2.3UiO-66-(COOH)2对Li2CO3的静态吸附分离实验 在一定温度下,将0.05 g UiO-66-(COOH)2均匀分散在10 mL一定浓度的碳酸锂溶液中,在恒温震荡水槽中匀速震荡,不同时间取样。
1.3 分析表征
1.3.1MOF结构表征 热重分析(TG):升温速率10 ℃/min、测试气氛为氮气。扫描电子显微镜(SEM):直接黏到导电胶上制样,喷金。全自动比表面积及孔隙度分析(BET):吸附气体为氮气,脱气温度100 ℃,测试模式为全孔,脱气时间8 h。X射线衍射分析(XRD):测试范围5°~90°,扫描角度范围5°~50°,扫描速度2°/min。
1.3.2Li浓度及6Li/7Li丰度测定 电感耦合等离子体发射光谱(ICP-OES法)测定Li浓度。样品选项重复三次,样品冲洗时间30 s,冲洗泵速120 r/min、分析泵速50 r/min、泵稳定时间10 s;RF功率1 150 W、辅助气流量0.5 L/min、雾化器流量0.7 L/min、冷却气流量14 L/min、添加气流量0、Li选择谱线670.784。多通道接收电感耦合等离子体质谱(MC-ICP-MS法)测定同位素丰度比(6Li/7Li):RF功率1 300 W,反射功率<3 W,辅助气流量0.85 L/min,载气流量37.3 L/min,冷却气流量14 L。
1.4 吸附性能评价
评价MOF材料UiO-66-(COOH)2对7Li吸附分离的指标有吸附量Q和分离因子S(7Li/6Li)。吸附量Q是指一定温度与一定的吸附质浓度下,单位吸附剂对吸附质吸附的最大量。分离因子S是指分离操作前后,两种物料相对含量的比值。吸附量Q(mg/g)按公式(1)、(2)计算:
(1)
(2)
其中,c0为吸附前锂离子浓度,μg/mL;c1为吸附后溶液中锂离子浓度,μg/mL;D为每mL溶液中吸附剂用量,g/mL;m为静态吸附实验中MOF的用量,g;V为Li2CO3溶液的体积,mL。
分离系数S可按公式(3)、(4)[12]计算:
S(6Li/7Li)=[6Li/7Li]adsorbent/[6Li/7Li]solution=
(3)
S(7Li/6Li)=1/S(6Li/7Li)
(4)
式中,α0为吸附前Li2CO3溶液中6Li/7Li同位素比值,α1为吸附后溶液中6Li/7Li同位素比值。
2 结果与讨论
2.1 UiO-66-(COOH)2表征
UiO-66-(COOH)2的表征结果示于图2。

a——普通XRD射线衍射图谱;b——SEM扫描电子显微镜;c——BET全自动比表面积及孔隙度分析;d——TG热重分析图2 UiO-66-(COOH)2的表征Fig.2 Characterization of UiO-66-(COOH)2
XRD谱(图2a)中UiO-66-(COOH)2在7.45°、8.60°、12.12°、14.26°、17.41°、18.93°、26.14°、33.33°、43.52°有强衍射峰,峰位置与模拟XRD标准图谱的衍射峰位置一致,表明成功制备了该MOF材料,可以用于7Li的吸附和分离。UiO-66-(COOH)2的SEM谱图(图2b)表明,通过喷金颗粒放大3 000倍的照片可以看出,制备的UiO-66-(COOH)2具有完整的球体结构形貌。UiO-66-(COOH)2的N2吸附-解析等温线(图2c)表明,其等温线类型接近于Ⅳ型-介孔材料,显示出其具有较多且均匀孔径的特征,材料的孔径等特性见表1,证明UiO-66-(COOH)2可用于吸附分离。UiO-66-(COOH)2的TG热重分析谱图(图2d)表明该材料具有高热稳定性,100~150 ℃时,由于UiO-66-(COOH)2孔道失水而导致质量损失;350~450 ℃时,UiO-66-(COOH)2结构中的配体开始分解,质量下降;570 ℃以后,金属节点断裂,最终生成ZrO2。

表1 全自动比表面积分析相关数据Table 1 The analysis of automatic specific surface area analysis
2.2 不同条件对吸附性能的影响
2.2.1吸附时间 用0.05 g UiO-66-(COOH)2对0.05 mol/L Li2CO3(Li浓度 0.1 mol/L)进行静态吸附实验,20 ℃下分别在0.5、1、1.5、2、3 h等时间进行取样,每次取样2 μL,用ICP-OES测试锂浓度,计算吸附量Q,结果示于图3。图3结果表明,在静态吸附分离到达4 h,UiO-66-(COOH)2对Li的吸附量最大,为11.4 mg/g。随着吸附时间增加,吸附量逐渐下降,最终维持在约5~7 mg/g,推测可能随吸附时间增加,UiO-66-(COOH)2中-COOH在弱碱性环境中脱落,使其吸附能力下降。

图3 不同时间UiO-66-(COOH)2对Li2CO3吸附分离中Li吸附量的影响Fig.3 Effect of different times on the adsorption quantity
2.2.2反应温度 用0.05 g UiO-66-(COOH)2对0.05 mol/L Li2CO3在5~50 ℃下进行静态吸附实验,充分震荡4 h。吸附量Q和分离因子S(7Li/6Li)随温度的变化示于图4。由图4结果可知,在20 ℃时,分离因子达到1.020,吸附量Q达到9.53 mg/g。相比于25 ℃时,虽然吸附量达到10.6 mg/g,但分离因子大幅降低,仅为1.002。随着温度升高,Q逐渐降低到1.0 mg/g,S也降低至1.002~1.005。在20 ℃以下时,UiO-66-(COOH)2对Li的吸附变大,但分离因子明显减小。可以证明UiO-66-(COOH)2对Li的吸附过程为放热过程,降低温度对7Li的吸附分离有利。出于操作的难易程度,以及考虑到后续实验和工艺能源消耗等问题,认为20 ℃为最佳。

图4 不同温度UiO-66-(COOH)2对Li2CO3吸附分离中Li吸附量和锂同位素分离因子的影响Fig.4 Effect of different temperatures on the adsorption quantity and the separation factors
2.2.3溶液浓度 改变Li2CO3溶液中Li+浓度,用相同质量的UiO-66-(COOH)2(0.05 g)对不同浓度Li2CO3溶液(10 mL)进行静态吸附分离实验,结果示于图5。由图5结果可知,当Li+浓度为0.10 mol/L时,Li的吸附量和分离因子均最大。此时所用Li2CO3溶液浓度0.05 mol/L为吸附分离实验的最佳浓度。
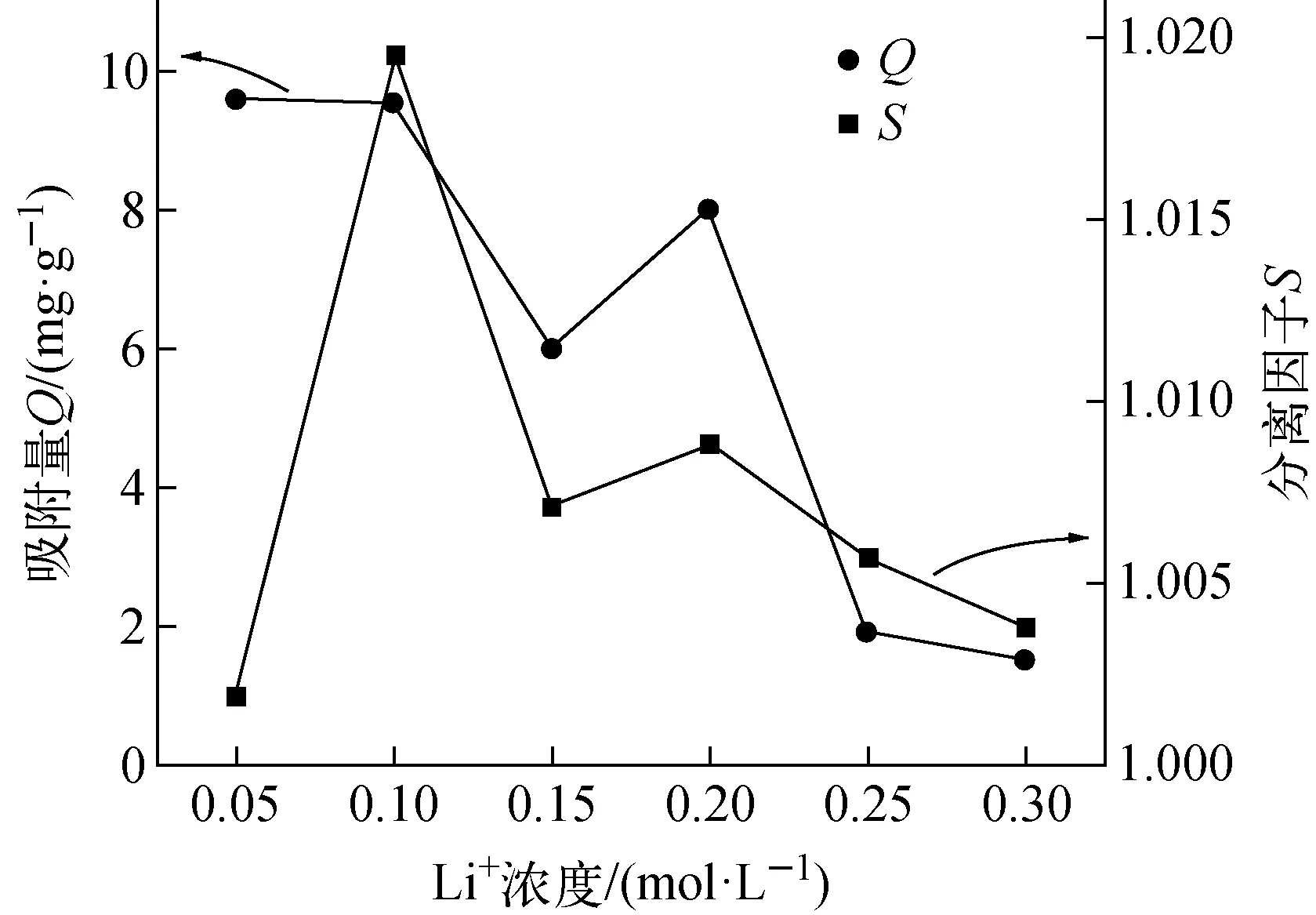
图5 不同Li+浓度UiO-66-(COOH)2对Li2CO3吸附分离中Li吸附量和锂同位素分离因子的影响Fig.5 Effects of different Li+ concentrations on the adsorption quantity and separation factors
经实验确定,称取0.05 g UiO-66-(COOH)2在10 mL浓度0.05 mol/L的Li2CO3溶液中均匀分散,在20 ℃充分震荡4 h,结果列于表2。由表2数据可知,在此条件下UiO-66-(COOH)2对Li的平均吸附量为9.53 mg/g,单级平均分离因子为1.019 54。

表2 UiO-66-(COOH)2对Li的最大吸附量和分离因子Table 2 Maximum adsorption quantity and separation factors for Li by UiO-66-(COOH)2
2.3 机理推测
在水溶液体系中,Li+的离子半径很小,电荷密度高,且2s和2p均为空轨道,以sp3空轨道杂化与给电子配位体(如:水)络合形成稳定的略呈扭曲的四面体配位结构,Li+在水相中以[Li(H2O)4]+结构状态存在,且该结构中Li-O键键长为1.956 Å(1 Å=0.1 nm)[13]。BET吸附实验中UiO-66-(COOH)2吸附平均孔径为4.259 4 nm,推测其孔径大小符合对Li+的吸附条件,展现出对Li+较好的吸附性能。UiO-66-(COOH)2具有八面体对称结构[11],符合刘育等[14]曾提出具有对称结构和适宜孔径尺寸的物质对Li+络合能力更强的理论。
Bigeleisen[15]曾指出,按化学键观点一相中锂物种应当是强键相,即具有较高的振动频率和大的同位素频率位移;而另一相则应当是弱键相即具有较低的振动频率和小的频率位移,两者差别愈大则体系的分离因子愈大,而且重同位素富集在强键相。实验结果中MOF相富集了7Li,UiO-66-(COOH)2中存在大量吸电子基团-COOH,在水溶液中以O-负离子形式存在,推测MOF相中-COO-作为硬碱性阴离子与电荷密度很高的硬酸性阳离子[16]Li+结合形成的Li-O键强于水相中Li+与H2O中Li-O键,使重同位素7Li富集在MOF相,达到了富集7Li的目的。符合Biseleisen提出的理论。
3 结论
本工作采用水热法合成金属有机骨架材料UiO-66-(COOH)2,开展了其对7Li的吸附分离实验研究。实验表明,在20 ℃下,用0.05 g UiO-66-(COOH)2对10 mL 0.05 mol/L的Li2CO3进行静态吸附分离实验可以达到最大吸附量与分离系数,实验具有较好的重复性,结果可靠。平均吸附量为9.53 mg/g,平均分离因子可达1.019 54。相比于其他方法,该体系操作简单,对环境友好,是一种全新的分离锂同位素的方法,值得进一步研究。
