单核细胞增生李斯特菌生物被膜交叉污染评估进展
2022-12-30方太松赵婕秀李卓思秦晓杰董庆利
王 真,方太松,王 园,2,赵婕秀,李卓思,秦晓杰,王 翔,董庆利,*
(1.上海理工大学健康科学与工程学院,上海 200093;2.上海中侨职业技术大学食品药品学院,上海 201514)
单核细胞增生李斯特菌(Listeria monocytogenes)简称单增李斯特菌,是一种兼性厌氧型、无芽孢的革兰氏阳性短杆菌,是“四大食源性致病菌”中致死率最高的一类[1]。2020年美国疾病预防控制中心的流行病学研究显示,美国李斯特菌病患者的死亡率为21%[2]。2018年欧洲食品安全局和欧洲疾病预防控制中心报告显示欧洲各国李斯特菌病患者死亡率为15.6%[3]。中国大陆2011—2017年间报告的562 例散发型李斯特菌病患者中非围产期患者死亡率为23.78%,围产期患者流产或新生儿死亡率为32.68%[4]。
单增李斯特菌在食品接触表面大多以生物被膜模式,而不是以浮游模式存在。生物被膜是微生物对生存空间和营养物质进行有效竞争以及抵御不良环境的一种生存策略。生物被膜态和浮游菌态相比表型不同,一旦形成生物被膜,胞外聚合物质(extracellular polymeric substances,EPS)可充当物理和化学屏障保护内部细菌,增强致病菌暴露于胁迫环境时的抵抗能力[5]。并且单增李斯特菌进入食品加工链后,在生物被膜形成阶段后期会有浮游菌体从生物被膜中脱落分散到周围环境中,进而开始新一轮生物被膜的形成,导致交叉污染持续发生,加剧单增李斯特菌在整个食品链的传播,从而威胁食品安全并引起相对严重的疾病负担和经济损失。
单增李斯特菌通过特定宿主传播导致食源性疾病发生不是其传播的唯一途径,交叉污染即通过直接或间接接触转移到未污染食品上,消费者食用被单增李斯特菌污染的食品是其传播到人体的主要途径[6]。据报道,全球每年约有20亿致病菌通过食物传播导致的病例,其中100多万病例死亡[7],食品污染80%的来源是食品接触表面和非接触面所形成的生物被膜[8]。当食品接触面不再是单层附着的浮游态菌体,而是含有EPS的多层生物被膜时,EPS组分可能会影响单增李斯特菌在食品接触表面上的黏附特性和数量,因此菌体的交叉污染转移情况就变得更复杂,目前也无专门针对单增李斯特菌生物被膜交叉污染相关的系统总结。
基于此,本文首先介绍了单增李斯特菌生物被膜的EPS,并深入探讨了形成单增李斯特菌生物被膜时影响其交叉污染转移的内外部因素和相关研究内容;其次,对单增李斯特菌生物被膜的早期防控进行了较为全面的概述;最后,对未来研究前景提出展望,以期降低单增李斯特菌生物被膜交叉污染引发的食源性疾病风险从而保障食品安全。
1 单增李斯特菌生物被膜
生物被膜也称生物膜或菌膜,指微生物附着于食品接触面或非食品接触表面,由细菌及其自身分泌的黏性EPS组成,经生长增殖形成具有一定空间结构和复杂代谢系统的高度组织化细菌群体[9]。生物被膜的形成有助于微生物在不利环境中生存,其能够提供以下表型多样性和生态优势:1)产生EPS保护内部菌体免受周围环境影响;2)通过营养交换和去除潜在有毒代谢物来增强营养物质的可利用性和代谢协作;3)通过水平基因转移获得新的遗传特征(例如抗生素抗性基因)[10]。
生物被膜形成的动态演变过程主要分为5个阶段:菌体黏附于接触表面→产生EPS→形成微菌落→微菌落转化为成熟生物被膜→生物被膜中活细胞向周围环境分散。根据EPS产生与否进一步被划分为可逆黏附和不可逆黏附2个阶段[9]。
如表1所示,蛋白质、多糖和胞外脱氧核糖核酸(extracellular deoxyribonucleic acid,eDNA)作为单增李斯特菌EPS的主要组分,与生物被膜形成密切相关,其构成了生物被膜3D结构的基本骨架。各组分在生物被膜形成的不同方面如初始黏附、内聚、群体感应(quorum sensing,QS)、细胞膜结构和营养代谢等都发挥着重要作用,影响着单增李斯特菌生物被膜结构和功能的完整性。生物被膜的形成赋予单增李斯特菌高耐受性和持久性,造成交叉污染,威胁食品安全。
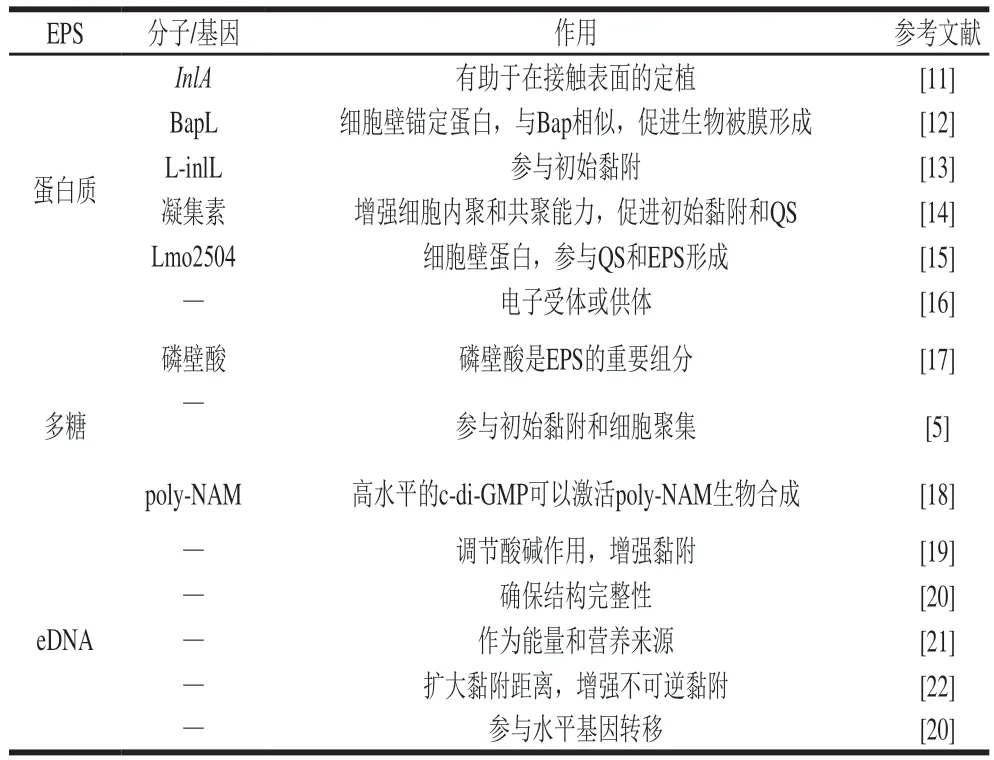
表1 EPS的主要组分及作用Table 1 Major components and functions of EPS
2 单增李斯特菌生物被膜交叉污染与食品安全
单增李斯特菌在食品加工设备和环境中持续存在,特别是在低温等不利条件下的独特持久性是引起人类李斯特菌病持续性暴发的重要原因[23]。并且持久性菌株比散发性菌株形成的生物被膜更厚,且瞬时接触时持久性菌株表现出更强的黏附性,促使其在食品加工设备中存活并成为交叉污染的传播中心[24]。基于Gusnaniar等[25]的研究,图1重绘并演示了生物被膜菌体既可以通过破坏生物被膜-供体的界面张力发生转移,也可以通过破坏生物被膜的内聚力发生转移。但在自然形成的生物被膜中,菌体之间的距离远超出理化作用范围,故破坏生物被膜内聚力发生转移的情况更普遍。
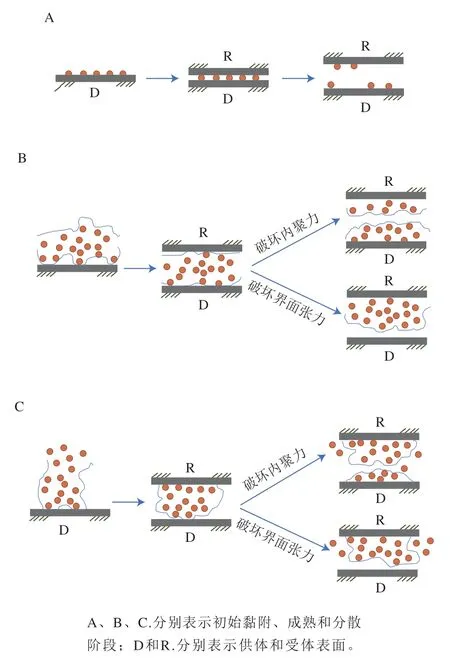
图1 生物被膜菌体的转移场景Fig. 1 Transfer scenes of biofilm-forming bacteria
交叉污染指菌体从已被污染的物体表面经过直接或间接的方式转移至未受污染的物体表面(食品或其他接触面)的过程。交叉污染发生在全食品链中的任一阶段,导致其发生的常见因素有:1)不恰当的食品处理习惯;2)已被污染的待加工食品;3)受致病菌感染的食品处理人员[26-27]。交叉污染对于低剂量感染的致病菌尤为重要[28],GB 29921—2021《食品安全国家标准 预包装食品中致病菌限量》[29]规定单增李斯特菌的限量标准为“25 g样品中不得检出”,德国、法国等欧盟国家即食食品中单增李斯特菌限量标准为不高于100 CFU/g[30],单增李斯特菌在即食食品中的检出很少超过限量标准,但是李斯特菌病例确诊人数却在逐年增加[3]。Willis等[31]在水果、蔬菜以及果蔬混合物中均检出单增李斯特菌,其污染水平全部不高于100 CFU/g,但是分离菌株却与李斯特菌病暴发菌株相关。生物被膜的形成提高了单增李斯特菌的污染概率,交叉污染扩大了单增李斯特菌在全食品链中的传播范围,经交叉污染途径转移的微量单增李斯特菌在适宜生存环境且存在易感人群条件下引起潜在的食源性疾病暴发风险需更加重视。近年来国内外交叉污染导致的李斯特菌病暴发事件如表2所示。
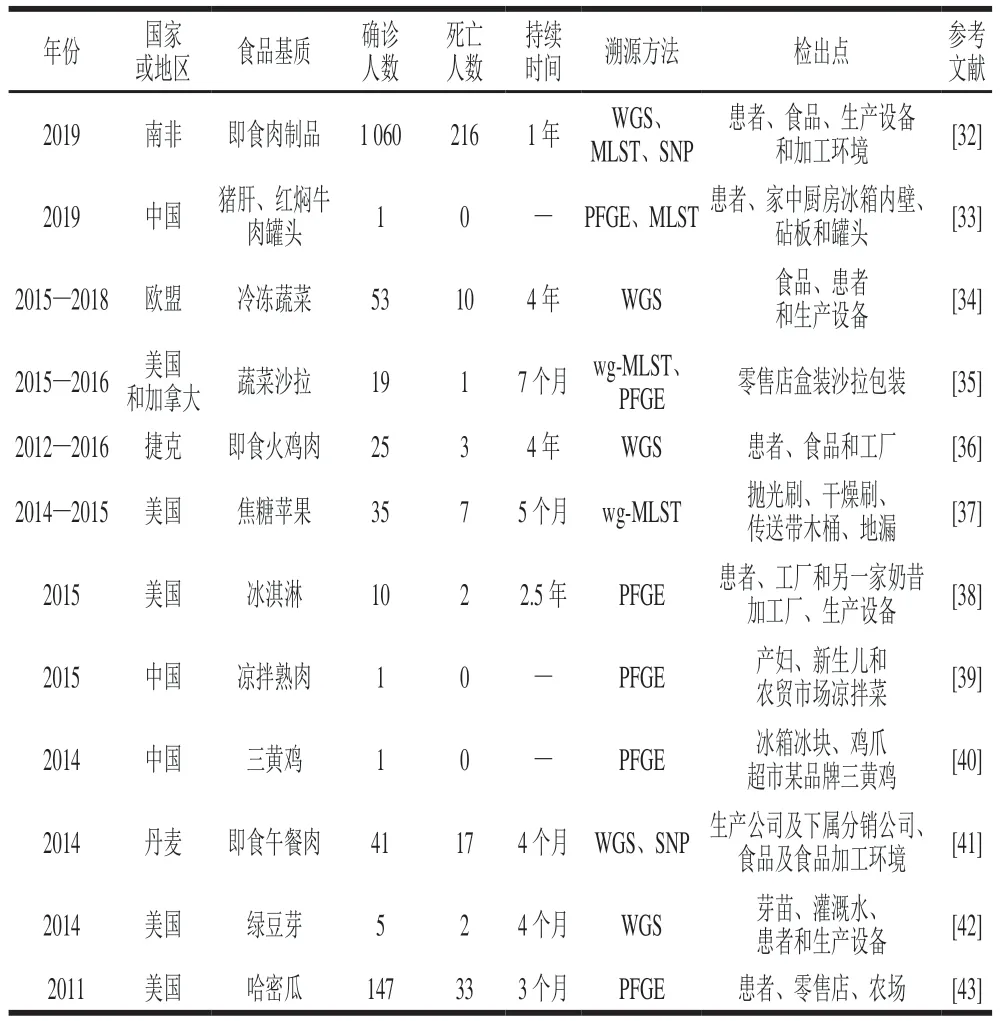
表2 交叉污染导致李斯特菌病暴发事件Table 2 Listeriosis outbreak caused by cross-contamination
由表2可知,被污染的肉制品特别是食用前不经加热处理的即食熟肉及其肉制品是食源性李斯特菌病的主要诱因,同时,与新鲜农产品相关的李斯特菌病例暴发也受到了更广泛的关注。如冰淇淋相关的李斯特菌病暴发事件表明单增李斯特菌独特的持久性与其在低温环境下的存活能力有关[38]。近年来,研究发现肉汁会影响生物被膜的形成,并加剧其在食品链中的传播[44],此外,曾经被认为是去污的采后洗涤过程因为水、水中的颗粒物质以及果蔬之间的接触会导致交叉污染的发生,现在也被视为发生交叉污染的高风险点[41,45]。对于李斯特菌病暴发是否源于持续存在的单增李斯特菌交叉污染,可采用WGS、MLST、wg-MLST和PFGE等方法溯源分析来自于食品及其所涉及工厂、分销商的食品加工设备和环境中的分离株与病例来源菌株的同源性来揭示。
3 单增李斯特菌生物被膜交叉污染影响因素
生物被膜形成过程中会影响其结构功能、组成成分、细胞和细胞以及细胞和接触表面的相互作用,会对菌体后续的潜在转移过程产生影响。单增李斯特菌生物被膜的存在与否取决于形成过程中的影响因素,同时这些因素也会影响单增李斯特菌总数量与黏附特性,进而导致转移量差异。以下结合单增李斯特菌生物被膜形成过程中的影响因素以进一步阐明影响单增李斯特菌生物被膜交叉污染的因素。
3.1 外部环境条件因素
接触表面的粗糙度会影响单增李斯特菌在接触表面的黏附,粗糙表面提供了更大的表面积供单增李斯特菌定植。粗糙表面比光滑表面上可能会发生更多的单增李斯特菌转移,Gkana等[26]定量研究了影响单增李斯特菌从接触表面转移到牛肉的因素,结果表明木质表面(2.77(lg(CFU/g)))单增李斯特菌的转移量高于不锈钢和塑料表面(2.66(lg(CFU/g)))。宋筱瑜[46]、董庆利[47]等的相关研究中也得到了在同一转移场景下木质表面单增李斯特菌的转移率显著高于其他材料表面。
生物被膜的转移量与其在接触面上的生成量相关。接触面的疏水性会影响接触表面单增李斯特菌的黏附性和可以转移的数量。Choi等[48]研究发现生物被膜形成能力与疏水性呈正相关。Yi等[49]研究了生菜叶和食品接触表面(玻璃、聚乙烯)间的交叉污染,结果表明菌体的转移率随食品表面疏水性的增加而增加。
初始接种量是影响生物被膜细胞转移的另一重要因素。初始接种量会影响生物被膜的形成过程,处于可逆黏附或不可逆黏附阶段的生物被膜根据EPS的存在与否从接触表面脱落所需的作用力不同。研究表明107CFU/mL和105CFU/mL初始接种量的单增李斯特菌EDGe在25 ℃孵育14 d期间,分别在第3天和第5天观察到生物被膜形成量达到最大[50]。因此,为获得准确的细菌转移率定量数据必须考虑初始接种量的影响。
同时,环境中营养成分的可利用性也与单增李斯特菌生物被膜的形成量有重要的联系。营养成分会影响EPS的分泌,从而导致单增李斯特菌的黏附性差异,进而影响转移情况。Lakicevic等[51]比较了20 株单增李斯特菌在胰蛋白胨大豆肉汤(tryptic soy broth,TSB)和营养肉汤2种培养基中生物被膜的形成能力,结果表明所有的单增李斯特菌菌株均可在聚苯乙烯上形成生物被膜,且在营养丰富的TSB培养基中生物被膜形成量更多。生物被膜的转移量取决于接触面上生物被膜的形成量,因此,环境中营养的可利用性也会间接影响生物被膜的转移。
3.2 内部微生物自身因素
菌株的血清型是影响生物被膜形成的因素之一,Wang Wenkai等[52]的研究表明,单增李斯特菌血清型1/2b比1/2a的生物被膜形成能力强;Harvey等[53]研究发现谱系II中的1/2a和1/2c比谱系I中4b和1/2b生物被膜形成能力强。然而Dhowlaghar等[54]研究发现,血清型1/2b、3b、4b和4c的生物被膜形成能力没有显著性差异。生物被膜形成能力的强弱会对转移产生影响,Keskinen等[55]研究了生物被膜形成能力不同的单增李斯特菌转移差异,结果表明生物被膜形成能力强的菌株表现出更强的转移能力,且生物被膜形成6 h比24 h的转移菌量多。
生物被膜会因EPS的组分和含量不同形成不同空间结构,可能会导致活菌的数量和分布不同,从而产生转移差异。单增李斯特菌中的eDNA对生物被膜的形成具有显著影响,Zetzman等[56]的研究结果证实了eDNA在低渗透活性物质浓度的介质中对单增李斯特菌生物被膜形成具有重要作用。同时,eDNA可通过调节酸碱作用增强单增李斯特菌在不同接触表面的黏附[19],故eDNA的存在可能会导致转移差异。
QS系统会影响单增李斯特菌在接触表面的初始黏附和生物被膜形成能力。Gandra等[57]的研究确定了agrBCD基因对于单增李斯特菌黏附和生物被膜形成的重要性,特别是在培育12 h和24 h时。另外,呋喃糖基硼酸二酯作为自诱导因子2(auto inducer-2,AI-2),是生物被膜形成时QS的通用信号分子,能够调控细菌的聚集、鞭毛合成以及运动基因,已有研究证实合成AI-2分子会影响菌体在玻璃和不锈钢表面的黏附以及后续到牛肉、猪肉、萨拉米香肠、哈密瓜、生菜等不同类型食品的转移[58]。由此可见,QS能通过控制下游基因的表达来调控生物被膜形成以及细菌运动能力,故可通过干扰QS抑制生物被膜的形成和转移。
代谢系统和QS系统之间存在关联,会影响单增李斯特菌对营养物质的可利用性、EPS的产生和生物被膜的形成。营养缺乏时补充前体代谢物信号分子S-腺苷甲硫氨酸(S-adenosylmethionine,SAM)能够诱导生物被膜形成,编码EPS合成机制的基因表达受SAM和/或Agr QS系统调控,并且这种调控依赖于细菌从浮游态到固着态的转变[59]。接触表面上生物被膜的转移会受接触表面生物被膜形成量的影响,然而生物被膜形成及抗性背后复杂的调控机制尚未得到足够的研究,揭示合作性共存的潜在机理有利于更好地评估生物被膜交叉污染风险。
4 单增李斯特菌生物被膜交叉污染研究
4.1 交叉污染的研究类型
实验室模拟研究通过控制特定实验条件和因素进行研究,其无法解释真实复杂情况中的全部影响因素,但可确定某些特定影响因素,从而更好地理解交叉污染的复杂本质。现场研究各因素虽不可控,但能识别真实环境中的交叉污染途径且接近真实情况。
在实验室模拟生物被膜转移场景时,应尽可能地考虑交叉污染过程的复杂性以更加接近真实环境。除去常规影响因素,如接触面材质、温度、接触时间以外,目标菌株的采样地点也应纳入考虑,说明菌株采样地点如经过清洗消毒的接触表面或生产过程中的设备表面或厨房接触面,有利于区分菌株的持久性和散发性[24]。目前对单增李斯特菌生物被膜形成能力的研究通常基于有利于细菌生长的实验室培养基,由于营养的可利用性、离子强度和pH值等因素,真实食品加工环境中的生物被膜的生长、存活情况可能会与实验室环境中的评估结果存在差异。研究发现单增李斯特菌能够在猪肉汁、鸡肉汁、牛肉汁和三文鱼肉汁中存活并形成生物被膜,且生物被膜培养基是影响单增李斯特菌存活和产生抗性的主导因素,因为肉汁有利于单增李斯特菌存活,其存活情况在人工培养基中会被低估。同时,在肉汁中形成的生物被膜更厚、细胞密度更大,对化学消毒剂的抗性更强[24,44]。此外,进行单增李斯特菌生物被膜菌体转移模拟实验时,为了使接触表面两面的菌体都能够转移,通常使用夹心法进行接触转移研究[60]。
现场研究是在各种影响因素不受控制的条件下,不考虑影响转移的因素和过程,侧重于量化细菌转移时发生的频率以及识别工厂、零售店和厨房等真实环境中的污染路径[61]。已有研究通过直接采访食品处理人员并利用接触性琼脂获取其手上微生物污染样本,确定了食品处理人员的手是菌体转移的重要媒介[62]。Evans等[63]针对60 岁以上的老年人,使用模拟厨房直接观察其食品操作习惯,并结合微生物学分析,明确了冰箱把手、砧板、水池、毛巾、水龙头和抹布等是交叉污染中微生物来源的潜在途径。另外,Barril等[64]对肉店中的生碎牛肉和肉类接触面进行采样,结果证实大多数肉店存在单增李斯特菌污染的风险,且不同肉店菌株的核糖体分型存在相关性,揭示了交叉污染潜在风险。
综上,这两种类型的研究数据都可以为暴露评估(交叉污染模型)、风险管理和风险交流提供定性或定量信息。因此,将实验室仿真模拟研究结果和现场研究信息相结合有助于识别交叉污染潜在路径,更加准确评估单增李斯特菌生物被膜交叉污染对公众健康的危害。
4.2 交叉污染的细菌收集
对食品接触表面和周围区域进行常规表面取样能够监测食品加工环境中单增李斯特菌生物被膜污染情况和检验清洁消毒措施的有效性。然而,无效的取样技术或工具可能导致单增李斯特菌存在但无法检出,阻碍及时实施防控措施,导致安全假象产生[65]。此外,不同研究者的操作惯性差异也可能导致菌体的低回收率和低重现性,使得不同研究结果难以比较[66]。深入了解影响菌株收集的因素能够标准化菌体收集方法,有助于科学准确评估单增李斯特菌生物被膜转移的潜在风险。
拭子法操作简单,长期以来是进行实验室研究和环境监测的常用表面取样方法[67]。不同的材料类型的拭子工具如棉签拭子、海绵拭子、植绒拭子和刮刀拭子等能够较好地收集不锈钢、塑料和橡胶等不同材料食品接触表面的单增李斯特菌,并且不同取样工具所得检测结果没有显著性差异[68];另外,采用棉签拭子或海绵拭子取样时,可以预先使用灭菌缓冲蛋白胨水等润湿以提高取样效率。棉签拭子是小面积取样时的理想选择,但大面积(>100 cm2)取样时更适合采用海绵拭子[69]。对食品接触表面的生物被膜采用拭子法取样时,可将棉签拭子法和刮刀拭子法结合使用,刮刀拭子法适用于对生物被膜的EPS进行分析,其结果略低于真实水平但不会干扰蛋白质、多糖等成分测定。而对于微生物计数,棉签拭子法比刮刀拭子法略微有效,但差异不显著[70]。
采用拭子法从接触表面收集细菌时,还应考虑接触表面类型导致的结果差异,如孔隙率、粗糙度、疏水性和材料成分。Jones等[67]研究发现,无论是高(106~107CFU/cm2)和低(0.01~1 CFU/cm2)接种量情况下,相比于不锈钢和塑料接触面,多孔、粗糙的木质接触面上单增李斯特菌回收率均最低,且在低接种量下差异显著。不锈钢是常见的食品加工设备材料,研究发现其表面结构不影响单增李斯特菌的回收率,但会影响单增李斯特菌的细胞活力,并且与聚丙烯和高密度聚乙烯相比,不锈钢表面的细胞活动均下降,表明细菌的回收率也受接触表面材料成分的影响。
除表面特性外,微生物在接触表面的种类和细胞密度也会影响回收率。革兰氏阳性或阴性菌特征会影响干燥表面细菌的收集[69]。革兰氏阳性菌(如单增李斯特菌)在细胞外层含有蛋白质组成的多层肽聚糖层,而革兰氏阴性菌(如沙门氏菌)的肽聚糖层膜要薄得多,这种形态会影响细菌在表面上的黏附方式。细菌初始接种水平也是影响评估表面微生物回收率的重要因素。实验室研究中往往在高浓度(单位面积菌量大于104CFU)时能获得期望的研究结果,但在较低接种水平时菌体收集几乎没有。需要进一步在高接种水平下,通过逐步降低接种水平来评估取样方法的检测限[67]。另外,接种后接触表面的干燥时间会影响菌体的收集,如低接种量(100 CFU/250 cm2)条件下,在不锈钢、高密度聚乙烯和橡胶表面接种后立即取样和风干1 h后取样,不同取样时间检测结果之间存在显著差异[68]。
采样后需谨慎选用收集细菌所用的介质溶液,介质溶液的成分应可恢复亚致死细胞的生长而不是致其死亡,同时应避免促进或抑制正常细胞的生长,以防高估或低估微生物的污染水平。如果收集的介质溶液中不含中和消毒剂残留物的成分,可能会低估细菌污染水平并且有利于具有高抗性的细菌存活。单增李斯特菌和接表面消毒剂残留物的成分被同时取样并放置在同一介质溶液中时,出现单增李斯特菌假阴性结果的可能性会增加[28,71]。传统的检测方法没有考虑到不可培养细胞的存活情况,会导致活的不可培养细胞未被检测收集,从而误判食品加工接触表面的卫生状况,造成潜在的交叉污染发生[72]。
5 单增李斯特菌生物被膜交叉污染的预防与控制
成熟生物被膜黏附牢固、结构致密。早期生物被膜三维结构尚未形成,黏附松散、结构脆弱,附着的细菌对抗菌化合物敏感性更高,此时去除生物被膜具有明显的优势。故抑制早期生物被膜的形成可阻碍其发展为成熟生物被膜,减少生物被膜的相关危害。
5.1 降低可逆黏附
在接触表面增加亲水涂层是减少细菌初始黏附的常用方法。基于不同电荷之间的相互作用以及菌体表面的疏水特性,在接触表面涂覆亲水涂层可减少细菌黏附,防止早期生物被膜形成。有研究表明,经聚二乙醇改性的不锈钢接触表面粗糙度降低,亲水性提升,单增李斯特菌在改性后的接触表面上初始附着和生物被膜形成量降低90%以上[73]。纳米粒子有机硅烷能通过固液相互作用改变接触面的亲/疏水性,能与玻璃、不锈钢接触面上的无机底物反应形成稳定的共价键和有机取代,影响生物被膜的初始黏附和形成,但是以上反应高度依赖菌种和接触表面性质[74]。
除亲水涂层外,在接触表面涂抗菌剂直接杀灭附着的细菌是抑制细菌可逆黏附的有效方法。银离子具有广谱杀菌活性,银涂层表面对生物被膜的形成具有显著抑制作用[75]。银纳米粒子因其具有纳米材料性质和银的抗菌性能也是一种理想抗菌物质[76]。抗菌肽作为一种碱性多肽,不易受细菌耐药性影响,Oger等[77]研究发现抗菌肽作用于接触表面时细菌的初始黏附性降低了50%,说明抗菌肽是具有前景的抗生物被膜涂层。
单增李斯特菌每个细菌细胞约有4~6 条鞭毛,鞭毛可介导细胞运动,并可作为表面黏附素,对在非生物接触表面形成生物被膜至关重要[78]。以鞭毛为靶点防止细菌运动和黏附也能有效控制早期生物被膜形成。相关研究表明抗生物被膜活性和抗细菌运动性明显相关,植物分子番茄碱、氯化锌、乙二胺四乙酸以及凝固酶阴性葡萄球菌中较复杂的细菌化合物混合物能够显著抑制细菌的游动能力,使细菌停留在浮游阶段,阻止其初始附着,减少生物被膜的形成[79-80]。
5.2 抑制EPS的产生
EPS的产生表明细胞从可逆黏附转变为不可逆黏附。抑制EPS产生、降低可逆黏附是控制早期生物被膜形成的重要目标。表3总结了针对蛋白质、多糖和eDNA这3种EPS主要组分开展的部分研究,以了解针对EPS开展防控措施能否有效去除单增李斯特菌生物被膜。
由表3可知,减少胞外多糖、胞外蛋白质和eDNA是去除早期生物被膜的重要策略。但是,抑菌物质的作用机理还有待继续深入挖掘,如丁香精油作用于生物被膜后eDNA含量变化不明显的原因,推测可能一方面丁香酚与DNA嵌合导致eDNA含量下降;另一方面丁香精油处理破坏了生物被膜结构后直接作用于细菌,细菌裂解并释放DNA,导致eDNA含量增加,综合两方面原因导致eDNA含量变化不明显[82],但具体原因仍需进一步研究。近年来,由于对化学消毒剂等具有抗性的单增李斯特菌的出现,天然植物提取物如精油(芳香植物中产生的天然挥发性酚类化合物)、细菌素(革兰氏阴性菌和革兰氏阳性菌包括乳酸菌产生的抗菌肽)以及具有抗菌活性的益生菌及其上清液作为安全且被证实对单增李斯特菌生物被膜具有抑制作用的物质[87],理应引起更多关注和研究。
5.3 抑制群体感应
QS是生物被膜细胞间通讯和检测细胞密度的过程,主要发生在生物被膜形成的初始聚集阶段,细菌处于不利胁迫条件时,会通过QS系统发出信号,使细菌聚集并形成生物被膜[88]。针对QS通路的抑制可通过3种方式:阻断信号分子合成、防止信号分子与受体结合以及降解生成的信号分子。
5.3.1 阻断信号分子合成
信号分子合成使细胞能够监测环境和调控基因表达[89],阻断信号分子合成阻碍了细胞间和种间的交流。革兰氏阴性菌QS系统由酰基高丝氨酸内酯(N-acylhomoserine lactone,AHL)信号分子介导[90]。香豆素作用后导致编码信号分子的基因lasI、rhlI和pqsBCH下调,阻碍AHL分子合成和假单胞菌喹诺酮信号(Pseudomonasquinolone signal,PQS)系统反应,从而减少生物被膜形成。丁香酚与香豆素作用机理相似,通过下调las、rhl以及PQS的几个关键基因,影响铜绿假单胞菌的泳动能力和生物被膜形成[91]。另外,水杨酸也能通过与AHL生成所需的底物结合而干扰其形成AHL信号分子[92]。
5.3.2 防止信号分子与受体结合
信号分子转导亦会干扰QS系统影响生物被膜形成。在单增李斯特菌等革兰氏阳性菌中,QS信号分子分为寡肽自诱导因子和AI-2分子,其中AI-2分子是目前所知唯一能进行种内和种间交流的通用信号分子,单增李斯特菌生物被膜形成时的细胞通讯主要是通过响应功能性AI-2分子[93]。呋喃酮作为天然抗菌剂,对革兰氏阴性菌和革兰氏阳性菌的QS系统均具有破坏性。合成呋喃酮化合物能够干扰AI-2分子影响QS系统,抑制来源于食品、环境的单增李斯特菌早期生物被膜形成[94]。呋喃酮结构上与AHL相似,能够取代AHL与相应的LasR受体结合抑制QS系统[95]。
5.3.3 降解生成的信号分子
降解生成的QS信号分子使其不能达到参与生物被膜调节的阈值水平,能够削弱生物被膜的形成能力。研究表明,最低亚抑菌浓度的AL705细菌素能够使QS系统的信号分子失活,干扰QS,抑制生物被膜;另外,在生物被膜形成过程中所涉及的不同于AI-2的其他分子可能是细菌素的作用靶点[96]。
6 结 语
目前针对单增李斯特菌的研究关注点更多是聚焦在能否在接触表面上附着形成微菌落(也称生物被膜形成能力)以及在各种逆性环境下的存活能力和耐受性。但是,单增李斯特菌对人造成的潜在健康风险和经济损失,不仅取决于其在接触表面的生物被膜形成能力和对逆性环境的耐受性,还取决于单增李斯特菌生物被膜交叉污染转移到其他接触表面的可能性。在“农场到餐桌”的全食品链中,单增李斯特菌生物被膜交叉污染对食品安全造成的威胁是无法回避的问题,因此未来此领域的深入研究可从以下几方面展开:1)应深入研究即食食品经交叉污染途径被单增李斯特菌生物被膜污染后,生物被膜在即食食品上的生长、存活或转移情况。目前更多的研究是关注致病菌生物被膜从不同材质食品接触表面到无污染即食食品的转移。如将相关研究结果纳入定量风险评估中,能科学准确评估单增李斯特菌生物被膜危害,降低食源性疾病暴发风险;2)采用更恰当标准的取样和检测方法,将研究变量和取样方法标准化。未来研究单增李斯特菌生物被膜的危害时,在选取高风险食品基础上应结合食品的内在特征(pH值、水分活度、防腐剂、背景微生物群落)和贮藏方式(温度和货架期长短)等设计交叉污染场景研究转移过程,以获取更可靠的真实场景下定量转移数据,阐明单增李斯特菌生物被膜持久性污染原因;3)将毒力、代谢等多种信号转导途径和QS调控相结合探究单增李斯特菌生物被膜形成机制,对杀菌剂和消毒剂产生的抗性机制制定有针对性的防控生物被膜策略。生物被膜的形成过程不仅受细菌细胞所暴露的理化因素影响,还受复杂调控网络的调节。此外,在食品接触表面上存在的微生物具有高度多样性,这些其他微生物的存在可能会增强或减弱单增李斯特菌交叉污染的潜在转移。多角度探究生物被膜形成背后的复杂调控机制,对评估真实环境中单增李斯特菌生物被膜的种群动态变化和遗传学信息具有积极的影响。
