冻结及冻藏温度对小龙虾冻藏过程中脂质氧化的影响
2022-12-30杨海琦陈季旺田宏伟王海滨
杨海琦,陈季旺,徐 言,田宏伟,廖 鄂,3,4,王海滨,3,4
(1.武汉轻工大学食品科学与工程学院,湖北 武汉 430023;2.湖北周黑鸭食品工业园有限公司,湖北 武汉 430000;3.湖北省农产品加工与转化重点实验室,湖北 武汉 430023;4.国家小龙虾加工技术研发分中心(潜江),湖北 潜江 433100)
小龙虾养殖具有季节性和地域性,这严重影响了其加工生产和销售,因此,小龙虾需要更长的贮藏期(3个月以上)以延长加工和销售周期。冻藏能够最大程度地延缓水产品的品质变化,抑制微生物和酶的活性,延长水产品的贮藏期[1-3]。虽然小龙虾中的脂质含量较低,但是不饱和脂肪酸(unsaturated fatty acids,UFAs)含量高,在长期的冻藏过程中,这些脂质易发生氧化。脂质氧化不仅改变了小龙虾的风味,还会导致小龙虾色泽和质地的劣变[4-6]。
国内外有关冻藏水产品脂质氧化的报道较多,水产品中UFAs在较低的温度下能保持液体状态,受到冰晶挤压后更容易被转移到外界,与氧接触而发生氧化[7-9]。此外,冰晶可以在冻藏过程中挤压甚至破坏肌肉细胞,使其释放诱导脂质氧化的促氧化剂(游离铁等),加快脂质氧化[10-11]。傅宝尚等[12]研究冻藏条件(预熟制和直接冻藏)对鲍鱼腹足脂质变化的影响,通过水蒸气蒸馏法和气相色谱质谱联用仪测定硫代巴比妥酸反应物(thiobarbituric reactive substances,TBARS)值和游离脂肪酸(free fatty acids,FFAs)含量。结果显示,鲍鱼中的脂质氧化主要发生在冻藏时期,预熟制工艺较好地延缓了冻藏过程中脂质的氧化。徐坤华等[13]研究了蓝鳍金枪鱼的脂质和肌红蛋白在-18、-30、-40、-50 ℃冻藏温度下的氧化动力学,结果显示,随着冻藏温度的升高,TBARS值和高铁肌红蛋白的含量增加,且变化规律符合Arrhenius化学反应动力学方程。
目前,工业化生产中常采用液氮冻结或者鼓风冻结小龙虾原料及其制品。然而,冻结和冻藏温度的选择通常依靠经验判断,造成了不同批次产品风味、质构、色泽等品质的不稳定。本课题组前期研究发现,冻结及冻藏温度显著影响了小龙虾冻藏过程中的品质和蛋白质的理化性质,但有关冻结温度、冻藏温度如何影响冻藏小龙虾脂质氧化的研究目前鲜见报道。因此,本研究测定经不同温度冻结和冻藏小龙虾肉的脂肪、FFAs含量、脂肪酸组成以及过氧化值(peroxide value,POV)和TBARS值,分析小龙虾冻藏过程中的脂质氧化规律,探讨冻结及冻藏温度对小龙虾脂质氧化的影响,以期为小龙虾加工原料的周年供应提供理论指导。
1 材料与方法
1.1 材料与试剂
鲜活小龙虾 湖北周黑鸭食品工业园有限公司提供。
石油醚、三氯乙酸、三氯甲烷、冰乙酸、碘化钾、甲苯、吡啶乙酸铜、正丁醇、甲醇(均为分析纯)和正己烷(色谱纯) 国药集团化学试剂有限公司;0.01 mol/L硫代硫酸钠、三氟化硼-甲醇溶液 上海源叶生物科技有限公司。
1.2 仪器与设备
DW-60W388超低温冰柜 青岛海尔生物医疗有限公司;S2F-06C脂肪测定仪 浙江托普仪器有限公司;XHF-DY高速分散器 宁波新芝生物科技有限公司;7200型可见光分光光度计 上海尤尼柯仪器有限公司;FD-1-50真空冷冻干燥机 北京博医康实验仪器有限公司;7890B气相色谱-质谱仪 美国安捷伦公司。
1.3 方法
1.3.1 冻藏小龙虾的制备
将大小均一(约10~15 g)的鲜活小龙虾用自来水冲洗,超声波清洗(水的添加量以覆盖虾体为准)20 min,然后放入沸水中热烫1 min,装盒(每盒1 kg小龙虾),盒中灌入清水(水的添加量以覆盖虾体为准)后抽成真空。盒装小龙虾分别置于-20、-40、-55 ℃冰柜中冻结至中心温度为-15 ℃。将冻好的虾随机分为两组,分别置于-20 ℃和-40 ℃冰柜中冻藏,冻藏周期为24 周,每6 周取样用于检测。每次随机取约1 kg小龙虾,使用流动水解冻。取虾肉时去除头、壳和肠线,虾肉置于-55 ℃冷柜中放置3 h,使水分冻结成冰后放入真空冷冻干燥机中,-55 ℃、30 kPa冷冻干燥后粉碎,置于真空袋中,抽真空封口备用。
1.3.2 脂肪质量分数的测定
参照GB 5009.6—2016《食品安全国家标准 食品中脂肪的测定》[14]的索氏抽提法测定脂肪质量分数。取3 g冻干虾肉粉移入滤纸筒中,滤纸筒两端塞入脱脂棉,并用脱脂棉线将滤纸筒固定。将滤纸筒置于索氏抽提器内的抽提筒中,然后将抽提筒放进接收瓶(已烘干至恒质量)内。接收瓶内加入瓶容积2/3左右的石油醚,水浴加热(60 ℃),使石油醚不断回流并抽提脂肪,抽提时间3.5 h。提取结束时,用磨砂玻璃棒蘸取一滴提取液,若无油斑则表明提取完毕。取下接收瓶,等瓶内溶剂蒸发至剩余1~2 mL后,于60 ℃水浴加热0.5 h,蒸发接收瓶内多余的石油醚。蒸发完全后置于105 ℃烘箱中干燥1 h,干燥器内冷却至室温(25 ℃)后称量。脂肪质量分数按公式(1)计算。

式中:ω为虾肉中的脂肪质量分数/%;m1为恒质量的接收瓶和脂肪质量/g;m0为接收瓶的质量/g;m2为虾肉粉的质量/g。
1.3.3 总脂质的提取
采用Folch法提取总脂质[15]。将20 g虾肉粉用200 mL三氯甲烷-甲醇(2∶1,V/V)溶解,匀浆至分散后,室温(25 ℃)下用磁力搅拌器将整个混合物搅拌20 min。过滤匀浆物,收集过滤液。在过滤液中加入一定量的去离子水(每20 mL过滤液加4 mL水),涡旋10 s,离心(5 000 r/min)混合物至分离成两相。用甲醇-水(1∶1,V/V)溶液冲洗两液交界面2 次,注意不要冲洗到下层液相。将混合液移入分液漏斗中,静置分层3 h,取下层液相,在旋转蒸发器中蒸发含有脂质的下层氯仿相,即得到脂质。
1.3.4 FFAs含量的测定
参照Lowry等[16]的方法测定FFAs含量。称取0.1 g脂质,溶于5 mL甲苯中,然后加入1 mL吡啶乙酸铜溶液(质量分数5%,pH 6.0),振荡2 min。混合液于室温(25 ℃)下3 000 r/min离心5 min,测定上清液在715 nm波长处的吸光度。FFAs含量用每100 g脂质中FFAs的质量表示。
1.3.5 脂肪酸组成的测定
脂肪酸组成的测定参考文献[17]的方法。
样品甲酯化:称取30 mg脂质,氮气吹扫,加入1 mL 2 mol/L NaOH-甲醇溶液,混合均匀后于60 ℃水浴保温2 min,再加入1 mL 2 mol/L三氟化硼-甲醇溶液,混匀后于水浴中继续放置5 min,取出,于室温(25 ℃)下加入2 mL正己烷,振荡摇匀后静置。待分层后取含脂肪酸甲酯的上层正己烷,加入一定量无水硫酸钠脱除水分,使用0.22 μm孔径的有机相滤膜过滤后进行气相色谱-质谱分析,进样量1 μL。
色谱条件:分析柱为HP-5MS(30 cm×0.25 mm,0.25 μm),高纯氦气为载气,采用恒压模式,压力为16 psi。进样口温度为250 ℃,检测器温度为150 ℃,柱温以2 ℃/min由150 ℃上升到210 ℃,并且于210 ℃下保持15 min,整个分析过程为45 min。
质谱条件:接口温度280 ℃,电子电离离子源,电离能量70 eV,离子源温度230 ℃,扫描周期2.84 次/s,质量扫描范围m/z50~500。
1.3.6 POV的测定
参照GB 5009.227—2016《食品安全国家标准 食品中过氧化值的测定》[18]中的滴定法测定POV。称取3 g脂质,置于250 mL碘量瓶中,加入30 mL三氯甲烷-冰乙酸混合液,轻轻振摇使脂质完全溶解。准确加入1 mL饱和碘化钾溶液,塞紧瓶盖,并轻轻振摇0.5 min,在暗处放置3 min。取出加100 mL水,摇匀后立即用0.01 mol/L硫代硫酸钠标准液滴定析出的碘,滴定至淡黄色时,加1 mL淀粉指示剂,继续滴定并强烈振摇至溶液蓝色消失为终点。同时进行空白实验,空白实验所消耗0.01 mo1/L硫代硫酸钠溶液体积不得超过0.1 mL。POV按公式(2)计算。
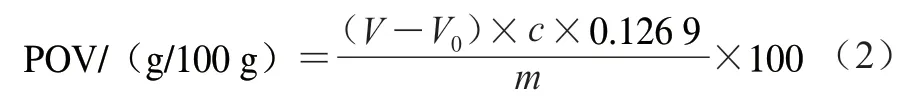
式中:V为脂质消耗的硫代硫酸钠标准溶液体积/mL;V0为空白消耗的硫代硫酸钠标准溶液体积/mL;c为硫代硫酸钠标准溶液浓度/(mol/L);m为脂质质量/g。
1.3.7 TBARS值的测定
参照李学英等[19]的方法。取3 g搅碎的虾肉,加入15 mL质量分数为7.5%的三氯乙酸溶液(含0.1%乙二胺四乙酸),均质1 min后过滤。取5 mL过滤液加入5 mL 0.02 mol/L硫代巴比妥酸溶液,沸水浴加热20 min,混合物冷却至室温(25 ℃)后离心,得到上清液。上清液中加入5 mL质量分数为7.5%的三氯甲烷溶液涡旋混匀,静置分层,取上清液。用分光光度计分别测定532 nm和600 nm波长处的吸光度。TBARS值按公式(3)计算。
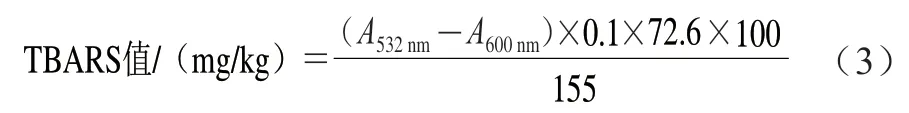
式中:A532nm为在532 nm波长处测得的吸光度;A600nm为在600 nm波长处测得的吸光度。
1.4 数据处理与分析
每组数据重复测定3 次,结果用平均值±标准差表示。应用SPSS软件对数据进行统计分析,采用方差分析、Duncan多重极差检验比较平均值的差异显著性,P<0.05判定为差异显著。
2 结果与分析
2.1 小龙虾冻藏过程中脂肪含量的变化
水产品冻藏过程中脂肪含量的变化受自身氧化或被酶水解的影响,金属催化剂和其他促氧化因子都可以加快氧化过程[20]。由表1可以看出,6 组小龙虾肉的脂肪含量随着冻藏时间的延长均呈先下降然后趋于稳定的趋势,且第24周较第12周脂肪含量显著下降。这是因为冻藏过程中冰晶体积增大,破坏了细胞膜结构,使得膜上的非血红素铁被释放、氧自由基转化成羟自由基,加快了脂质氧化的发生[21]。

表1 小龙虾冻藏过程中脂肪质量分数的变化Table 1 Changes in fat content of red swamp crayfish during frozen storage %
冻藏温度相同时,冻结温度对小龙虾肉中脂肪质量分数的影响不显著(P>0.05);冻结温度相同时,在第18~24周,-40 ℃冻藏小龙虾肉中的脂肪质量分数显著高于-20 ℃组(P<0.05)。这是因为小龙虾在-20 ℃冻藏过程中更容易发生重结晶,更严重地破坏了肌肉细胞膜,释放出更多的非血红素铁,促进脂肪氧化。同时,由于包装盒内的真空度较低,小龙虾肉与空气接触可能发生自动氧化,-20 ℃冻藏温度较高,自动氧化速度较快,导致脂肪含量较低[4-5]。此外,-40 ℃冻藏温度可能更好地抑制了虾肉中脂肪酶的作用,降低了脂肪被水解的程度[22]。
2.2 小龙虾冻藏过程中FFAs含量的变化
脂质的水解程度是评价小龙虾品质劣变程度的常用指标,FFAs是脂质被酯酶水解或者化学水解的产物,通过测定FFAs含量可以反映脂质的水解程度[23]。由图1可以看出,6 组小龙虾肉的FFAs含量随冻藏时间的延长逐渐增加(P<0.05),可能是随着冰晶体积的增大,破坏了肌肉细胞,释放的脂质被酯酶水解,导致FFAs含量增加[24]。同时,在第12~24周FFAs含量较高(P<0.05),导致脂质更快的氧化酸败。这与脂肪含量在第12~24周显著减少相印证(P<0.05)。
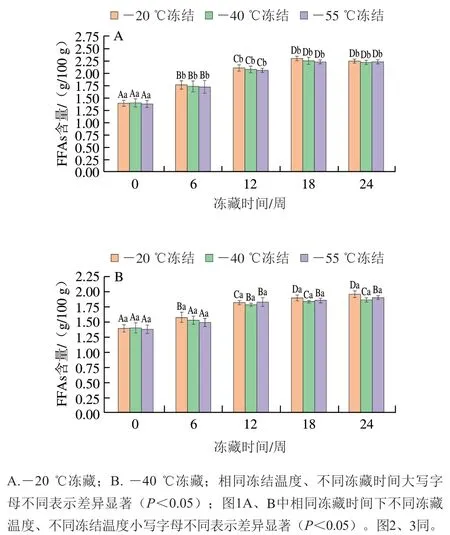
图1 小龙虾冻藏过程中FFAs含量的变化Fig. 1 Changes in FFAs contents of red swamp crayfish during frozen storage
冻藏温度相同时,冻结温度对FFAs含量的影响不显著(P>0.05);冻结温度相同时,-40 ℃的冻藏温度相较-20 ℃明显降低了FFAs含量。这与武华等[25]的研究结果类似,-40 ℃冻藏更好地抑制了小龙虾中酯酶的活性,降低了脂质被酶水解的程度。
2.3 小龙虾冻藏过程中脂肪酸组成的变化
小龙虾冻藏过程中脂肪酸组成的变化见表2~4。小龙虾肉中被检测出的脂肪酸合计13种,可分为饱和脂肪酸(saturated fatty acids,SFAs)和UFAs两类,其中UFAs又可以分为单不饱和脂肪酸(monounsaturated fatty acids,MUFAs)和多不饱和脂肪酸(polyunsaturated fatty acids,PUFAs)。小龙虾肉中,UFAs含量较多,SFAs含量较少,且PUFAs含量高于MUFAs含量。脂质的氧化速率与组成脂质的脂肪酸不饱和度、双键位置和构型有关,共轭双键数目越多,氧化速度越快[26]。UFAs含量较高,脂质氧化速度加快,这也是小龙虾肉脂肪含量在冻藏期间显著下降的原因之一。
随冻藏时间的延长,6 组小龙虾肉中的SFAs相对含量显著上升(P<0.05),UFAs和PUFAs相对含量显著下降(P<0.05),同时MUFAs相对含量变化不显著(P>0.05),说明在整个冻藏周期里,主要发生氧化的是PUFAs。
在所有的脂肪酸中,油酸(C18:1n9)、二十碳五稀酸(C20:5n3)和棕榈酸(C16:0)相对含量较高。油酸(C18:1n9)是MUFA的一种,在整个冻藏周期内,油酸相对含量变化不显著(P>0.05)。MUFAs不含共轭双键,被氧化需要接触更多氧,而小龙虾经过液封并抽真空处理,冻藏过程中可接触的氧较少,所以MUFAs相对含量总体无显著变化(P>0.05);二十碳五稀酸(C20:5n3)是PUFAs的一种,随着冻藏时间的延长其相对含量显著下降(P<0.05)。这可能是PUFAs所含共轭双键较多,在冻藏过程中易被氧化。Oh[27]和Sover[28]等均报道冻藏过程中的蛋白质变性会导致一部分非血红素铁被释放出来,可能促进脂肪酸氧化。因此,蛋白质变性可能也是PUFAs不断被氧化而减少的原因;棕榈酸(C16:0)是一种SFA,随着冻藏时间的延长其相对含量逐渐增加。脂质在酯酶的作用下水解产生SFAs,SFAs较稳定[24],因此在小龙虾肉中的相对含量逐渐增加。
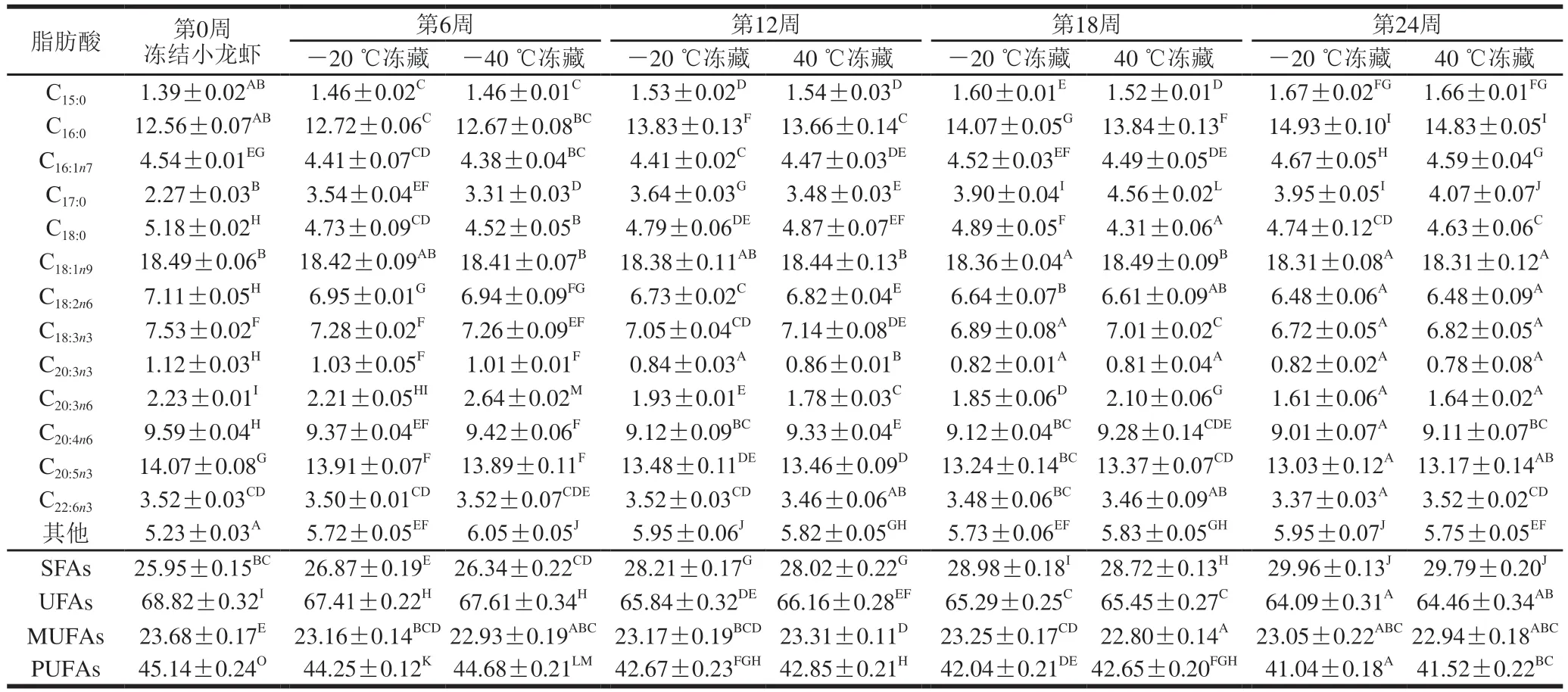
表2 -20 ℃冻结的小龙虾冻藏过程中脂肪酸组成的变化Table 2 Changes in fatty acid composition of red swamp crayfish frozen at -20 ℃ during frozen storage %

表3 -40 ℃冻结的小龙虾冻藏过程中脂肪酸组成的变化Table 3 Changes in fatty acid composition of red swamp crayfish frozen at –40 ℃ during frozen storage %
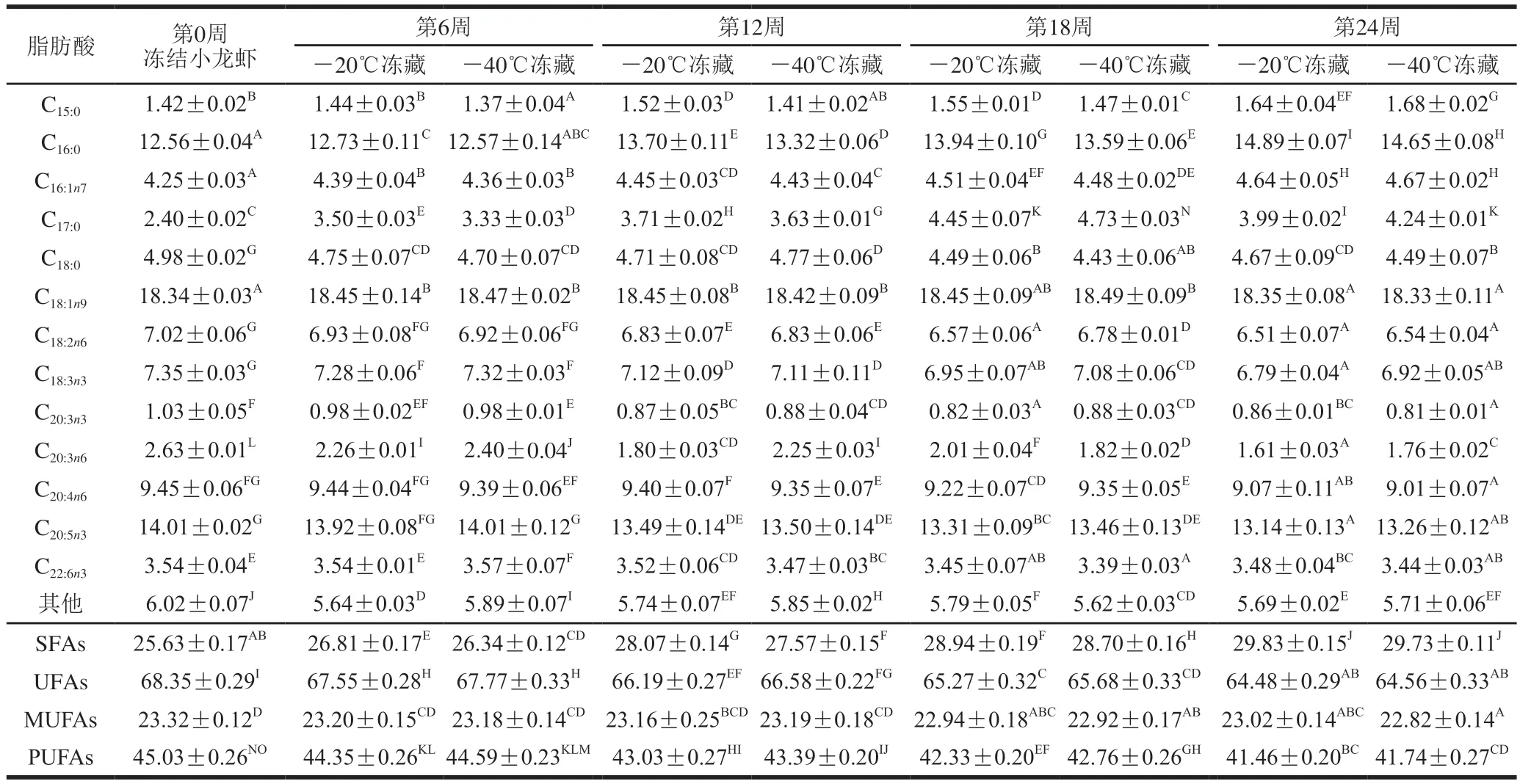
表4 -55 ℃冻结的小龙虾冻藏过程中脂肪酸组成的变化Table 4 Changes in fatty acid composition of red swamp crayfish frozen at –55 ℃ during frozen storage %
冻藏温度相同时,冻结温度对小龙虾肉的脂肪酸组成有轻微影响;冻结温度相同时,冻藏温度对脂肪酸组成有明显影响。显微结构观察发现,-20 ℃冻藏的小龙虾中形成的冰晶较大(图未显示),对肌原纤维蛋白的破坏程度较高,释放出的非血红素铁促进了游离脂肪酸的氧化。同时,-20 ℃冻藏提高了脂质的自动氧化速度,加重了脂质的氧化程度[4-5],导致-20 ℃冻藏小龙虾的PUFAs含量低于-40 ℃冻藏。
2.4 小龙虾冻藏过程中POV的变化
POV代表脂质初级氧化产物的含量。由图2可以看出,6 组小龙虾肉POV随冻藏时间的延长呈显著上升趋势(P<0.05)。这是因为小龙虾肉中UFAs含量较高,共轭双键数目较多,氧化速度较快[29]。
冻藏温度相同时,-20 ℃冻结的小龙虾肉POV总体高于-40 ℃和-55 ℃。这是因为较高的冻结温度会形成更大的冰晶,这些冰晶挤压虾肉细胞,使其形变甚至破裂,造成促氧化剂和脂质等流出,加快了脂质氧化的速度,导致POV更高[29];冻结温度相同时,-40 ℃冻藏的小龙虾肉的POV明显低于-20 ℃组。这可能由两种原因造成:一是-40 ℃冻藏小龙虾的冰晶增大速度较慢,使得冰晶在整个冻藏周期内均小于-20 ℃冻藏组,冰晶越小,破坏的虾肉细胞越少,减少了促氧化剂和脂质等的流出;二是-40 ℃冻藏降低了脂质自动氧化的速度,减轻了脂质被氧化的程度。
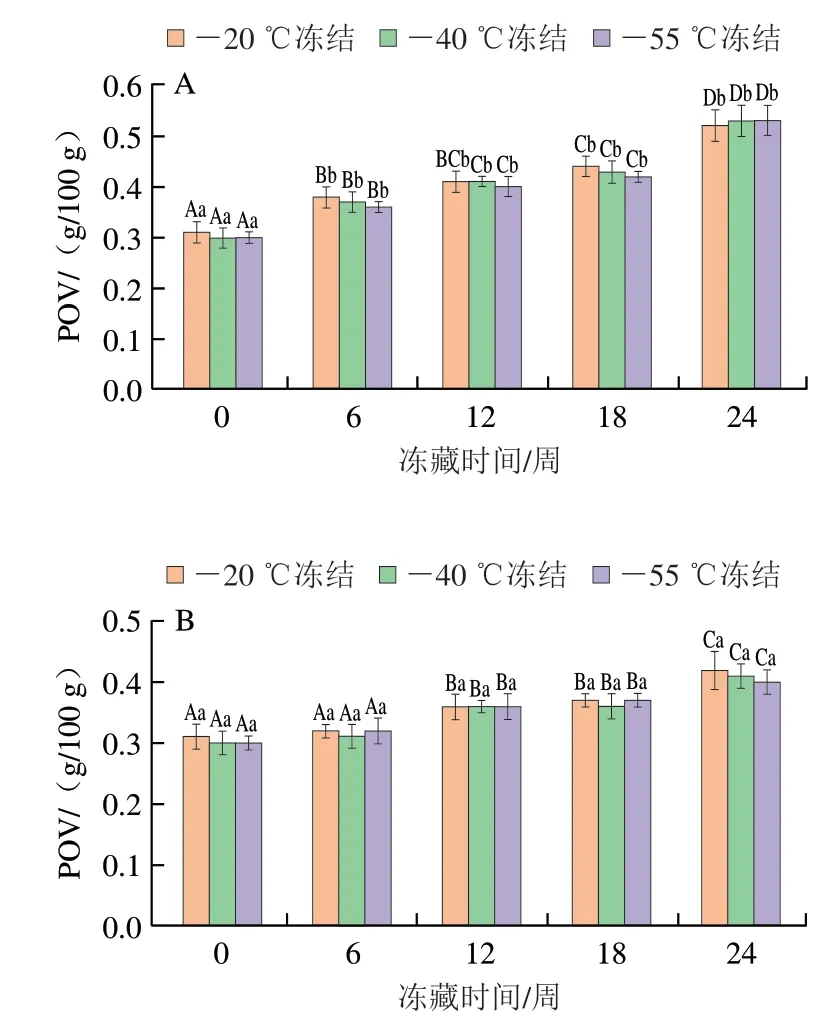
图2 小龙虾冻藏过程中POV的变化Fig. 2 Changes in POV of red swamp crawfish during frozen storage
2.5 小龙虾冻藏过程中TBARS值的变化
TBARS值代表小龙虾脂质氧化次级产物的含量。由图3可以看出,小龙虾肉的TBARS值随冻藏时间的延长总体呈显著上升的趋势(P<0.05)。这与林二妹[30]报道的结果类似,可能是小龙虾肉脂质氧化的初级产物不断降解生成丙二醛所致。
冻藏温度相同时,冻结温度对TBARS值的影响总体不显著(P>0.05);冻结温度相同时,在冻藏前期,-20 ℃冻藏小龙虾肉的TBARS值略高于-40 ℃冻藏组;冻藏至第24周时,-20 ℃冻藏小龙虾肉的TBARS值略高于-40 ℃冻藏组,可能是冻藏温度-40 ℃较-20 ℃更好地抑制了脂质的自动氧化[31-32]。这个结果与脂肪和FFAs含量、脂肪酸组成及POV的变化趋势类似,进一步说明了较低的冻结及冻藏温度抑制了脂质的水解,减轻了冻藏过程中脂质的氧化。
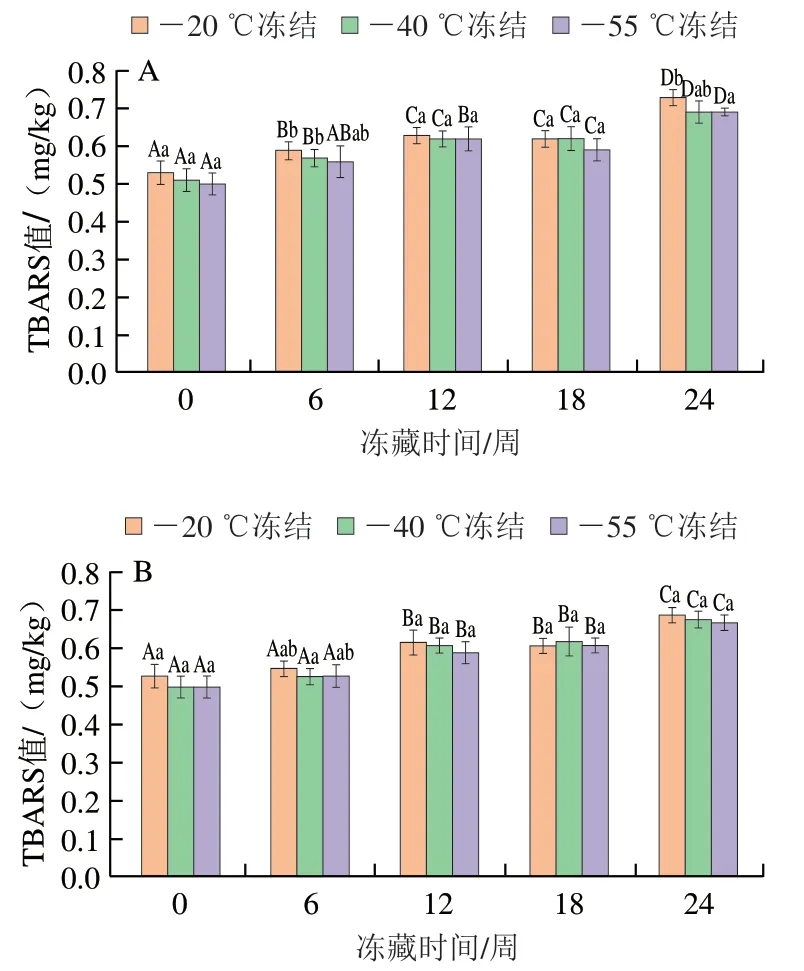
图3 小龙虾冻藏过程中TBARS值的变化Fig. 3 Changes in TBARS values of red swamp crayfish during frozen storage
3 结 论
-40 ℃和-55 ℃冻结的小龙虾肉中形成的冰晶较小,对肌肉细胞的破坏程度较轻,减少了促氧化剂和脂质等的释放,抑制了脂质的水解和氧化;-40 ℃冻藏更好地抑制了重结晶及虾肉中酯酶的活性,减轻了对小龙虾肌肉细胞的损伤,减缓了脂质的水解速率。同时,-40 ℃冻藏减缓了脂质自动氧化的速率。因此,较低的冻结及冻藏温度减轻了冻藏过程小龙虾肉中脂质的氧化程度。在-20~-55 ℃区间,低温加快了冻结速率,但并非选择更低的冻结温度能使小龙虾达到更佳的贮藏效果,而较低的冻藏温度(-40 ℃)更好地抑制了小龙虾冻藏过程中的脂质氧化。该研究结果可为小龙虾加工原料的周年供应提供科学指导。
