4种迷迭香化合物对脂多糖诱导的RAW264.7细胞氧化应激和炎症的抑制作用
2022-12-30丁芷倩RAKARifatNowshin魏梦雅王开阳肖俊松
丁芷倩,许 敏,吴 华,RAKA Rifat Nowshin,魏梦雅,王开阳,肖俊松,*
(1.北京工商大学食品与健康学院,北京 100048;2.中国轻工业酿酒分子工程重点实验室,北京 100048;3.北京市食品添加剂工程技术研究中心,北京 100048)
迷迭香(Rosmarinus officinalisL.)是一种原产于地中海地区的多年生木本香料植物,属于唇形科迷迭香属,具有多种药用价值[1-2],在食品工业中常被用作植物性天然防腐剂及调味品,在世界各地均有栽培[3-4]。迷迭香有良好的抗氧化和缓解炎症功效,主要功能成分为鼠尾草酸(carnosic acid,CA)、鼠尾草酚(carnosol,CS)、迷迭香酚(rosmanol,RS)和迷迭香酸(rosmarinic acid,RA)等化合物[5-8],有研究表明RA在20 μmol/L浓度以上时才能发挥一定的生物活性[9]。CA、CS、RS和RA的化学结构如图1所示,这些功能成分能直接和肠道部位的免疫相关细胞接触,有可能缓解肠道部位的炎症,清除活性氧(reactive oxygen species,ROS)。
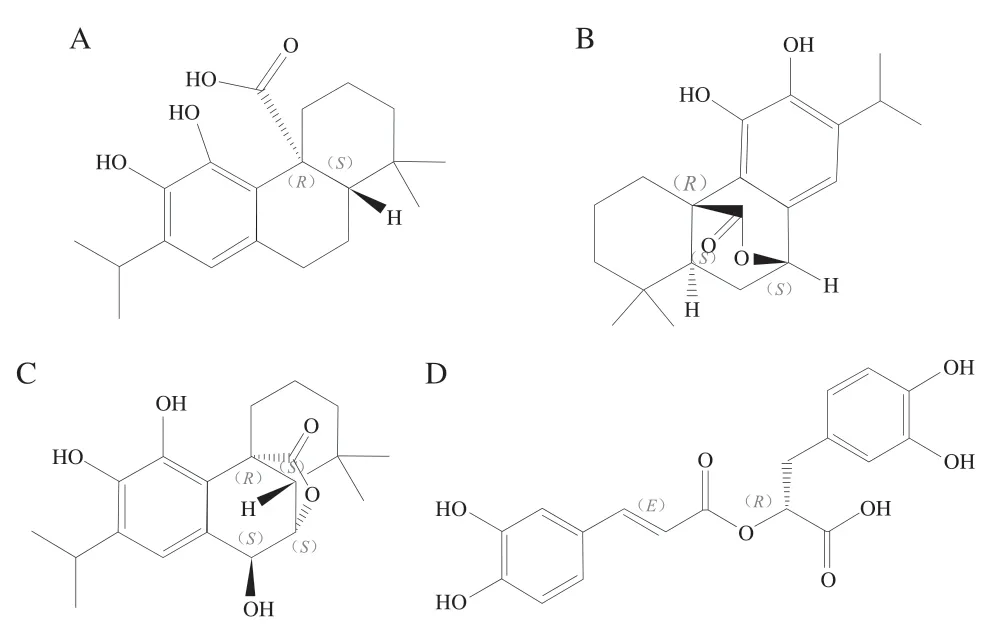
图1 CA(A)、CS(B)、RS(C)和RA(D)的化学结构式Fig. 1 Structures of CA (A), CS (B), RS (C) and RA (D)
机体在受到各种可能的有害刺激时会产生大量的ROS,过量产生的ROS会降低内源性抗氧化酶的活性,如超氧化物歧化酶(superoxide dismutase,SOD)和过氧化氢酶(catalase,CAT)等[10]。过量ROS还会破坏细胞膜结构,引起脂质过氧化,导致胞内丙二醛(malonic dialdehyde,MDA)含量增加[11]。
氧化应激与炎症密切相关[12]。Toll样受体4(tolllike receptor 4,TLR4)是一类关键的病原模式识别受体,可以识别革兰氏阴性细菌细胞壁成分脂多糖(lipopolysaccharide,LPS)[13]。当LPS刺激时,机体会产生大量的自由基,导致线粒体中ROS积累,激活NOD样受体蛋白3(NOD-like receptor protein,NLRP3)炎症小体,促进白细胞介素(interleukin,IL)-1β释放[14];或激活核因子κB(nuclear factor κB,NF-κB)信号通路,增加IL-6、肿瘤坏死因子(tumor necrosis factor,TNF)-α[15]、诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)、环氧合酶2(cyclooxygenase 2,COX-2)和一氧化氮(nitric oxide,NO)的表达[16]。LPS刺激RAW264.7巨噬细胞能产生炎症反应,是一种常用的体外细胞炎症模型[17]。
迷迭香化合物可能通过抑制机体产生大量自由基,增加抗氧化酶活力,抑制NLRP3炎症小体和NF-κB信号通路激活,降低促炎因子的产生,进而发挥其抗氧化和抗炎作用。为了系统准确地评价迷迭香化合物发挥抗氧化、抗炎的作用及其机制,本研究选用LPS刺激RAW264.7细胞建立体外炎症模型,从分子水平比较上述4种迷迭香化合物的抗氧化及抗炎作用,从而为迷迭香的功能性食品开发研究提供理论依据。
1 材料与方法
1.1 材料与试剂
RAW264.7细胞 中国科学院干细胞库;DMEM培养液、胎牛血清、谷氨酰胺和丙酮酸钠 美国Gibco公司;CA、CS、RS和RA(均为色谱级,纯度≥98%) 上海源叶生物科技有限公司;LPS、2’,7’-二氯二氢荧光素二乙酸酯(2’,7’-dichlorofluorescin-diacetate,DCFH-DA)、二甲基亚砜(dimethyl sulfoxide,DMSO)美国Sigma公司;总NO、总SOD活力、CAT活力检测试剂盒 上海碧云天生物技术有限公司;蛋白提取试剂盒、BCA蛋白定量试剂盒 南京建成生物技术研究所有限公司;RNA提取试剂盒 北京全式金生物技术有限公司;逆转录试剂盒、SYBR Green Realtime PCR Master Mix试剂盒 上海东洋纺生物科技有限公司;聚合酶链式反应(polymerase chain reaction,PCR)引物 生工生物工程(上海)股份有限公司;小鼠抗β-actin抗体、小鼠抗iNOS抗体、小鼠抗COX-2抗体、辣根过氧化物酶标记的兔抗鼠二抗 美国Cell Signaling Technology公司;ECL化学发光液 北京原平皓生物技术有限公司。
1.2 仪器与设备
KJ201A型微量振荡器 上海启前电子科技有限公司;ME403型电子天平 美国梅特勒托利多集团;80-1型低温离心机 德国希格玛公司;Infinite M200 Pro 型多功能酶标仪 瑞士帝肯集团公司;Q5000型微量紫外分光光度计 美国Quawell技术公司;CFX96型荧光定量PCR仪 上海伯乐生命医学产品有限公司;FMB40型制冰机 无锡沃信仪器公司;BE-9008型微孔板恒温振荡器 苏州江东精密仪器有限公司;VE-180微型垂直电泳槽、VE-186转移电泳槽、Tanon5200型显影仪 北京原平皓生物技术有限公司;TDK-2型水平摇床 北京鼎国生物技术公司;CX31-12C03型光学倒置显微镜日本奥林巴斯公司。
1.3 方法
1.3.1 细胞培养与分组
将RAW264.7细胞置于25 cm2细胞培养瓶中,标记代数和日期,细胞培养液由88% DMEM培养液、1%丙酮酸钠、1%谷氨酰胺和10%胎牛血清组成,细胞于37 ℃、5% CO2、饱和湿度的培养箱内培养,每隔24 h利用倒置显微镜观察细胞形态及密度,当细胞形态正常且密度达到80%以上时吸去培养液,用pH 7.4的0.01 mol/L磷酸盐缓冲液(phosphate buffered saline,PBS)轻柔冲洗一次,弃液,加入1 mL胰蛋白酶消化2 min,进行传代培养。将处于对数生长期的细胞[18]接种于培养板中进行分组,空白组:不接种细胞,不加CA、CS、RS、RA和LPS干预处理;对照组:接种细胞,不加CA、CS、RS、RA和LPS干预处理;实验组:接种细胞,分别加入终质量浓度1~10 μg/mL CA、CS、RS和终质量浓度1~100 μg/mL的RA与质量浓度1 μg/mL的LPS共孵育或加入终质量浓度1 μg/mL的LPS孵育。
1.3.2 细胞活力检测
采用四甲基偶氮唑盐(3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide,MTT)法检测细胞活力[19]。首先对CA、CS、RS和RA进行最佳浓度的筛选,然后在相应质量浓度范围内检测CA、CS、RS和RA对LPS诱导的RAW264.7细胞活力的影响。选取对数生长期的细胞,以2×105cells/mL的密度接种于96 孔板中,在CA、CS、RS和RA最佳浓度的选择实验中,对照组:接种细胞,不加CA、CS、RS和RA干预处理;实验组:接种细胞,分别加入质量浓度1~20 μg/mL CA、CS、RS和质量浓度1~100 μg/mL的RA。在4种化合物对LPS诱导RAW264.7细胞活力的影响实验中,对照组:接种细胞,不加CA、CS、RS、RA和LPS干预处理;实验组:接种细胞,加入质量浓度1 μg/mL的LPS以及分别与质量浓度1~10 μg/mL CA、CS、RS和质量浓度10~100 μg/mL的RA共处理细胞。于培养箱中孵育24 h后,弃去上清液,每孔加入100 μL新鲜细胞培养液和10 μL MTT,于培养箱中孵育4 h后,弃液,每孔加入150 μL DMSO,于培养箱中孵育15 min后,利用酶标仪在波长570 nm处测定吸光度A,按式(1)计算细胞存活率。

1.3.3 细胞内ROS相对含量的测定
利用DCFH-DA法测定CA、CS、RS和RA对LPS诱导的RAW264.7细胞内ROS水平。选取对数生长期的细胞,以2×105cells/mL的密度接种于96 孔板中,按照1.3.1节分组方法处理细胞,于培养箱中孵育24 h后,弃去培养液,加入终浓度10 μmol/L的DCFH-DA试剂,于培养箱中反应30 min,弃液。加入100 μL PBS洗去未结合的DCFH-DA,再加入100 μL细胞培养液,采用多功能酶标仪于激发波长485 nm和发射波长530 nm条件下测定荧光强度,按式(2)计算ROS相对含量。

1.3.4 NO释放量的测定
利用Greiss法测定CA、CS、RS和RA对LPS诱导RAW264.7细胞释放NO的含量[20]。选取对数生长期的RAW264.7细胞,以2×105cells/mL的密度接种于96 孔板中,按照1.3.1节分组方法处理细胞,于培养箱中孵育24 h后,取细胞培养液于1 000×g离心5 min,收集上清液。向待测上清液中加入等体积的Griess Reagent I和Griess Reagent II于室温下孵育10 min,利用酶标仪在波长540 nm处测定各孔吸光度,以NaNO2作为标准品用细胞培养液分别稀释至浓度为10、20、40、60、80 μmol/L,在与细胞上清液同样处理条件下,以NaNO2浓度为横坐标、吸光度为纵坐标绘制标准曲线y=0.005 2x-0.014 3,根据标准曲线方程计算得到NO释放量。
1.3.5 SOD、CAT活力和MDA含量测定
利用水溶性四唑盐-8(2-(2-methoxy-4-nitrophenyl)-3-(4-nitrophenyl)-5-(2,4-disulfophenyl)-2H-tetrazolium,WST-8)法、可见显色法和硫代巴比妥酸反应物(thiobarbituric acid reactive substances,TBARS)比色法分别测定CA、CS、RS和RA对LPS诱导的RAW264.7细胞SOD、CAT活力和MDA含量的影响。将处于对数生长期的RAW264.7细胞以5×105cells/mL的密度接种于6 cm培养皿中,按照1.3.1节分组方法处理细胞,于培养箱内孵育24 h后,弃去培养液,重新加入1 mL PBS用细胞刮板刮下细胞并收集至1.5 mL的离心管中,根据试剂盒说明书提取蛋白并采用BCA蛋白定量试剂盒检测蛋白浓度。
按SOD活力检测试剂盒说明书在96 孔板中进行如下操作:样品组中加入20 μL蛋白样品、160 μL WST-8/酶工作液和20 μL反应启动工作液;空白1组中加入20 μL SOD检测缓冲液、160 μL WST-8/酶工作液和20 μL反应启动工作液;空白2组中加入40 μL SOD检测缓冲液、160 μL WST-8/酶工作液和20 μL反应启动工作液;空白3组中加入20 μL蛋白样品、20 μL SOD检测缓冲液、160 μL WST-8/酶工作液和20 μL反应启动工作液;各组于37 ℃孵育30 min,利用酶标仪在波长450 nm处测定各孔的吸光度,按式(3)、(4)计算SOD活力。
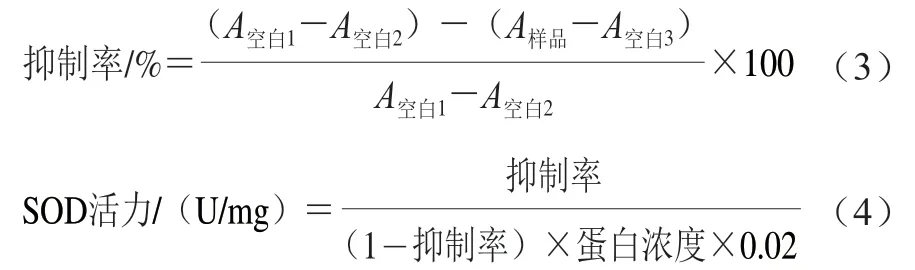
按CAT活力检测试剂盒说明书进行如下操作:取1 μL蛋白样品,加入39 μL CAT检测缓冲液和10 μL 250 mmol/L过氧化氢溶液,反应5 min,加入450 μL CAT反应终止液,混匀。取10 μL上述终止反应的体系于新离心管中,加入40 μL CAT检测缓冲液,混匀,取10 μL于96 孔板中加入200 μL显色工作液,25 ℃孵育30 min,利用酶标仪在波长520 nm处测定其吸光度。取0、12.5、25、50、75 μL的标准品过氧化氢溶液,加入CAT检测缓冲液至终体积为100 μL,各取4 μL于96 孔板中,在与样品同样处理条件下,以标准品溶液浓度为横坐标、吸光度为纵坐标绘制标准曲线y=69.75x-0.099 3,根据标准曲线方程计算得到CAT活力。
按MDA检测试剂盒说明书进行如下操作:取100 μL蛋白样品,加入200 μL MDA检测工作液,于100 ℃水浴15 min后冷却至室温,1 000×g离心10 min,取200 μL上清于96 孔板中,利用酶标仪在波长532 nm处测定各孔的吸光度。将试剂盒中的标准品用蒸馏水分别稀释至浓度为1、2、5、10、20、50 μmol/L,在与样品同样处理条件下,以标准品溶液浓度为横坐标、吸光度为纵坐标绘制标准曲线y=0.533 6x+0.101 0,通过标准曲线方程计算得到MDA含量。
1.3.6TNF-α、IL-6、IL-1βmRNA相对表达量测定
利用实时荧光定量PCR法,以β-actin为内参基因,测定CA、CS、RS和RA对LPS诱导的RAW264.7细胞中TNF-α、IL-6、IL-1βmRNA相对水平的影响。将处于对数生长期的RAW264.7细胞以5×105cells/mL的密度接种于6 cm培养皿中,按照1.3.1节分组方法处理细胞,于培养箱内孵育24 h后,弃去培养液,加入1 mL TRIzol试剂裂解细胞并收集至1.5 mL无RNA酶离心管中,按照试剂盒说明书分别进行样品RNA提取、逆转录和定量检测,采用2-ΔΔCt法计算TNF-α、IL-6、IL-1βmRNA的相对表达量,ΔΔCt=(Ct目的基因-Ctβ-actin)实验组-(Ct目的基因-Ctβ-actin)对照组[21]。各指标引物信息见表1。

表1 实时荧光定量PCR引物序列Table 1 Primer sequences used for RT-qPCR
1.3.7 iNOS、COX-2蛋白相对含量测定
利用Western blot法测定CA、CS、RS和RA对LPS诱导的RAW264.7细胞中iNOS、COX-2蛋白的相对含量,参照Han等[22]的方法略有改动,将处于对数生长期的RAW264.7细胞以5×105cells/mL的密度接种于6 cm培养皿中,按照1.3.1节分组方法处理细胞,于培养箱内孵育24 h后,弃去培养液,重新加入1 mL PBS用细胞刮板刮下细胞并收集至1.5 mL离心管中。利用试剂盒提取蛋白并检测蛋白浓度,配制10%的分离胶和浓缩胶,上样,恒压100、120 V电泳各40 min,湿法转膜,5%脱脂奶粉4 ℃封闭1 h,一抗4 ℃孵育过夜,二抗室温孵育1 h,在膜上滴加超敏化学发光染料底物,反应1 min后开始曝光显影。采用凝胶成像系统分析目标蛋白的净光密度值,以β-actin为内参蛋白,目标蛋白的相对表达量=目标蛋白的净光密度值/β-actin的净光密度值[23]。
1.4 数据处理与分析
实验数据用Excel做初步整理,然后用SPSS Statistics软件进行统计学分析。通过单因素方差分析对多组数据之间的差异进行显著性检验,P<0.05为差异显著,实验数据用平均值±标准差表示,最后利用Origin 2019b软件进行绘图。
2 结果与分析
2.1 CA、CS、RS和RA最佳浓度的选择及对LPS诱导RAW264.7细胞活力的影响
采用MTT法检测CA、CS、RS和RA对RAW264.7细胞活力的影响,结果如图2所示。由图2A~C可以看出,质量浓度1~10 μg/mL的CA、CS和RS处理RAW264.7细胞24 h后,细胞存活率均达到80%以上,表明这3种物质在此质量浓度范围内不会对细胞产生明显的毒性作用,而质量浓度大于10 μg/mL的CA、CS和RS处理细胞后,细胞存活率均有一定程度的下降,所以选用质量浓度1、5、10 μg/mL的CA、CS和RS进行后续实验。由图2D可以看出,质量浓度10~100 μg/mL的RA处理RAW264.7细胞24 h后,细胞存活率均达80%以上,即RA在此浓度范围内对细胞无毒性作用,因此可选取10、50、100 μg/mL的RA进行后续实验。
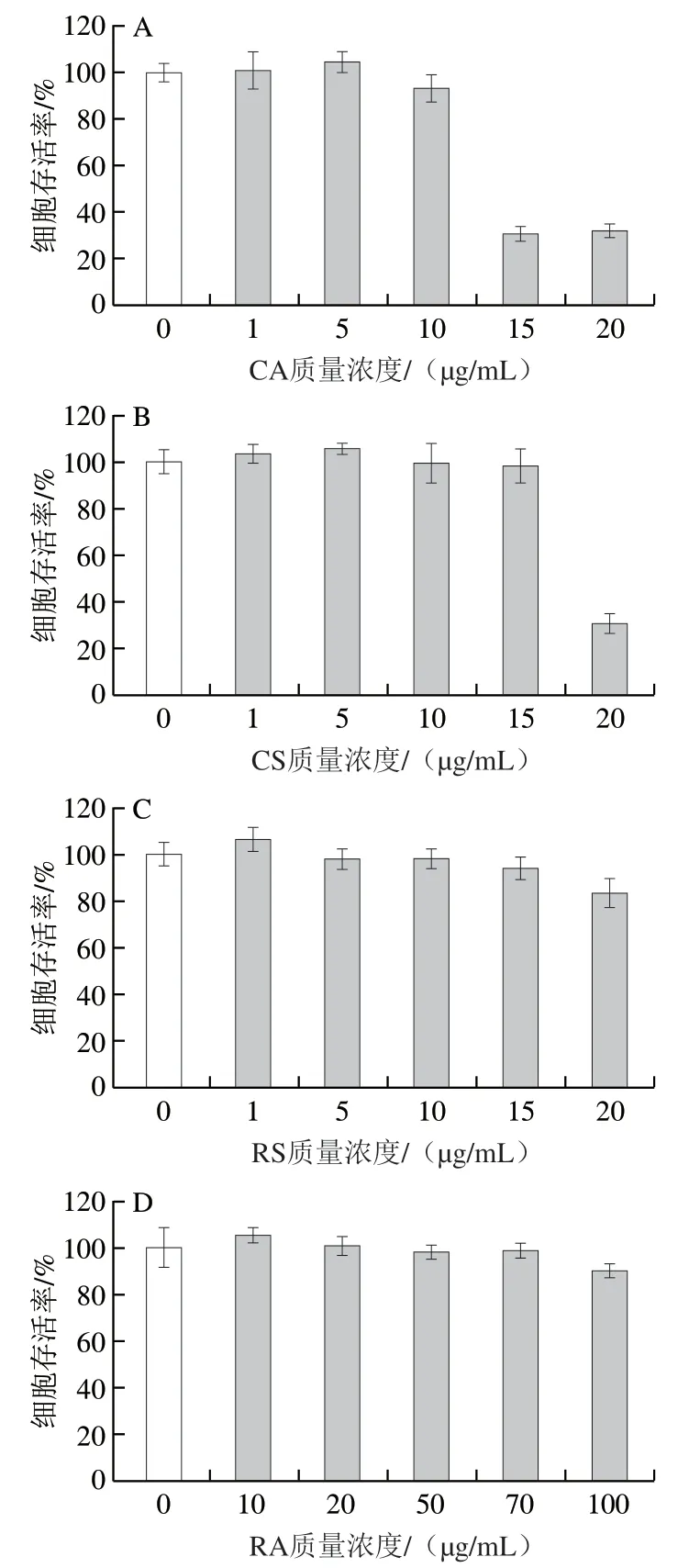
图2 CA(A)、CS(B)、RS(C)和RA(D)对RAW264.7细胞活力的影响Fig. 2 Effects of CA (A), CS (B), RS (C) and RA (D) on the viability of RAW264.7 cells
采用MTT法检测3种质量浓度的CA、CS、RS和RA对LPS诱导RAW264.7细胞活力的影响,结果如图3所示,质量浓度1、5、10 μg/mL的CA、CS、RS和质量浓度10、50、100 μg/mL的RA分别与质量浓度1 μg/mL的LPS共孵育24 h后,细胞存活率均超过90%,表明上述4种迷迭香化合物在此质量浓度范围内与LPS共孵育不会对细胞产生明显的毒性作用。因此,可选取质量浓度1、5、10 μg/mL CA、CS、RS和质量浓度10、50、100 μg/mL RA分别与LPS共孵育进行后续实验。
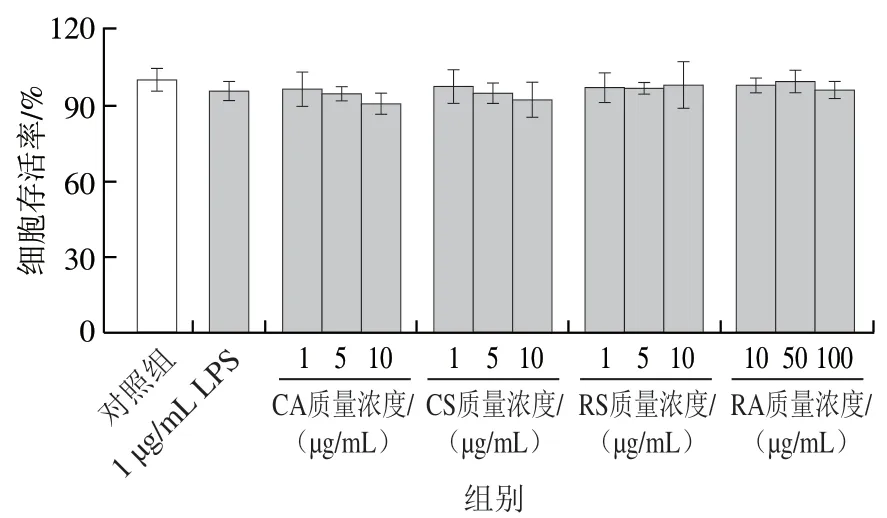
图3 CA、CS、RS和RA对LPS诱导RAW264.7细胞活力的影响Fig. 3 Effects of CA, CS, RS and RA on the viability of RAW264.7 cells induced by LPS
2.2 CA、CS、RS和RA对LPS诱导RAW264.7细胞内ROS水平的影响
当机体受到LPS刺激时,RAW264.7细胞产生氧化应激反应。ROS是氧化应激发生的重要介质,本实验中采用DCHF-DA荧光探针法检测细胞内ROS相对含量,结果如图4所示。
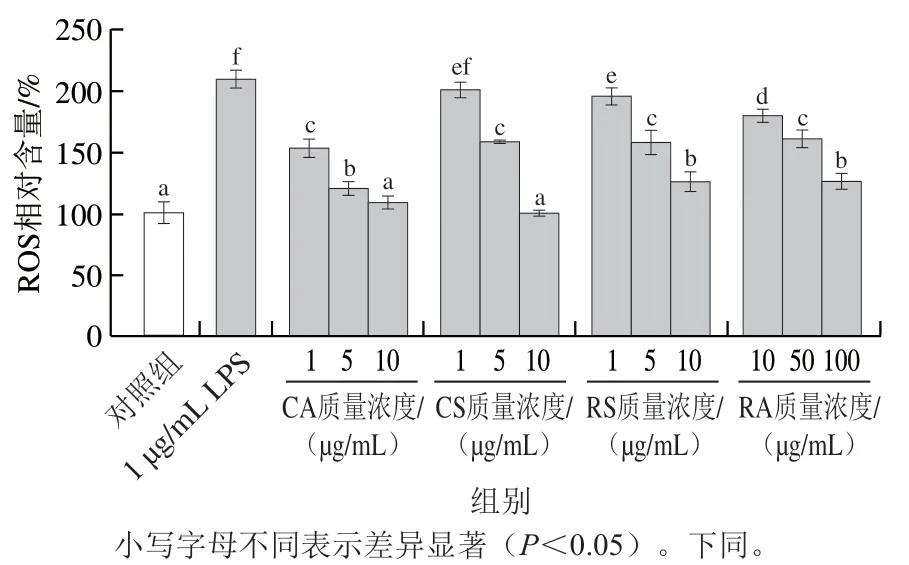
图4 CA、CS、RS和RA对LPS诱导的RAW264.7细胞内ROS水平的影响Fig. 4 Effect of CA, CS, RS and RA on ROS levels in RAW264.7 cells induced by LPS
由图4可知,与LPS组相比,4种迷迭香化合物均能显著降低LPS诱导的胞内ROS相对含量升高(P<0.05)(质量浓度1 μg/mL CS除外),并具有明显的剂量依赖性,即随质量浓度的升高,抑制效果逐渐增强。总体来看,CA对ROS的抑制效果优于其他3种化合物,其中,质量浓度10 μg/mL的CA与CS可将细胞ROS水平保持与对照组几乎一致。
2.3 CA、CS、RS和RA对LPS诱导RAW264.7细胞NO释放量的影响
氧化应激会导致严重的组织损伤和炎症反应,NO是炎症发生发展的关键介质,其释放量是衡量炎症反应程度的重要指标[21]。本实验利用Greiss法测定NO释放量,结果如图5所示。
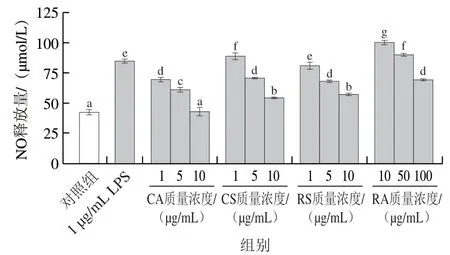
图5 CA、CS、RS和RA对LPS诱导RAW264.7细胞NO释放量的影响Fig. 5 Effect of CA, CS, RS and RA on NO production of RAW264.7 cells induced by LPS
由图5可见,与LPS组相比,大部分迷迭香化合物均能显著降低LPS诱导细胞NO的释放量(P<0.05),并具有一定的剂量依赖性,随质量浓度的升高,其抑制效果逐渐增强。在4种迷迭香化合物中,CA对NO的抑制作用较其他3种化合物更显著(P<0.05),且质量浓度10 μg/mL的CA可将NO释放量降低至与对照组几乎一致。与LPS组相比,质量浓度5~10 μg/mL的CS和RS及质量浓度100 μg/mL的RA对NO释放有显著的抑制效果(P<0.05),但均不及相应浓度下CA的效果显著(P<0.05)。
2.4 CA、CS、RS和RA对LPS诱导RAW264.7细胞内SOD、CAT活力和MDA含量的影响
SOD和CAT是细胞内关键的抗氧化酶,能有效清除ROS,从而提高机体的抗氧化能力[24],本实验采用WST-8法检测SOD活力,用可见显色法测定CAT活力。MDA是ROS过量积累导致脂质过氧化而生成的产物,采用TBARS比色法测定细胞内MDA含量,其含量间接反映细胞氧化应激损伤的程度。
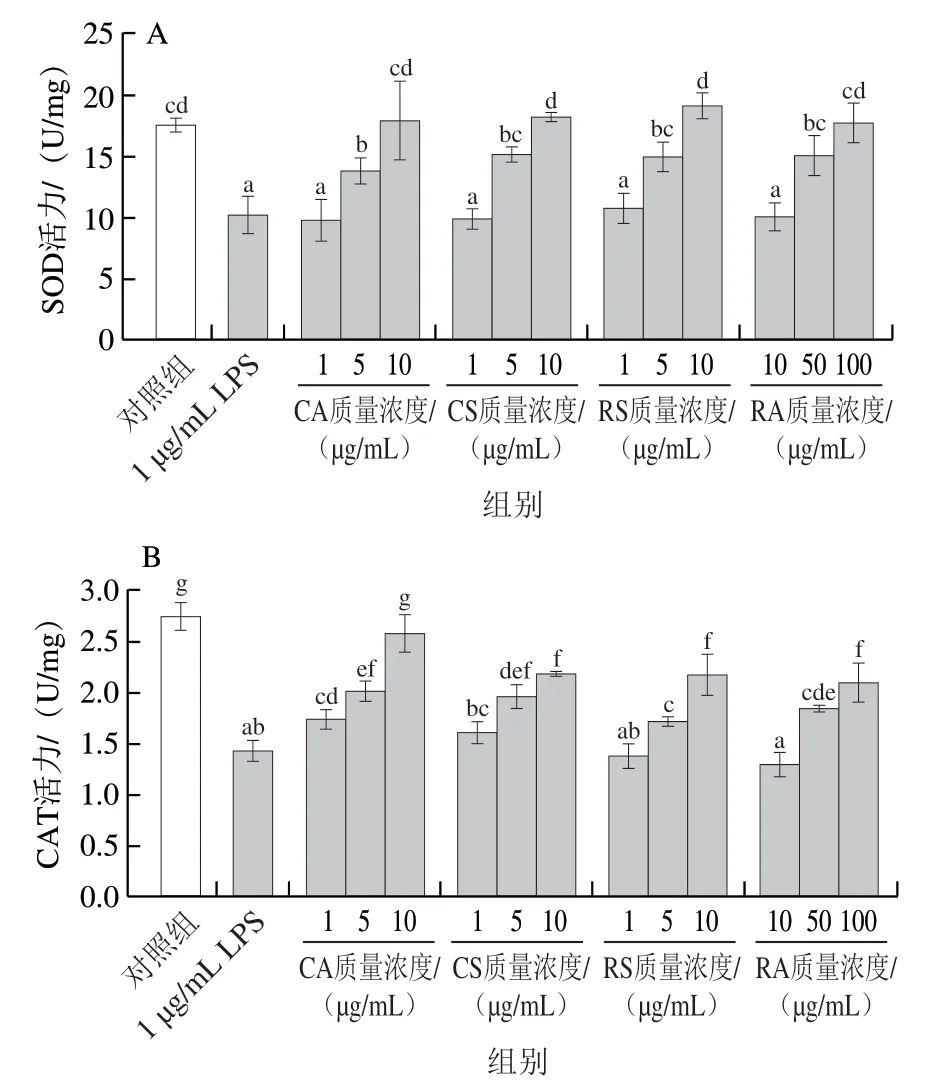
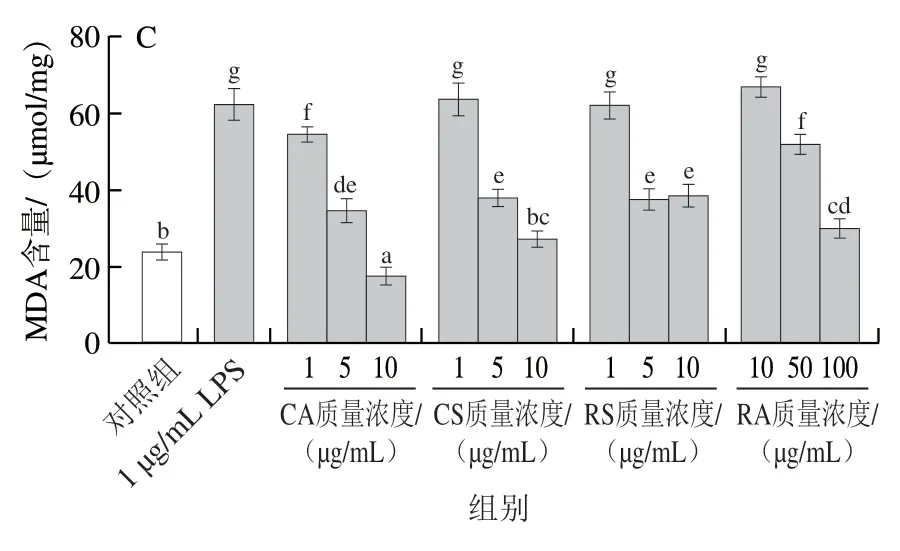
图6 CA、CS、RS和RA对LPS诱导的RAW264.7细胞内SOD(A)、CAT(B)活力和MDA含量(C)的影响Fig. 6 Effect of CA, CS, RS and RA on the activity of SOD (A), CAT (B)and MDA levels (C) in RAW264.7 cells induced by LPS
从图6A、B可以看出,SOD与CAT活力均随4种迷迭香化合物质量浓度的增大而提高,呈现明显的剂量效应。与LPS处理组相比,4种化合物在较高浓度处理时均能显著提高SOD与CAT活力(P<0.05)。其中,SOD活力在4种化合物添加到最高浓度时均与对照组近似,相互间无显著差异(P>0.05)。与SOD活力不同的是,低质量浓度的CA(1 μg/mL)处理较LPS组能显著提高CAT活力(P<0.05)。且4种化合物中,只有CA在最高质量浓度的作用下,CAT活力与对照组无显著差异(P>0.05),其他3种化合物在最高质量浓度下,虽然CAT活力较LPS组显著提高,但仍显著低于对照组(P<0.05)。
图6C结果显示,与对照组相比,LPS组能显著刺激细胞内MDA的产生(P<0.05),不同质量浓度的迷迭香化合物对MDA的抑制作用效果不同,且呈剂量依赖性。与LPS组相比,CS、RS和RA在较高质量浓度下均能显著抑制MDA的生成(P<0.05)。与其他化合物不同的是,质量浓度1、5、10 μg/mL CA处理与LPS组相比均可显著抑制MDA的产生(P<0.05),且在质量浓度10 μg/mL时, MDA含量降低到较对照组更低的水平(P<0.05)。由此可见,CA不仅能较好地提高SOD和CAT活力,还能够较好地抑制MDA的产生。
2.5 CA、CS、RS和RA对LPS诱导RAW264.7细胞内IL-6、IL-1β和TNF-α mRNA相对表达量的影响
IL-6、IL-1β和TNF-α参与调控机体的炎症反应,是重要的促炎因子。在LPS刺激下,细胞内促炎因子显著增加[25]。通过实时定量PCR方法检测迷迭香化合物对LPS诱导的细胞内IL-6、IL-1β和TNF-αmRNA相对表达量反映细胞炎症程度。
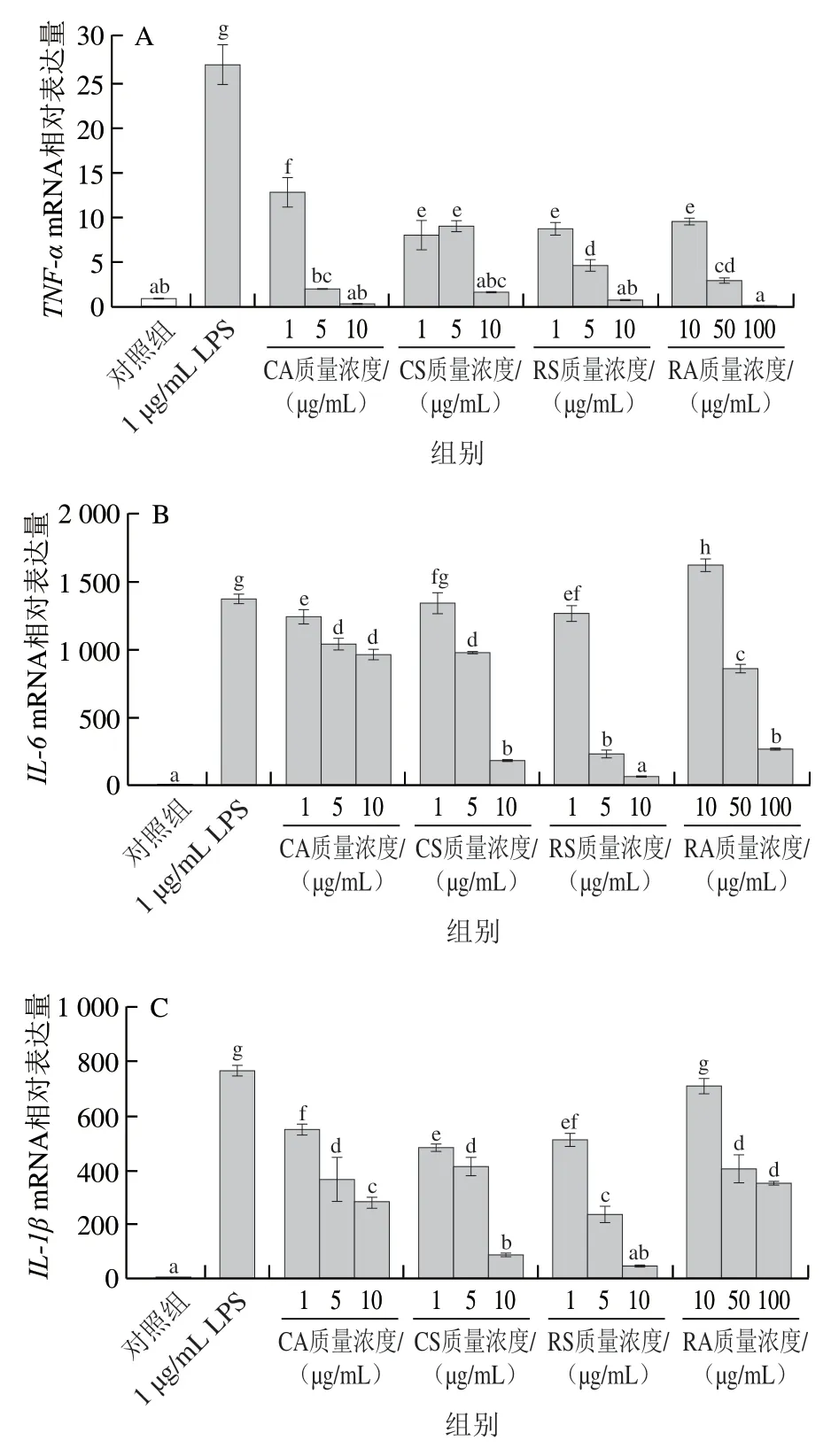
图7 迷迭香CA、CS、RS和RA对LPS诱导的RAW264.7细胞内TNF-α(A)、IL-6(B)和IL-1β(C) mRNA相对表达量的影响Fig. 7 Effects of CA, CS, RS and RA on relative mRNA expression of TNF-α (A), IL-6 (B) and IL-1β (C) in RAW264.7 cells induced by LPS
由图7可以看出,与LPS组相比,4种迷迭香化合物在较高质量浓度时对IL-6、IL-1β和TNF-αmRNA相对表达量均有较好的抑制作用,且具剂量依赖性。与LPS组相比,4种迷迭香化合物在最高质量浓度下均能显著抑制TNF-α的转录水平(P<0.05),且可达到与对照组水平(P>0.05)。只有质量浓度10 μg/mL RS能将LPS刺激导致的IL-6和IL-1βmRNA相对表达量升高降低至与对照组一致的水平(P>0.05)。由此可见,4种迷迭香化合物中,质量浓度5、10 μg/mL CA对TNF-α转录水平具有较好的抑制效果,而对于IL-6和IL-1β的转录抑制则是质量浓度10 μg/mL的RS效果最佳。
2.6 CA、CS、RS和RA对LPS诱导RAW264.7细胞内iNOS和COX-2蛋白相对表达量的影响
炎症是由多种分子机制介导的复杂过程,当细胞受到LPS刺激时iNOS和COX-2蛋白相对表达量会增加,iNOS和COX-2是炎症复杂网状体系中的重要靶基因蛋白[26]。利用Western blot方法检测iNOS和COX-2蛋白相对表达量,研究4种迷迭香化合物对LPS诱导的细胞抗炎活性。
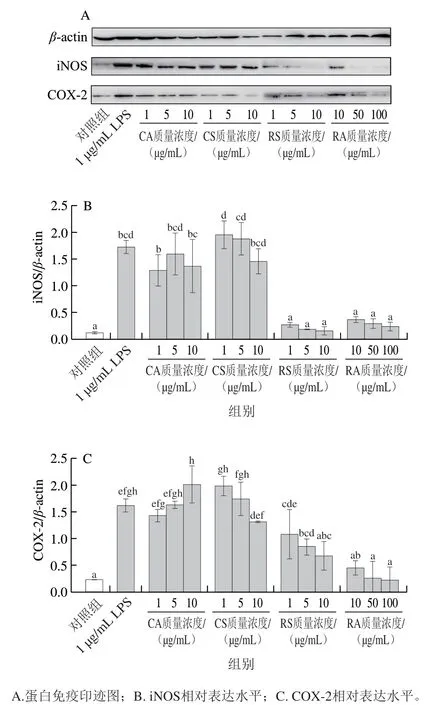
图8 CA、CS、RS和RA对LPS诱导的RAW264.7细胞内iNOS和COX-2蛋白相对表达量的影响Fig. 8 Effects of CA, CS, RS and RA on the relative protein expression of iNOS and COX-2 in RAW264.7 cells induced by LPS
由图8可以看出,随CS、RS和RA质量浓度的升高,LPS诱导的细胞iNOS和COX-2蛋白相对表达量逐渐降低,呈一定的剂量依赖效应。与LPS组相比,RS和RA能显著降低LPS诱导的iNOS蛋白相对表达量(P<0.05),且与对照组无显著差异(P>0.05)。在相应质量浓度下比较4种迷迭香化合物,其中RS对iNOS表达的抑制效果最佳。与LPS组相比,RA和RS均能显著降低LPS诱导细胞COX-2蛋白相对表达量(P<0.05)。其中,RA和质量浓度10 μg/mL RS可将COX-2蛋白相对表达量降低至与对照组无显著差异(P>0.05),对LPS诱导的COX-2蛋白表达升高表现出较好的抑制效果。
3 讨 论
炎症是宿主对抗外来病原体所产生的免疫防御应答反应。机体通过抗原呈递细胞(如巨噬细胞)表面的模式识别受体识别各种入侵微生物的病原相关分子模式,如鞭毛蛋白和LPS等,当机体受到LPS刺激时会产生大量的ROS[27]。本研究结果表明,CA、CS、RS和RA能降低LPS诱导的胞内MDA含量和ROS相对含量,提高LPS诱导的抗氧化物酶活力,从而对LPS诱导RAW264.7细胞氧化应激损伤具有一定的保护作用。
氧化应激与炎症密切相关,通过LPS刺激产生的ROS可以激活NF-κB信号通路,NF-κB信号通路是炎症发生的关键信号通路之一[28],可以促进TNF-α、IL-6等炎症因子的表达[29]。iNOS和COX-2是NF-κB信号通路中重要的两种蛋白分子,两者互相协调,是预防或治疗慢性炎性疾病的靶点[30],其中,iNOS可以调节NO的产生,NO也是参与氧化应激和炎症反应的关键信号分子[31]。本研究中CA、CS、RS和RA可以降低LPS诱导的细胞内促炎因子TNF-α、IL-6mRNA相对表达量,降低LPS诱导的iNOS和COX-2蛋白相对表达量,降低LPS诱导的NO释放量,且均有一定的浓度依赖效应,发挥了一定的抗炎作用。
ROS也可以激活炎症小体,炎症小体在各种生理病理过程中起着重要的作用。目前,NLRP3是研究最广泛的炎症小体,ROS可以通过激活NLRP3炎症小体促进炎症因子IL-1β的产生[32],本研究发现CA、CS、RS和RA可以降低LPS诱导的细胞内促炎因子IL-1βmRNA相对表达量。
近年来,迷迭香植物作为天然抗氧化、抗炎剂的研究与开发利用引起了广泛的关注,Lai等[33]发现RS可以阻断LPS诱导的RAW264.7细胞NF-κB信号通路的激活,进而下调iNOS和COX-2蛋白的表达。Arranz等[34]利用LPS刺激THP-1巨噬细胞构建体外炎症模型,研究发现CA和CS能够抑制TNF-α、IL-1β、IL-6、COX-2等基因的表达,进而表现出抗炎作用。Kuhlmann等[35]发现RA可以抑制LPS诱导的胶质细胞内自由基和NO的产生,具有一定的抗氧化、抗炎作用。本研究的结果进一步表明了4种迷迭香化合物可作为机体外源抗氧化、抗炎剂,从而有效地抑制氧化应激及炎症反应。
4 结 论
本实验研究了CA、CS、RS和RA对LPS诱导的RAW264.7细胞氧化应激和炎症反应的抑制作用。结果表明,上述4种迷迭香化合物对LPS诱导的细胞内ROS相对含量、MDA含量、NO释放量和TNF-α、IL-1β、IL-6mRNA相对表达量,以及iNOS和COX-2蛋白相对表达量的升高有显著抑制作用,对SOD和CAT活力有显著的保护作用,且具有浓度依赖效应。CA、CS、RS和RA可以有效缓解LPS诱导的RAW264.7细胞氧化应激和炎症,在体外具有预防或减弱氧化应激和炎症的效果,其中水溶性的RA有效质量浓度高于其他3种。本研究结果可丰富迷迭香在食品营养中的理论基础,为其开发抗氧化和抗炎的精准营养食品提供科学依据。
