茭白壳提取物对小鼠溃疡性结肠炎的预防作用
2022-12-30吴伟杰郜海燕房祥军韩延超刘瑞玲陈杭君
严 媛,吴伟杰,郜海燕,*,房祥军,韩延超,刘瑞玲,牛 犇,陈杭君,*
(1.南京农业大学食品科学技术学院,江苏 南京 210008;2.浙江省农业科学院食品科学研究所,农业农村部果品采后处理重点实验室,农业农村部蔬菜采后保鲜与加工重点实验室(部省共建),浙江省果蔬保鲜与加工技术研究重点实验室,中国轻工业果蔬保鲜与加工重点实验室,浙江 杭州 310021)
茭白(Zizania latifolia)是禾本科菰属水生植物,是我国仅次于莲藕的第二大水生蔬菜,茭白壳是茭白采收时下部残留的叶鞘[1]。茭白采收时,割取茭白后剩余的叶片和叶鞘通常丢弃在田埂间,我国茭白产业每年产生的废弃茭白鞘叶在500万 t以上,造成严重的环境污染[2]。目前关于茭白鞘叶的回收利用主要集中在食用菌基质、动物饲料等方面,从中提取的天然功能性物质主要包括黄酮、膳食纤维和叶绿素[3-5],加强对废弃茭白壳的研究开发利用具有重要的现实意义。小麦黄素又称为苜蓿素,是一种类黄酮化合物,广泛存在于禾本科植物中,研究表明小麦黄素能通过抑制环氧合酶(cyclooxygenase,COX)、肿瘤坏死因子(tumor necrosis factor,TNF)、前列腺素(prostaglandin,PG)、白细胞介素(interleukin,IL)、一氧化氮(NO)等炎症介质发挥抗炎作用[6-7]。
溃疡性结肠炎是一种发病机制尚未明确的慢性非特异性炎症性肠病,病情易反复,治疗难度大,近年来在我国的发病率呈显著上升趋势,常见于青壮年人群,严重影响患者的生存质量[8-9]。且溃疡性结肠炎发病机制复杂,主要包括遗传因素和环境因素,其中饮食是最重要的环境因素之一[10],近年来通过饮食干预治疗溃疡性结肠炎的方法成为研究热点。
基于前人研究基础,本研究通过葡聚糖硫酸钠盐(dextran sulfate sodium,DSS)诱导小鼠溃疡性结肠炎模型,评价茭白壳提取物(Zizania latifoliashell extract,Zlse)对小鼠溃疡性结肠炎的预防作用,以期为推进茭白壳的综合利用提供理论依据,并为膳食预防和调节溃疡性结肠炎提供参考。
1 材料与方法
1.1 动物、材料与试剂
C57BL/6小鼠,雄性,SPF级,7 周,体质量16~22 g,购于华东师范大学科学实验动物中心,饲养于浙江省农业科学员实验动物中心专属动物房,使用许可证号:SYXK(浙)2020-0022。
‘浙茭七号’茭白壳 浙江省嘉兴市桐乡董家优质茭白基地;玉米芯垫料 邳州市小河科技发展有限公司;60Co灭菌饲料 北京科澳协力饲料有限公司。
美莎拉嗪肠溶片 佳木斯鹿灵制药有限公司;超氧化物歧化酶(superoxide dismutase,SOD)、髓过氧化物酶(myeloperoxidase,MPO)、IL-1β、TNF-α、IL-6、IL-8检测试剂盒 南京建成科技有限公司;DSS、无水乙醇、乙酸乙酯、甲醛(均为分析纯) 上海麦克林生化科技有限公司;柱层析硅胶(200~300 目) 青岛海洋化工有限公司。
1.2 仪器与设备
FreeZone®真空冷冻干燥机 美国Labconco公司;DGG-9070A电热恒温鼓风干燥箱 上海森信实验仪器有限公司;RE-52AA旋转蒸发器 上海亚荣生化仪器厂;DK-S28电热恒温水浴锅 上海精宏实验设备有限公司;ME103E电子天平 梅特勒-托利多(上海)有限公司;ZJ-4独立送风隔离笼具 苏州冯氏实验动物设备有限公司;RM2016病理切片机 上海徕卡仪器有限公司;SpectraMax M2酶标仪 美国Molecular Devices公司;NIKON DS-U3光学显微镜 日本尼康公司。
1.3 方法
1.3.1 茭白壳提取物的制备
将新鲜茭白壳洗净切碎,放入恒温干燥箱中60 ℃烘干至恒质量,粉碎后过40 目筛,于干燥器中贮藏备用。将茭白壳粉末与体积分数70%乙醇溶液按料液比1∶30(m/V)混匀,在恒温水浴锅中于80 ℃搅拌浸提3 h,取出后超声(30 ℃、210 W)辅助提取30 min,过滤,所得滤液于40 ℃旋蒸至无乙醇味,冷冻干燥后以料液比1∶30(m/V)用乙酸乙酯分两次萃取,合并萃取液,旋蒸水洗后冷冻干燥备用。取乙酸乙酯相冻干样品与硅胶搅拌,干法上样,进行硅胶柱色谱层析,以体积比100∶0~0∶100的二氯甲烷-甲醇进行梯度洗脱,根据薄层层析检测结果合并相似洗脱液,再次进行硅胶柱色谱分离,以体积比50∶1~5∶1的二氯甲烷-甲醇梯度洗脱,合并目标洗脱液,真空冷冻干燥保存备用。所得Zlse利用超高效液相色谱-串联质谱(ultra performance liquid chromatography tandem mass spectrometry,UPLC-MS/MS)进行定性和相对定量分析。
1.3.2 小鼠溃疡性结肠炎模型的构建及分组
小鼠饲养条件:SPF级,温度22~25 ℃,相对湿度60%~70%,明暗12 h循环,标准饲料饲养,小鼠自由摄食饮水。参考Wu Hao等[11]的方法进行造模,60 只C57BL/6雄性小鼠适应性喂养一周后,随机分为6 组,每组10 只,除正常组外其余组灌胃质量分数3.5% DSS水溶液诱导小鼠溃疡性结肠炎,阳性对照组以美沙拉嗪(5-aminosalicylic acid,5-ASA)作为阳性对照,分组及模型构建方法如表1所示。
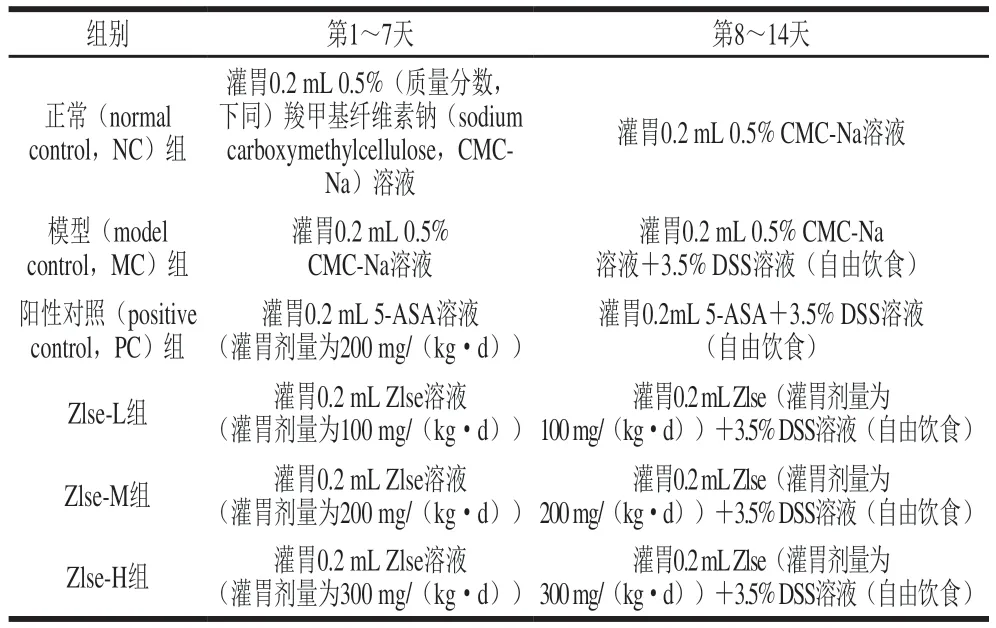
表1 小鼠溃疡性结肠炎模型的构建Table 1 Experimental scheme for construction of mouse model of ulcerative colitis
造模结束后断食24 h,眼球取血收集血清并处死小鼠,取出盲肠至肛门处整段结肠,测量长度,剪下1 cm结肠用质量分数4%甲醛溶液固定,苏木精-伊红(hematoxylin-eosin,HE)染色观察结肠组织病变情况,其余结肠组织迅速于液氮中保存,然后转移至-80 ℃冰箱用于酶活力测定。
1.3.3 小鼠疾病活动指数评分
实验过程中每天记录小鼠体质量,并观察小鼠大便性状及便血情况,并进行评分,计算小鼠疾病活动指数(disease active index,DAI)评分,量化炎症程度[12]。DAI评分标准如表2所示[13],体质量变化率和DAI评分计算分别见式(1)、(2)。
组别 第1~7天 第8~14天正常(normal control,NC)组灌胃0.2 mL 0.5%(质量分数,下同)羧甲基纤维素钠(sodium carboxymethylcellulose,CMCNa)溶液灌胃0.2 mL 0.5% CMC-Na溶液灌胃0.2 mL 0.5% CMC-Na溶液+3.5% DSS溶液(自由饮食)阳性对照(positive control,PC)组模型(model control,MC)组灌胃0.2 mL 0.5%CMC-Na溶液灌胃0.2 mL Zlse(灌胃剂量为100 mg/(kg·d))+3.5% DSS溶液(自由饮食)Zlse-M组 灌胃0.2 mL Zlse溶液(灌胃剂量为200 mg/(kg·d))灌胃0.2mL 5-ASA+3.5% DSS溶液(自由饮食)Zlse-L组 灌胃0.2 mL Zlse溶液(灌胃剂量为100 mg/(kg·d))灌胃0.2 mL 5-ASA溶液(灌胃剂量为200 mg/(kg·d))灌胃0.2 mL Zlse(灌胃剂量为200 mg/(kg·d))+3.5% DSS溶液(自由饮食)Zlse-H组 灌胃0.2 mL Zlse溶液(灌胃剂量为300 mg/(kg·d))灌胃0.2 mL Zlse(灌胃剂量为300 mg/(kg·d))+3.5% DSS溶液(自由饮食)


表2 DAI评分标准Table 2 Scoring criteria for DAI
1.3.4 小鼠结肠长度及HE染色检查结肠组织病理学变化
将用质量分数4%甲醛溶液固定的结肠组织样本取出,经过脱水、石蜡包埋、切片、脱蜡洗涤、HE染色等步骤后,在光学显微镜下观察各组织样本病变情况并进行组织病理学评分[14],评分标准如表3所示,结肠组织病理学评分按式(3)计算。

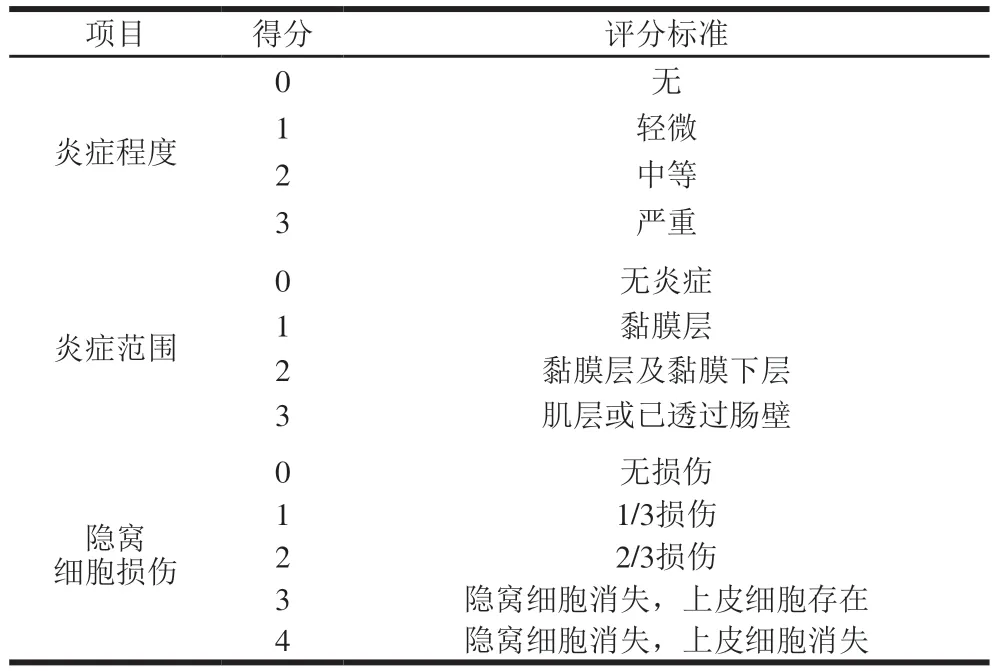
表3 小鼠结肠炎组织病理学评分标准Table 3 Criteria for histopathological grading of colitis in mice
1.3.5 小鼠血清炎症因子水平的测定
各组小鼠血液样本静止4 h时,待血液凝固后,3 000 r/min离心15 min取上层血清,用磷酸盐缓冲液(pH 7.2~7.4)稀释至所需浓度,采用酶联免疫吸附试验法,按照试剂盒说明书进行操作,酶标仪测定OD450nm,根据标准曲线计算各血清样本中IL-1β、TNF-α、IL-6、IL-8质量浓度。
1.3.6 小鼠结肠组织氧化应激水平测定
精确称取结肠组织,加入检测试剂盒中的匀浆介质混匀,按照试剂盒说明书进行操作,酶标仪测定OD460nm,测定和计算小鼠结肠组织中MPO活力和SOD活力。
1.3.7 茭白壳提取物活性成分作用靶点预测
利用PubChem数据库获取成分的分子式和SMILES号,通过Swiss Target平台查询Zlse各活性成分的相关靶点,再通过OMIM、GeneCards、Therapeutic Target Database(TTD)数据库3个平台查找溃疡性结肠炎的相关靶点,并筛选出Zlse活性成分与疾病的交叠靶点,利用DAVID数据库筛选得到交叠靶点相关京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路。最后通过网络拓扑属性分析软件Cytoscape 3.7.0构建“活性成分-靶点-疾病”网络图和“活性成分-靶点-KEGG通路”网络图。
1.4 数据统计与分析
数据均采用平均值±标准差表示。采用Excel及GraphPad Prism 8.0.2软件进行数据处理和作图。采用SPSS 25.0中单因素方差分析进行统计学分析,置信区间为95%(P<0.05)。
2 结果与分析
2.1 茭白壳提取物成分分析
如图1所示,多反应监测模式(multiple reaction monitoring,MRM)检测多峰图显示了样本中检测到的所有物质,其中不同颜色的质谱峰代表检测到不同物质,具体物质见表4。茭白壳粗提物经过乙酸乙酯萃取和硅胶层析柱纯化之后,得到的化合物进行UPLC-MS/MS检测,所得Zlse共检测到10种化合物,其中9种为黄酮类化合物、1种为生物碱。10种化合物根据相对含量排序分别为沙可林B>小麦黄素-4’-O-(愈创木酰甘油)醚>沙可林A>小麦黄素>小麦黄素-4’-O-丁香醇醚>3-氯苯胺>香叶木素>高车前素>小麦黄素-7-O-(2’-丙二酰)鼠李糖苷>柚皮素,其中小麦黄素-4’-O-丁香醇醚、小麦黄素、小麦黄素-4’-O-(愈创木酰甘油)醚、小麦黄素-7-O-(2’’-丙二酰)鼠李糖苷、沙可林B、沙可林A这6种化合物为小麦黄素及其衍生物,总相对含量约为91.53%。
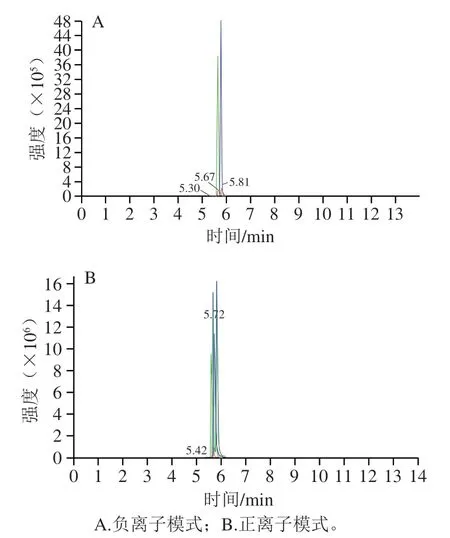
图1 茭白壳提取物MRM检测多峰图Fig. 1 MRM detection multi-peak diagram of Z. latifolia shell extract
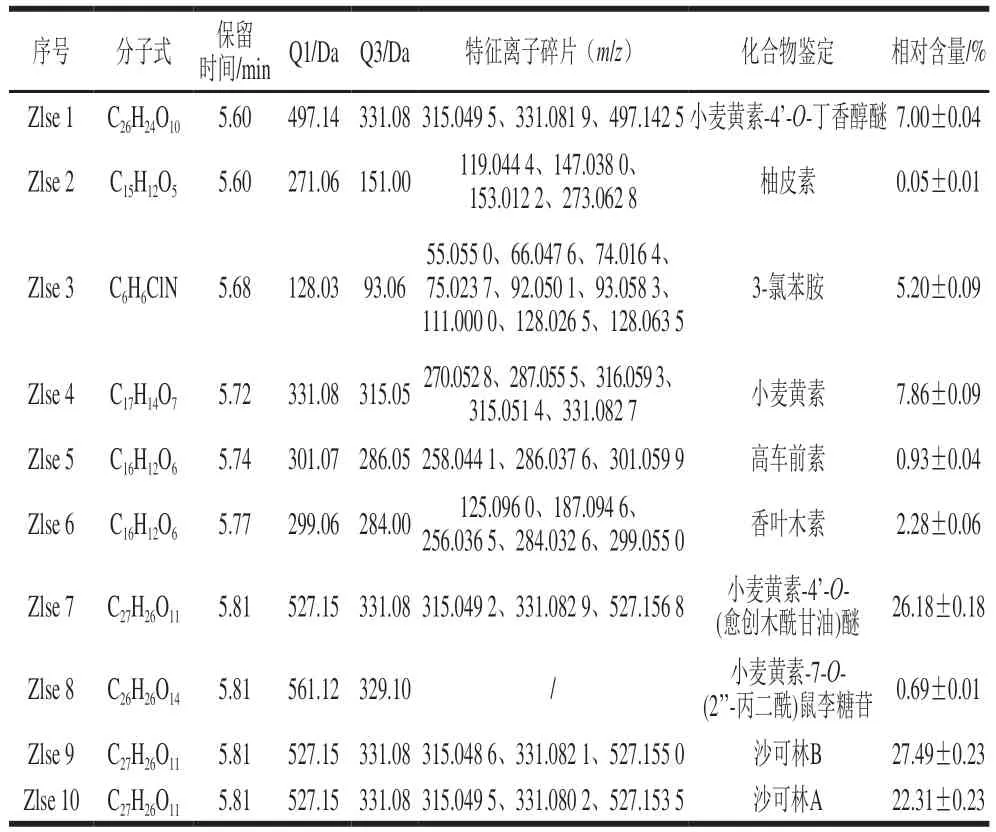
表4 茭白壳提取物成分分析Table 4 Component analysis of Z. latifolia shell extract
2.2 茭白壳提取物对小鼠体质量变化率及DAI的影响
体质量下降是DSS诱导小溃疡性结肠炎的典型症状之一[15]。如图2A所示,MC组小鼠体质量从第10天开始下降,第14天时,MC组小鼠体质量为造模初始的84.50%,而NC组小鼠体质量为初始的106.77%,MC组小鼠相较NC组体质量显著下降(P<0.05)。与MC组相比,Zlse处理组(Zlse-L、Zlse-M和Zlse-H)小鼠体质量的下降趋势减缓,分别为初始体质量的89.10%、92.17%和96.06%,表明Zlse能有效改善结肠炎小鼠体质量减轻的症状。
DAI评分是评估小鼠溃疡性结肠炎的重要指标[16]。如图2B所示,NC组小鼠精神活跃、毛色光泽发亮,且体质量稳定上升、大便成形、无便血情况,而MC组小鼠第9天开始DAI评分上升,出现精神萎靡、大便带黏液等症状,第11天出现肉眼可见便血,并伴随水状粪便、肛门肿胀等现象。相较而言,Zlse组情况有所改善,第14天时,NC组DAI评分为0,MC组为3.70,Zlse-L组为3.17,Zlse-M组为2.87,Zlse-H组为2.23,说明Zlse能缓解小鼠结肠炎病状。
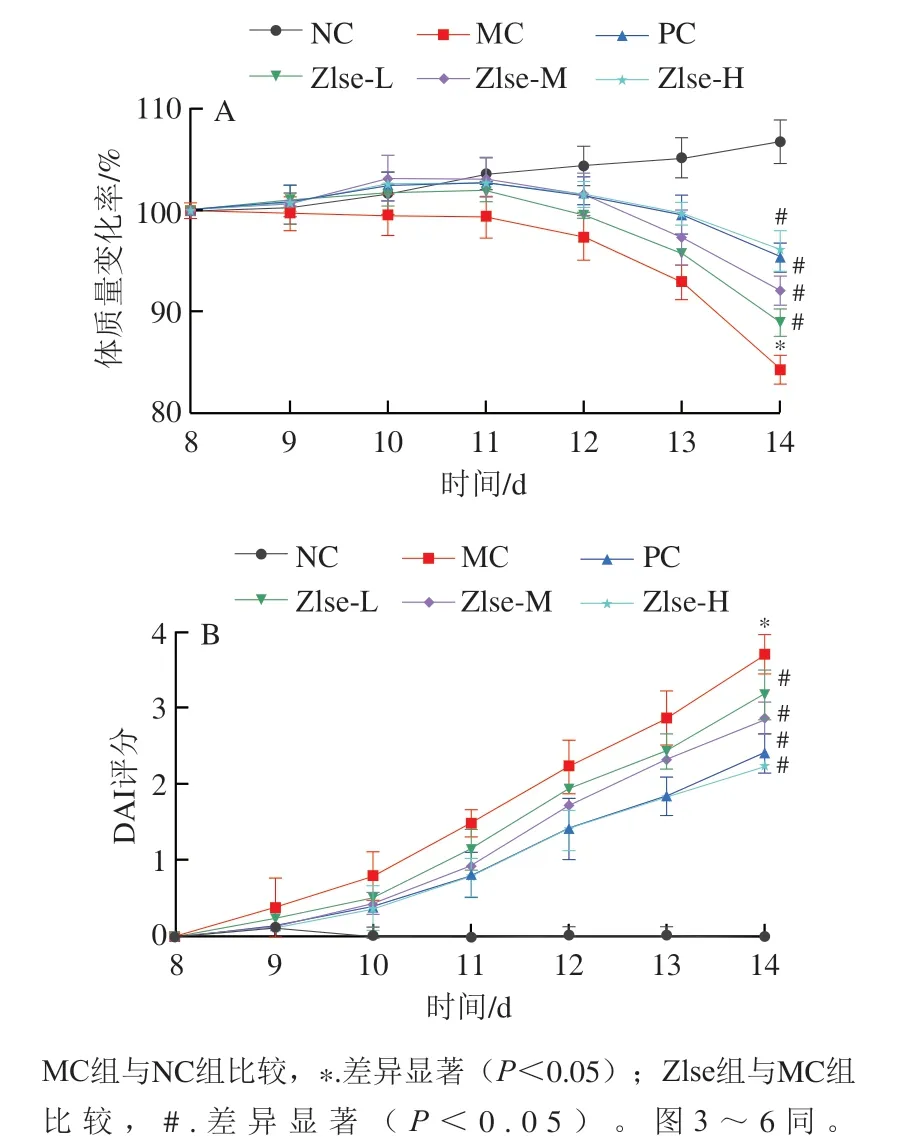
图2 茭白壳提取物对小鼠体质量变化率(A)和DAI评分(B)的影响Fig. 2 Effect of Z. latifolia shell extract on percentage body mass change (A) and DAI score (B) in mice
2.3 茭白壳提取物对小鼠结肠长度的影响
结肠萎缩是小鼠溃疡性结肠炎的主要症状之一[17]。如图3所示,NC组小鼠结肠长度为7.95 cm,MC组为5.02 cm,与NC组相比显著缩短(P<0.05),Zlse-L、Zlse-M和Zlse-H组结肠长度分别为5.37、5.67 cm和6.08 cm,相比MC组分别增长6.97%、12.95%和21.12%,说明Zlse一定程度能改善小鼠溃疡性结肠炎的症状。
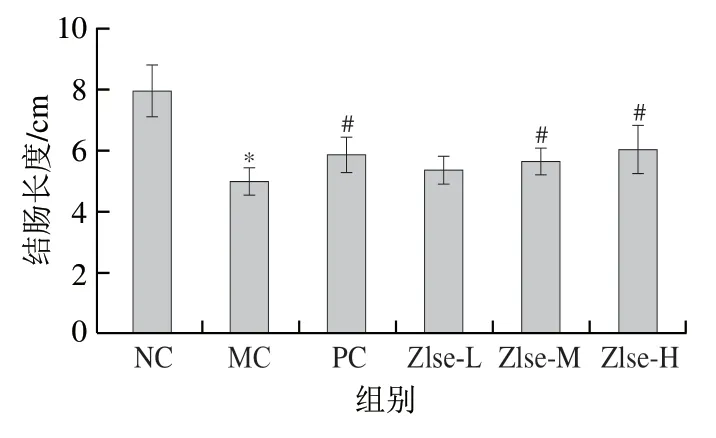
图3 茭白壳提取物对小鼠结肠长度的影响Fig. 3 Effect of Z. latifolia shell extract on colon length in mice
2.4 茭白壳提取物对小鼠结肠组织病理情况的影响
为评价Zlse对小鼠结肠组织病理情况的影响,对结肠进行HE染色,结果如图4A所示。NC组小鼠结肠肉眼观察无溃疡和充血症状,HE染色切片观察结肠组织健康,上皮组织结构完整,腺体完整有序,隐窝结构正常。MC组结肠组织肉眼可见充血和部分糜烂,显微镜下观察上皮损伤脱落,隐窝破损甚至完全消失,腺体损伤,炎症细胞浸润严重,这与MC组小鼠结肠组织病理学评分相较于NC组显著提高(P<0.05)(图4B)一致。而Zlse-L、Zlse-M组和Zlse-H组上皮组织之间趋于完整,杯状细胞增多,炎症细胞减少,隐窝结构逐渐趋于正常,组织病理学评分较MC组分别显著降低16.47%、34.12%和57.65%(P<0.05)。
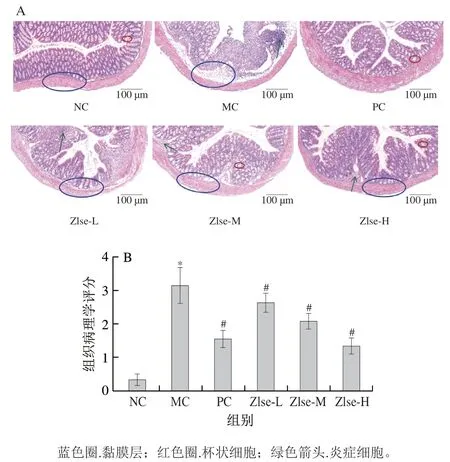
图4 茭白壳提取物对小鼠结肠HE染色切片(200×)(A)及组织病理学评分(B)的影响Fig. 4 Effect of Z. latifolia shell extract on colonic morphology (200 ×) (A)and histopathology score (B) of mice
2.5 茭白壳提取物对小鼠血清炎症因子水平的影响
炎症因子是一类主要由免疫系统细胞分泌的具有多种生物学效应的内源性多肽,可介导单核细胞等炎症细胞浸润肠组织,引起肠组织损伤,直观反映结肠的炎症程度[18]。IL-6、IL-8、IL-1β、TNF-α等促炎症因子分泌水平异常升高会促使小鼠结肠炎性损伤加剧[19]。
TNF-α是炎症反应中出现最早、最重要的炎性介质,能够协同干扰素γ改变肠上皮细胞的屏障功能和形态结构,增加肠黏膜和血管壁的通透性,引起肠壁出现溃疡和水肿[20],还能够促进IL-6、IL-8等炎症因子的表达,扩大炎症级联反应,加剧炎症损伤[21]。IL-1β是单核细胞及免疫细胞产生的重要炎症介质,可促进其他炎性因子表达,趋化中性粒细胞浸润肠道病变部位[22]。IL-6可被IL-1β通过自分泌或者旁分泌的形式刺激产生,能诱导B细胞分化和产生抗体,并诱导T细胞活化增殖,参与机体的免疫应答,是炎性反应的促发剂[23]。IL-8能刺激中性粒细胞趋化,使其脱颗粒后释放弹性酶、损伤内皮细胞,引起微循环血流淤滞、组织坏死[24]。
如图5所示,与NC组相比,MC组小鼠血清中促炎症因子水平均显著提高(P<0.05),与MC组相比,Zlse干预组各炎症因子水平均显著降低(P<0.05),其中Zlse-L、Zlse-M组和Zlse-H组IL-6质量浓度相较于MC组分别降低15.99%、23.11%和43.48%,IL-8质量浓度分别降低24.69%、32.82%和44.79%,IL-1β质量浓度分别降低25.39%、44.68%和65.96%,TNF-α质量浓度分别降低42.33%、49.21%和62.79%。殷玉婷等[25]研究发现小麦黄素可显著降低小鼠支气管肺泡灌洗液中TNF-α和IL-1β水平,改善小鼠肺部炎症;郭敏侠等[26]用尿酸钠诱导RAW264.7巨噬细胞炎症,结果发现小麦黄素能够降低细胞培养物上清液中TNF-α含量。本研究发现Zlse能通过抑制促炎症因子水平升高,缓解DSS诱导的小鼠溃疡性结肠炎病理过程中的炎症反应和组织损伤,与前人研究结果一致。
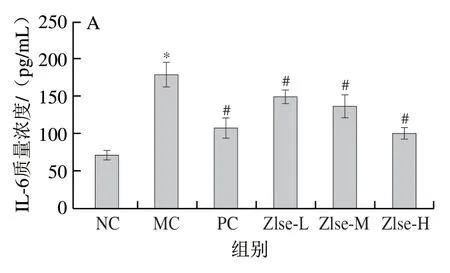
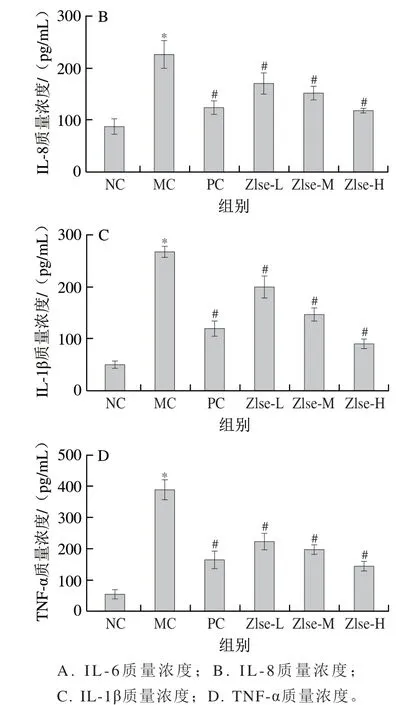
图5 茭白壳提取物对小鼠血清炎症因子水平的影响Fig. 5 Effect of Z. latifolia shell extract on serum inflammatory factors in mice
2.6 茭白壳提取物对小鼠结肠氧化应激的影响
溃疡性结肠炎发病机制与肠道抗氧化系统的失衡有关,过量活性氧和活性氮堆积会导致结肠抗氧化防御系统失衡。MPO是一种血红素蛋白,富含于中性粒细胞中,在中性粒细胞中可使过氧化氢催化电子供体的氧化作用生成多种氧化物,进而引起氧化应激反应和氧化损伤,最终导致结肠组织损伤[27-28]。如图6A所示,和NC组相比,MC组小鼠结肠的MPO活力显著升高(P<0.05),而Zlse-L、Zlse-M和Zlse-H组的MPO活力显著低于MC组(P<0.05),且随着Zlse剂量升高MPO活力逐渐降低,相较于MC组分别降低18.48%、22.56%和41.96%,表明Zlse能有效减少小鼠结肠组织中的中性粒细胞,降低炎症程度,这与HE染色中观察到的结肠组织炎症细胞浸润程度降低一致。SOD能通过清除机体产生的超氧阴离子自由基减轻氧化应激损伤,SOD活力降低致使结肠对自由基的清除能力下降,加速结肠组织损伤[29]。如图6B所示,相较于NC组,MC组SOD活力显著降低(P<0.05),Zlse-L、Zlse-M组和Zlse-H组SOD活力分别为MC组的1.28、1.48 倍和1.70 倍。小麦黄素具有良好的抗氧化能力,能有效清除1,1-二苯基-2-三硝基苯肼自由基、羟自由基和超氧阴离子自由基[30-32]。Li Xiaoxiao等[33]研究发现小麦黄素可以通过抑制MPO活力减轻DSS诱导的小鼠结肠组织损伤。本研究结果表明Zlse能够通过调节小鼠结肠组织MPO和SOD活力,提高结肠抗氧化应激能力,减轻结肠氧化损伤,缓解炎症。
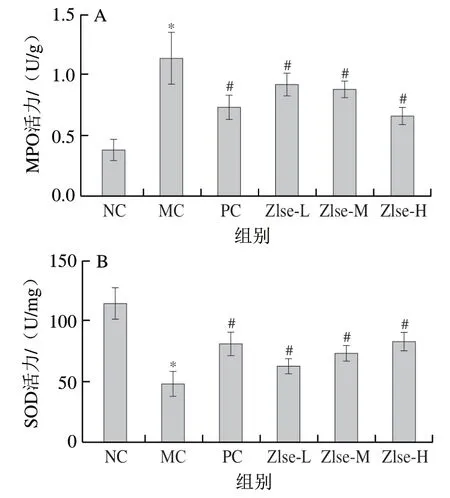
图6 茭白壳提取物对小鼠结肠组织中MPO活力(A)和SOD活力(B)的影响Fig. 6 Effect of Z. latifolia shell extract on MPO (A) and SOD (B)activity in colon tissue of mice
2.7 网络药理学分析
Zlse经过UPLC/MS-MS系统检验共包含10种化合物,进一步在Swiss Target Prediction数据库中筛选得到符合要求的靶点280个,8种化合物为有效活性成分,在OMIM、GeneCards、TTD数据库以溃疡性结肠炎为关键词,筛选得到1 571个疾病相关靶点,将筛选得到的活性成分靶点与疾病相关靶点进行比对,共得到77个共有靶点(图7A)。
通过Cytoscape构建活性成分-靶点-疾病网络图,结果如图7B所示,根据平均节点Degree值(30)筛选得5个关键活性成分,根据节点Degree值排序分别为高车前素(49)>香叶木素(45)>小麦黄素(44)>小麦黄素-4’-O-丁香醇醚(42)>柚皮素(39),由于高车前素、香叶木素和柚皮素相对含量很少,推测小麦黄素及小麦黄素-4’-O-丁香醇醚为关键活性成分。
通过DAVID数据库对潜在基因进行通路富集分析得到119 条KEGG通路,筛选排名前20的KEGG通路,结果如图7C、D所示,除人类癌症相关通路之外,磷脂酰肌醇3-激酶/苏氨酸激酶(phosphatidylinositol 3-kinase/threonine kinase,PI3K/Akt)信号通路位居首位,可能是Zlse治疗溃疡性结肠炎的关键通路,另外受体激活和活性氧积累等也是相关重要通路。研究表明,PI3K/Akt信号通路在肠道炎症反应过程中发挥重要作用,与细胞因子的调控紧密相关。PI3K家族是一类蛋白激酶,PI3K活化之后会激活下游直接靶蛋白Akt,进而激活核因子κB,诱导其释放大量炎性因子如TNF-α、IL-6和IL-8等[34]。推测Zlse可通过调节炎症因子和抗氧化系统来改善溃疡性结肠炎的炎症程度和症状,其中小麦黄素和小麦黄素-4’-O-丁香醇醚为关键活性成分,这与动物实验的结果相印证。
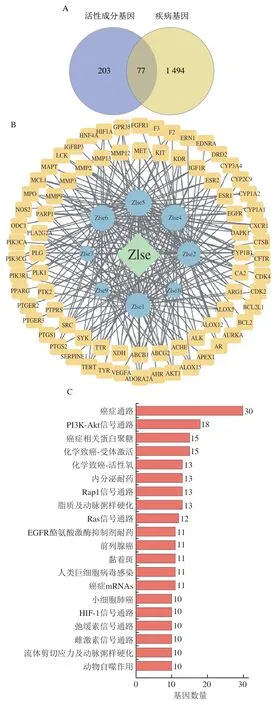
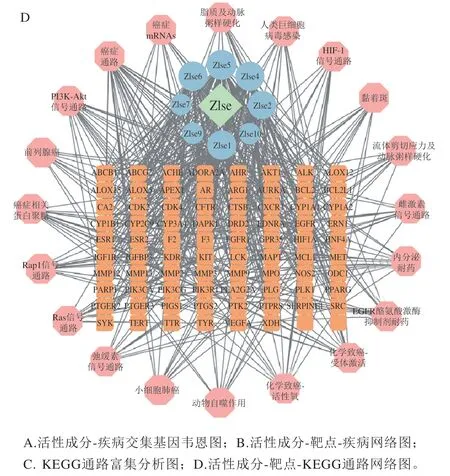
图7 网络药理学分析Fig. 7 Network pharmacology analysis
3 结 论
本研究发现,相较于MC组,Zlse干预组小鼠体质量下降变缓,DAI评分显著降低(P<0.05),小鼠结肠缩短现象减轻,且结肠组织病变情况明显改善,组织病理学评分显著降低(P<0.05),Zlse显著抑制了小鼠血清中促炎症因子水平的升高(P<0.05),显著降低结肠氧化应激酶MPO活力(P<0.05),提高结肠SOD活力(P<0.05)。UPLC-MS/MS分析Zlse中共检出10种化合物,经过PubChem、Swiss Target、OMIM、GeneCards、TTD、DAVID数据库筛选,推测小麦黄素及小麦黄素-4’-O-丁香醇醚为其关键活性成分,PI3K/Akt信号通路、受体激活、活性氧积累为重要作用通路。Zlse通过调节结肠氧化防御系统,缓解小鼠的炎症程度,修复结肠炎带来的损伤。
