TiO2负载Co基纳米材料催化硼氢化钠水解制氢性能的研究
2022-12-29王雪张迪任简徐凤艳王艳
王雪,张迪,任简,徐凤艳,王艳
(沈阳师范大学,辽宁 沈阳 110034)
随着工业化污染物越来越多,人类所面临的环境污染也愈发严重。经研究发现,近些年来有的半导体材料光照下可实现降解污染物。半导体材料的重要特性之一就是能够进行光催化,它可以在光的作用下将光能转化为化学能,这样一来就能达到促进目标化合物的合成或降解。TiO2就是其中重要代表之一,它作为一种宽禁带半导体材料,具备无毒、无嗅、物理性质稳定等特点,目前已被广泛地应用于防晒、油漆等领域[1-4]。
TiO2是自然界中常见的一种n 型半导体材料,其因连接方式不同,在自然界中以3种形式存在[5-6]。三者因结构不同,物理和化学性质也就不尽相同。其中金红石型因其具备较强的遮盖力以及着色力被广泛用于油漆等工业中去[7-8];锐钛矿型因其光催化活性较好,因此可将其用于绿色降解中,极具研究价值[9-10]。
迄今为止,由于传统化石燃料日渐缺乏,使得环境污染、能源危机等问题也越来越严重。针对此状来说,探索能源去代替煤等化石燃料[11]不仅是减少污染问题的重点,也是目前能源方面的首要任务。因此,对于高效、洁净以及可再生能源的期望也逐步加强。作为重要新能源物质之一的氢气来说,它本身具备可再生、自身清洁等优势。这也足以让氢气在新能源中占有重要地位,而针对氢气的制备与存储也具有一定的研究价值与重要意义。正是因为氢具有密度小、易燃易爆以及大多数情况下为气态等物理性质,所以存储氢的过程极具困难[12]。本实验主要研究化学储氢材料中的硼氢化物类储氢材料[13-15]。原因是其具备稳定性好、自身储氢量高、被广泛应用等优点。主要的硼氢化物类储氢材料有氨硼烷[15]以及硼氢化钠,由于氨硼烷的价格相对昂贵,本实验采用硼氢化钠[16]进行水解制备氢。硼氢化钠[16]分子式为NaBH4,具备自身储氢量较高、价格相对低廉、在碱性溶液中的稳定性较好等特点[17]。此外在一定催化剂作用下,碱性NaBH4溶液在室温下水解可释放出氢气。其反应原理如下:

为了能够使NaBH4更好的水解制氢,寻找合适催化剂尤为重要。硼氢化钠水解制氢可加入的催化剂有3种类型,其中贵金属型体系在目前研究较多的有Pt、Ph等纳米材料催化剂[18-19]。其可以使得硼氢化钠更高效的水解制氢,这一过程中该类催化剂也可以展现出良好的催化活性,但因其价格昂贵,并不被广泛应用。而贵金属与非贵金属复合型催化剂的催化活性良好,但其制备成本较高,本实验也不予采用。相反,对于拥有和贵金属催化剂催化活性相似的非贵金属催化剂而言,其兼具廉价易得的独特优点[20]。XU[21]等通过实验验证,相同条件下因非贵金属型催化剂间的协同作用使得该类催化剂用时最短就能达到与其他单金属催化剂相同的效果。因此本实验不仅采用非贵金属制备催化剂,还将利用其间的协同作用将催化剂效果达致最佳。
要想制备出合适的催化剂,其制备方法的选择也很重要。需要注意的是,同种催化剂制备方法不同,会导致催化剂的性能方面有变化。因此,探索出合适的催化剂制备方法尤为重要[22]。
经研究者大量实验验证了催化剂的催化活性、催化的速率等性质,不但跟催化剂本身的组成成分相关,更与该类催化剂的表面微观结构有一定关 联[22]。催化剂可能会因其内部金属粒子的尺寸大小、分布等方面,使得催化剂的催化性能受到损害。而造成上述问题的原因很有可能就是选择了不同的制备方法。目前,对于催化剂的制备方法有很多种,如表1所示。

表1 传统催化剂制备方法
根据以上得出本实验所具备的优势之处:本实验采用非贵金属作催化剂,不仅比以往其他金属的成本降低很多,还利用非贵金属间的协同作用使得催化剂性能更高;TiO2作为催化剂来说,其本身具备半导体材料的优势,可以使得所制催化剂更加稳定、高效;实验制备催化剂的方法选择化学沉积法,不仅工艺流程简单,还能减少很多不必要的污染。
1 实验部分
1.1 载体TiO2的制备
首先称取一定量钛酸四丁酯,再向其中加入盐酸、乙醇、去离子水;将上述药品混合后转移至高压反应釜中,放入80℃的电热恒温干燥箱中加热12 h;待其冷却后,进行离心步骤(水洗2~3次);最后将其干燥、研磨至粉末,备用。
1.2 TiO2/Co-Ni-B催化剂的制备
取2 cm×2 cm的商用泡沫铜作为载体,在开始化学沉积前将上述泡沫铜浸入热碱性溶液以及酸性侵蚀溶液中去,目的为除去油污等杂质。然后再将其放入敏化、活化液中,用去离子水洗净,干燥。最后用分析天平称其重量,确定纯泡沫铜的质量,记为m泡沫铜。
将实验最开始制备的TiO2粉末取0.1 g,将其与适量去离子水结合,放置在超声波清洗器中约0.5 h,以此来获得均匀乳浊液。再向乳浊液中加入适量六水氯化钴、六水氯化镍以及甘氨酸,待其全部均匀分散后,将溶液pH调至11.00,即完成镀液的配制。
待温度达到一定数值时,向上述镀液中加入适量还原剂NaBH4,开始化学沉积法制备所需催化剂,时间分别为5、7、8 min。之后将TiO2/Co-Ni-B/泡沫铜从镀液中取出,将其进行水洗,干燥,称重,记为mTiO2/Co-Ni-B/泡沫铜。
通过以上实验步骤,可以计算出TiO2/Co-Ni-B催化剂的质量:

1.3 催化剂催化NaBH4水解制氢性能检测
圆底烧瓶中加入NaBH4水溶液10 mL(质量分数为4.70%),并将其置于室温下。然后将上述所制得的TiO2/Co-Ni-B催化剂放入圆底烧瓶中,反应产生氢气,实验通过排水法测位移来记录氢气体积。
2 结果与讨论
将在化学沉积不同时间、其他条件均相同下制备的TiO2/Co-Ni-B催化剂分别用于NaBH4室温下水解制氢实验。
其他条件一定的前提下,化学沉积5 min制备催化剂的催化活性如图1所示。由图1可知,该催化剂放氢速率可达5 389.1 mL·min-1·g-1。
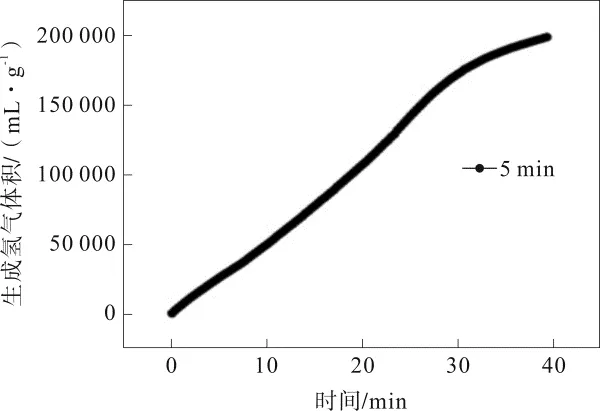
图1 化学沉积5 min时所制TiO2/Co-Ni-B催化剂用于NaBH4水解制氢的催化性能
当其他条件一定的前提下,改变化学沉积法制备催化剂所需时间至7 min,其放氢速率呈增长趋势,如图2所示。沉积7 min反应的放氢速率在该体系中达到最高值,为6 298.1 mL·min-1·g-1。
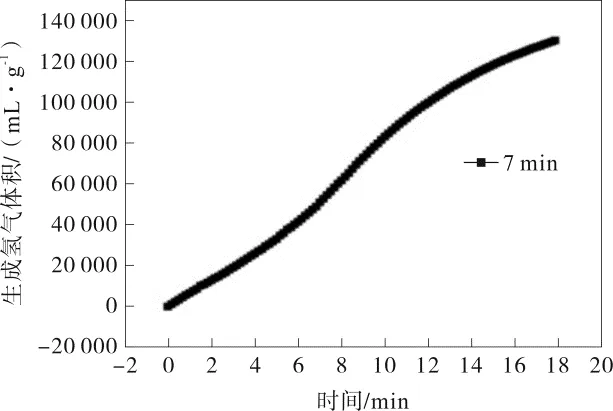
图2 化学沉积7 min时所制TiO2/Co-Ni-B催化剂用于NaBH4水解制氢的催化性能
随着时间延长至8 min,反应放氢的速率呈递减趋势,为4 909.1 mL·min-1·g-1,如图3所示。

图3 化学沉积8 min时所制TiO2/Co-Ni-B催化剂用于NaBH4水解制氢的催化性能图
由上述实验结果表明,实验制备TiO2/Co-Ni-B催化剂时,沉积时间应为7 min,以此得到催化活性较高的催化剂。
不同时间下所制TiO2/Co-Ni-B催化剂催化NaBH4水解制氢速率比较结果如图4所示。

图4 不同时间下所制TiO2/Co-Ni-B催化剂催化NaBH4水解制氢速率比较
由图4能够更加清晰直观地看出,当其他条件相同时,化学沉积7 min相比于实验中的5 min和8 min所制得的催化剂在催化硼氢化钠水解反应中表现出较快的产氢速率。
3 结论
通过化学沉积法制备出以TiO2、泡沫铜为载体的三元非贵金属TiO2/Co-Ni-B催化剂。实验结果表明,在室温下(25℃),pH为11.00、沉积7 min所制备的催化剂在NaBH4水解反应中表现出较高催化活性。
