超声辅助酶法提取罗非鱼皮胶原蛋白及其溶解特性
2022-12-29李家柔倪剑波何静怡许惠雅井璐楠施文正
李家柔,倪剑波,何静怡,许惠雅,井璐楠,施文正,
(1 上海海洋大学食品学院,上海 201306;2 平太荣远洋渔业集团,浙江舟山 316100;3 国家淡水水产品加工技术研发分中心(上海),上海 201306)
人体内富含胶原蛋白[1],以起到支撑、保护组织的作用。外源性胶原蛋白大多来自陆生的哺乳动物[2],目前主要应用于食品工业、生物医药、化工领域等[3]。然而,一些疾病如牛海绵状脑病(疯牛病)的爆发和宗教限制等因素限制了哺乳动物胶原蛋白的应用[4]。与哺乳动物胶原蛋白相比,鱼类胶原蛋白有相似的氨基酸组成及生物相容性[5],且无传播疾病的风险、无宗教限制、吸收能力更强,引起了较多学者的关注[6-7]。据报道,鱼类副产品胶原蛋白含量丰富,特别是鱼皮中含有约70%的Ⅰ型胶原蛋白[8]。
罗非鱼是中国重要的经济养殖鱼类之一,生长快、富含蛋白质[9]。2020年,中国罗非鱼产量和罗非鱼加工品产量分别为165万t和55万t[10],但罗非鱼加工品形式单一,主要为整鱼冷冻和冷冻鱼片[9],副产物如鱼皮、鱼鳞、鱼骨等未得到有效利用,造成资源浪费和环境污染。罗非鱼皮中胶原蛋白质量分数为20.65%,约占其粗蛋白的62.30%[11],是良好的胶原蛋白来源。
超声作为一种绿色加工技术,不但广泛应用于食品加工的各个环节,也被用来提取天然活性产物[12]。利用超声技术不但可以在较短的时间内完成提取过程,而且能降低溶剂消耗,得到更高纯度的产品[13]。邹烨等[14]利用超声辅助胃蛋白酶,以乙酸为溶剂提取中华鳖裙边胶原蛋白,得率高达74.5%,且与酶提取法所得胶原蛋白相比,热稳定性显著提高;李根等[15]使用超声辅助酶法提取鲵皮胶原蛋白,得率(37.36%)是酶法提取的两倍多,且发现超声处理改变了鲵皮表面结构,使胶原蛋白更易溶出。目前尚未有研究给出超声辅助酶法提取罗非鱼皮胶原蛋白的最佳工艺,使其在工业化的提取应用上受限。常规酶法提取鱼类胶原蛋白得率约为10%~30%,效率低下且耗时较长[15-18]。
本研究采用超声辅助胃蛋白酶法提取罗非鱼皮胶原蛋白,进行响应面优化得到使胶原蛋白得率较高的最佳提取工艺,使罗非鱼皮胶原蛋白得到高效充分的利用,为罗非鱼皮胶原蛋白的工业化提取以及在食品中的开发利用提供了理论依据。
1 材料与方法
1.1 材料与试剂
罗非鱼购于上海市浦东新区南汇新城镇水产店,取鱼皮去鳞除杂后,于-80 ℃冷冻备用;氢氧化钠、氯化钠、无水碳酸钠、正丁醇、五水合硫酸铜等均为分析纯,胃蛋白酶(3000 U/g),国药集团化学试剂有限公司;乙酸、酒石酸钾钠均为分析纯,牛血清白蛋白(生物技术级,96%),上海迈瑞尔化学技术有限公司;福林酚试剂,合肥博美生物科技有限责任公司。
1.2 仪器与设备
SCIENTZ-10N型冷冻干燥机、SB-400DTY型超声多频清洗机,宁波新芝生物科技股份有限公司;UV-1800PC型紫外可见分光光度计,上海美谱达仪器有限公司;H-2050R型高速冷冻离心机,长沙湘仪有限公司;HH-6型数显恒温搅拌水浴锅,常州鸿泽实验科技有限公司。
1.3 试验方法
1.3.1 原料前处理
去除杂蛋白:用NaOH溶液(0.1 mol/L)浸泡鱼皮24 h(m∶V=1∶20),间隔12 h重新更换溶液以达到最佳的去除效果,之后用蒸馏水冲洗备用。
脱脂:用10%正丁醇溶液进行浸泡,其他条件同上述步骤。
1.3.2 罗非鱼皮胶原蛋白的提取
超声辅助酶法提取:将经前处理后的罗非鱼皮剪碎(0.5×0.5 cm2),每组鱼皮用量为2 g,加入0.5 mol/L 乙酸溶液(m∶V=1∶40),再加入一定量的胃蛋白酶,酶解液pH为2左右,在25 kHz 频率下用一定功率超声处理一定时间,4 ℃搅拌18 h,离心(10 000×g,离心半径r=10 cm)30 min后,收集上清液,在沉淀中再次加入0.5 mol/L 乙酸溶液(m∶V=1∶10)及胃蛋白酶,进行超声、搅拌、离心(条件同上)。收集上清液,加入NaCl使其最终浓度为0.9 mol/L,10 000×g(离心半径r=10 cm)离心30 min后,将沉淀溶于乙酸溶液进行透析,于-80 ℃ 冷冻过夜,真空冷冻干燥后即可得到胶原蛋白粉末。
常规酶法提取:取剪碎的罗非鱼皮2 g,加入0.5 mol/L 乙酸溶液(m∶V=1∶40),再加入1.67%胃蛋白酶,酶解液pH为2左右,4 ℃磁力搅拌48 h[19],离心(10 000×g,离心半径r=10 cm)30 min后,收集上清液,在沉淀中再次加入0.5 mol/L 乙酸溶液(m∶V=1∶10)及1.67%胃蛋白酶,进行搅拌、离心(条件同上)。收集上清液,加入NaCl使其最终浓度为0.9 mol/L,10 000×g(离心半径r=10 cm)离心30 min后,将沉淀溶于乙酸溶液进行透析,于-80 ℃ 冷冻过夜,真空冷冻干燥后即可得到胶原蛋白粉末。
胶原蛋白得率由下式计算:
(1)
式中:y为胶原蛋白得率;m1为冷冻干燥后胶原蛋白粉末质量/g;m2为鱼皮质量/g。
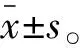
1.3.3 单因素试验
在前期试验基础上,设定提取溶剂为乙酸(5 mol/L)、料液比为1∶40、超声频率为25 kHz。以胶原蛋白得率为指标,探究超声功率(100、150、200、250、300 W)、超声时间(15、20、25、30、35 min)、加酶量(0.75%、1.00%、1.25%、1.50%、1.75%)等因素的影响,每个水平进行3次平行试验,取均值。
1.3.4 响应面优化试验
以胶原蛋白得率为响应值,设计响应面试验,各因素与水平如表1所示。

表1 响应面试验因素与水平
1.3.5 紫外可见光谱分析
参考邢瀚文等[21]的方法,以乙酸溶液(0.5 mol/L)为溶剂,配制1 mg/mL的胶原蛋白溶液,在10 000×g(离心半径r=10 cm)的条件下离心10 min,取上清液,紫外扫描范围为200~400 nm。
1.3.6 溶解度分析
参考Chen等[22]的方法并稍做改动,将胶原蛋白样品用乙酸溶液(0.5 mol/L)溶解,使其质量浓度为3 mg/mL,取8 mL样品溶液,分别调pH为1、2、3、4、5、6、7、8、9、10,室温下搅拌30 min后,加入蒸馏水(调至相应的pH)使其达到10 mL。室温下再次搅拌30 min后,于4 ℃在10 000×g(离心半径r=10 cm)条件下离心30 min,上清液蛋白浓度通过 Lowry法[23]进行测定。蛋白相对溶解度(%)由每个pH条件下蛋白浓度与最高蛋白浓度比值计算。
1.3.7 数据处理
使用 IBM SPSS Statistics 23.0进行单因素ANOVA检验、显著性分析(P<0.05)及Duncan多重比较;使用Design-Expert 10进行响应面优化;使用Origin 2018作图。
2 结果与分析
2.1 单因素试验结果
2.1.1 超声功率对胶原蛋白得率的影响
由图1得,胶原蛋白得率在超声功率为150 W时达到最大,之后随着超声功率的增大,胶原蛋白得率逐渐减小。

图1 超声功率对胶原蛋白得率的影响
一定的功率范围内,超声产生的空化效应和机械效应可修饰酶的结构,暴露其活性位点,提高酶的活力[24]。超声作用还可改变底物特性,使胶原蛋白更易溶解于提取溶剂中[25],为胶原蛋白的提取提供最佳条件。超声功率过大时,会产生显著的热效应,降低酶的活性甚至使其失活,影响胶原蛋白得率。水产胶原热变性温度较低,温度过高也会破坏胶原蛋白的结构,从而降低胶原蛋白得率。所以,选取最佳超声功率为150 W。
2.1.2 超声时间对胶原蛋白得率的影响
由图2 可以看出,胶原蛋白得率随超声时间延长呈现先增高后降低的趋势,在超声时间为25 min时提取率最高,为49.53%。

图2 超声时间对胶原蛋白得率的影响
之后,胶原蛋白得率随超声时间的增长而明显降低(P<0.05),说明超声作用时间对胶原蛋白的得率有较大的影响。适当的超声作用时间可使酶与底物充分反应,促进胶原蛋白的溶出。长时间的超声作用会产生较高能量,使环境介质的温度变高,对酶的活性以及胶原蛋白的分子结构造成一定影响[26],使胶原蛋白得率下降。因此,要严格控制超声时间,选取25 min为最佳条件。
2.1.3 加酶量对胶原蛋白得率的影响
由图3可知,加酶量在0.75%~1.50%范围内,胶原蛋白得率随加酶量的增大而提高,在加酶量为1.5%时达到最大,继续增大加酶量胶原蛋白得率开始降低。在加酶量为1.0%~1.5%范围内,胶原蛋白得率与加酶量几乎呈现线性关系,这是由于,底物充足的条件下,酶促反应速率受酶浓度影响,适当增添酶量可以使底物与酶尽可能反应,进而提高胶原蛋白得率。继续增大加酶量时,底物与酶完全反应,酶浓度过高反而会产生抑制作用,导致胶原蛋白降解[14,27]。鉴于此,最适加酶量定为1.5%。

图3 加酶量对胶原蛋白得率的影响
由国标法测得冻干后胶原蛋白粉中的水分含量为:UPSC(4.52%±0.10%),PSC(4.38%±0.06%),不同批次的胶原蛋白粉水分含量相同。
2.2 响应面试验结果与分析
2.2.1 数学模型的建立与显著性分析


表2 响应面试验设计与结果

表3 回归模型方差分析
2.2.2 因素间交互作用影响结果
由图4可观察到,超声功率和加酶量(X2X3)的等高线图为椭圆形,说明其交互作用显著[31]。此模型下,使蛋白得率较高的条件为:超声时间26.015 min、超声功率164.804 W、加酶量1.67%,胶原蛋白得率为62.37%。为方便操作,调整提取条件为超声时间26 min、超声功率165 W、加酶量1.67%,验证试验所得胶原蛋白得率为62.26%,接近模型计算的理论值。常规酶法所提的胶原蛋白得率仅为29.02%,超声辅助酶法不但缩短了提取时间,而且显著提高了蛋白得率,为罗非鱼皮胶原蛋白的高效提取提供了依据。

图4 不同因素间交互作用的响应面和等高线图
2.2.3 紫外光谱分析
在紫外光谱中,由于—C=O、—COOH、—CONH2等基团的存在,胶原蛋白在210~240 nm之间存在特征吸收峰[32]。由图5可知,UPSC和PSC都在230 nm处有最大吸收峰,与Ι型胶原蛋白特征一致,且与鲵皮胶原蛋白[15]以及中华鳖胶原蛋白[33]紫外吸收峰相似。UPSC和PSC在280 nm处无明显的吸收峰,说明其几乎不含芳香族氨基酸。以上结果表明,超声辅助酶法提取到的胶原蛋白为典型的Ι型胶原蛋白。

图5 罗非鱼皮胶原蛋白紫外光谱分析
2.2.4 溶解度分析
图6 显示了UPSC和PSC在不同pH条件下的相对溶解度,可以看出二者均在酸性条件下有较高的溶解度。

图6 不同pH下胶原蛋白相对溶解度
UPSC和PSC的最大溶解度分别在pH=5及pH=6处,随着pH继续增大,相对溶解度显著降低(P<0.05),均在pH =7左右达到最小,而后又在碱性条件下随pH增加有所上升。这是由于在胶原蛋白等电点(pI=7)处,蛋白分子净电荷为0,疏水作用力增强,使胶原蛋白相对溶解度下降;当pH高于或低于等电点时,蛋白分子间的电荷斥力会增大蛋白的相对溶解度。同时可以观察到,在酸性pH范围内,UPSC的相对溶解度均高于PSC,这与Zou等[33]研究结果相似,他们发现经超声处理的酸溶性蛋白比常规酸法提取所得的胶原蛋白溶解度高,这为胶原蛋白在食品工业的应用提供了借鉴。
3 结论
本研究对超声辅助酶法提取罗非鱼皮胶原蛋白的提取条件进行了响应面优化,最优提取工艺为:超声功率165 W、超声时间26 min、加酶量1.67%,此工艺下胶原蛋白得率高达62.26%,约为常规酶法提取得率(29.02%)的两倍。此法高效简便,既缩短了提取时间,又显著提高了罗非鱼皮胶原蛋白得率。紫外光谱扫描结果表明,UPSC在230 nm处有最大吸收峰,为典型的Ι型胶原蛋白。溶解性试验表明,在酸性条件下,与PSC相比,UPSC具有更高的相对溶解度。因此,超声辅助酶法是一种简便高效的提取方法,适合罗非鱼皮胶原蛋白的工业化生产。未来可进一步探讨超声辅助对于罗非鱼皮胶原蛋白各项物理化学性质的影响及变化机制,使罗非鱼皮胶原蛋白得到差异化利用。
□
