肾小球C3 沉积在儿童原发性膜性肾病中临床及预后意义
2022-12-28王忍夏正坤张沛高春林
王忍 夏正坤 张沛 高春林
东部战区总医院儿科(江苏南京 210002)
原发性膜性肾病(primary membranous nephropathy,PMN)是一种自身免疫性疾病,以IgG和补体C 3 在肾小球毛细血管襻上皮下沉积为特征。研究表明,补体系统在PMN的发病中起重要作用,上皮下免疫复合物激活补体形成C5b-9膜攻击复合物导致足细胞损伤和蛋白尿发生。磷脂酶A 2受体相关性膜性肾病(phospholipase A 2 receptorassociated membranous nephropathy,PLA2R-MN)的主要IgG 亚型IgG 4 通过甘露糖结合凝集素途径(mannose-binding lectin pathway,MBL)或补体旁路途径(alternative complement pathway,AP)激活补体系统[1]。EXT1(exostosin 1)/EXT2(exostosin 2)、神经表皮生长因子样-1蛋白(neural epidermal growth factor like-1 protein,NELL-1)和信号素3B相关性膜性肾病的IgG亚型以IgG1为主,更多可能通过经典途径(classical pathway,CP)激活补体系统[1]。继发性膜性肾病(secondary membranous nephropathy,SMN)中,C 1 q 或IgG 1 或IgG 3 沉积参与补体经典途径的激活[2]。
C3参与补体激活的经典途径和补体旁路途径,然而,目前有关肾小球C 3 沉积对PMN 临床和预后的影响尚未明确。本研究比较肾小球C 3 免疫荧光染色低强度(low intensity,LI)组和高强度(high intensity,HI)组的临床病理特征、治疗及远期预后,探讨肾小球C 3 沉积在儿童PMN 中的临床和预后意义。
1 对象与方法
1.1 研究对象
回顾性收集2008 年1 月至2020 年12 月就诊东部战区总医院儿科经肾穿刺诊断为PMN 患儿的临床资料。纳入标准为:①肾穿刺确诊为PMN;②年龄≤18 岁;③随访时间≥6 个月。排除标准:①SMN(由系统性红斑狼疮、乙型或丙型肝炎病毒、恶性肿瘤和药物等引起);②肾穿时估计肾小球滤过率(estimate glomerular filtration rate,eGFR)<15 mL·min-1·1.73 m-2;③临床资料不全。
本研究获得东部战区总医院伦理委员会批准(审批号:2019NZGKJ-067),获得所有患儿和/或监护人的知情同意。
根据肾脏病理免疫荧光染色肾小球C 3 染色强度分为LI 组和HI 组,LI 组为肾小球C 3 染色强度<++的患儿,HI 组为肾小球C 3 染色强度≥++的患儿。
1.2 方法
1.2.1 临床资料收集 研究基线为肾穿刺的时间,通过医院门诊和住院系统收集患儿肾穿刺时的临床病理特征,门诊或电话收集患儿的随访数据(尿蛋白、血肌酐、治疗方案等)。
1.2.2 肾组织学检查 肾脏病理由2 名病理医师评估,所有样本经光镜(HE、Masson、PASM 染色)、免疫荧光(IgG、IgA、IgM、C1q、C3)和电镜检查。IgG、IgA、IgM、C 1 q、C 3 免疫荧光染色强度采用0~3 半定量评分法测定:0 为阴性;1 为弱;2 为中等;3 为强阳性。根据Ehren-reich-Churg 分期标准[2]将PMN 病理分为4 期。间质纤维化和肾小管萎缩(interstitial fibrosis and tubular atrophy,IFTA)采用半定量量表从0 到3 进行分级:0 为正常;1 为轻度,间质病变<25%;2 为中度,25%<间质病变<50%;3为重度,间质病变>50%。
1.2.3 相关定义 主要终点定义为终末期肾病(end-stage renal disease,ESRD),次要终点定义为完全缓解(CR)和部分缓解(PR)。年龄<16岁的患者使用Schwartz 公式计算eGFR,年龄≥16 岁的患者使用慢性肾脏病流行病学公式(CKD-EPI)计算eGFR。ESRD定义为eGFR<15 mL·min-1·1.73 m-2和需要肾脏替代治疗。儿童CR和PR的诊断依据儿童激素敏感、复发/依赖的肾病综合征诊治循证指南(2016)[3],CR定义为血生化及尿检查完全正常,PR定义为晨尿蛋白阳性(≤++)和/或水肿消失、血清白蛋白>25 g/L,未缓解(NR)定义为晨尿蛋白≥+++。成人CR定义为24 h尿蛋白定量<0.3 g/L伴eGFR>60 mL·min-1·1.73 m-2;PR定义为24 h尿蛋白定量减少>50%(基线时表现为肾病范围蛋白尿的患者24 h尿蛋白定量需<3.5 g/L)伴持续稳定的eGFR(±25%)或eGFR改善;NR定义为24 h尿蛋白定量>3.5 g,且下降幅度小于基线水平的50%。达ESRD时间指从研究基线(肾穿刺)至患者最开始进展至ESRD的时间。
1.3 统计学分析
使用SPSS 19.0 统计软件对数据进行分析。计量资料符合正态分布的以均数±标准差表示,两组间比较采用两独立样本t检验;非正态分布的以M(P25~P75)表示,组间比较采用Wilcoxon 秩和检验。计数资料以例数(百分比)表示,组间比较采用χ2检验。采用Kaplan-Meier 法和log-rank 检验比较肾小球C 3 染色LI 组和HI 组的远期肾脏预后。采用log-rank 检验和Cox 回归分析影响PMN 患儿达ESRD 的危险因素。以P<0.05 为差异有统计学意义。
2 结果
2.1 LI组与HI组间临床和肾脏病理特征比较
本院就诊经肾穿刺确诊为PMN 的患儿共268例,排除36例随访时间<6个月的患儿和19例临床资料不全的患儿,最终共213例患儿纳入研究。根据肾脏病理免疫荧光染色肾小球C 3 染色强度分为LI组(92例)和HI组(121例)。与LI组相比,HI组年龄较大,24 h尿蛋白定量较高,血清白蛋白和eGFR水平较低,大量蛋白尿、IgG 免疫荧光染色强度+++、IFTA分级为中度的比例较高,差异均有统计学意义(P<0.05)。见表1。
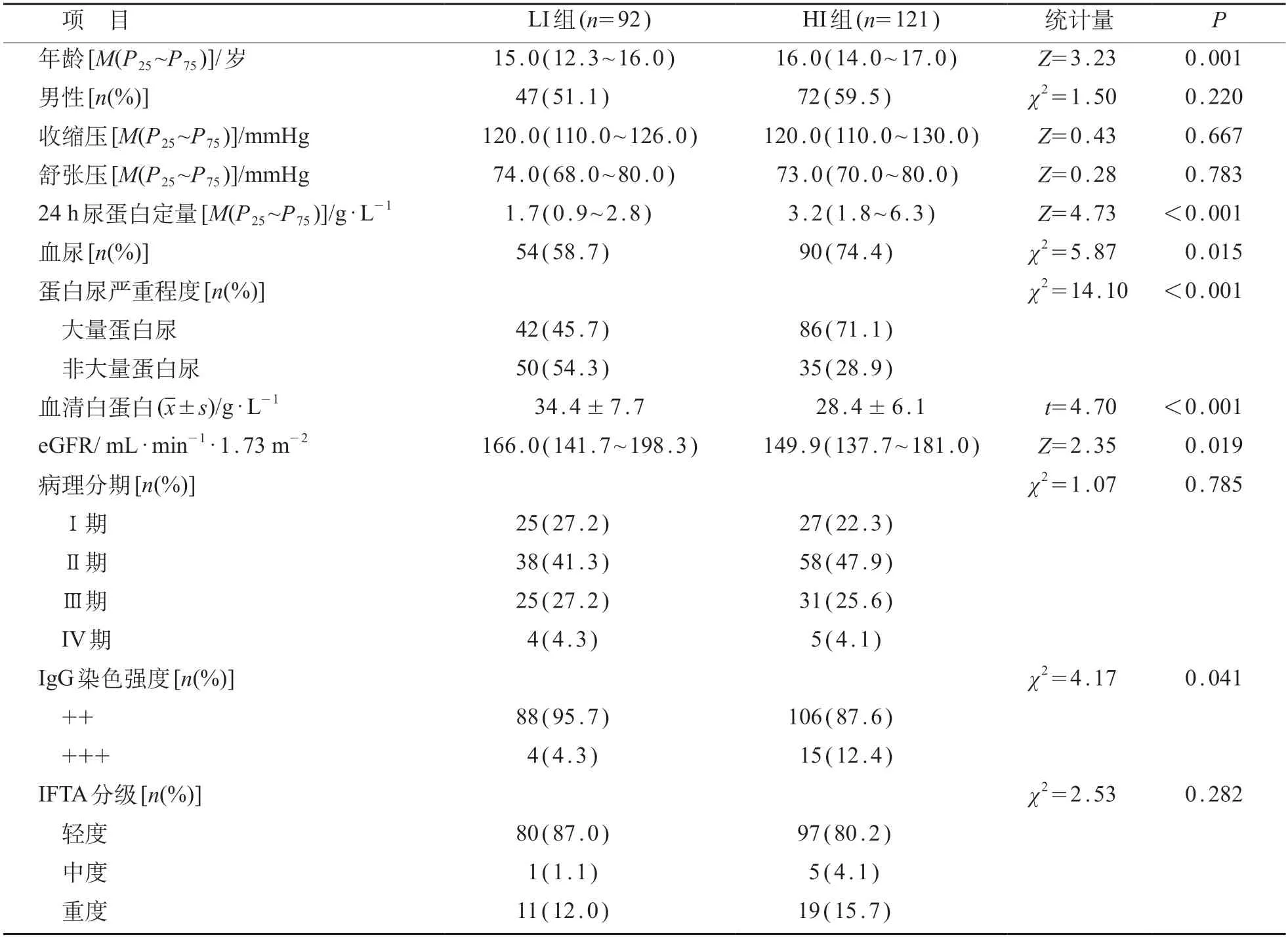
表1 肾小球C3染色LI组与HI组临床和肾脏病理特征比较
2.2 肾小球C 3 染色LI 组与HI 组治疗方案和转归比较
LI组与HI组患者末次随访时的eGFR和24 h尿蛋白量差异均无统计学意义(P>0.05)。LI组环磷酰胺的使用率高于HI组,差异有统计学意义(P<0.05)。
经过43.0(13.0~85.0)月的随访,LI组92例完成随访,其中1例患儿进展至ESRD,其余91例在随访终点时未进展至ESRD;68例患儿的转归为CR和PR,24 例转归为NR。经过57.0(20.0~86.0)月的随访,HI组121例完成随访,5例患儿进展至ESRD,116例未进展至ESRD;86例转归为CR和PR,35例转归为NR。两组患儿之间治疗转归差异无统计学意义(P>0.05)。见表2。
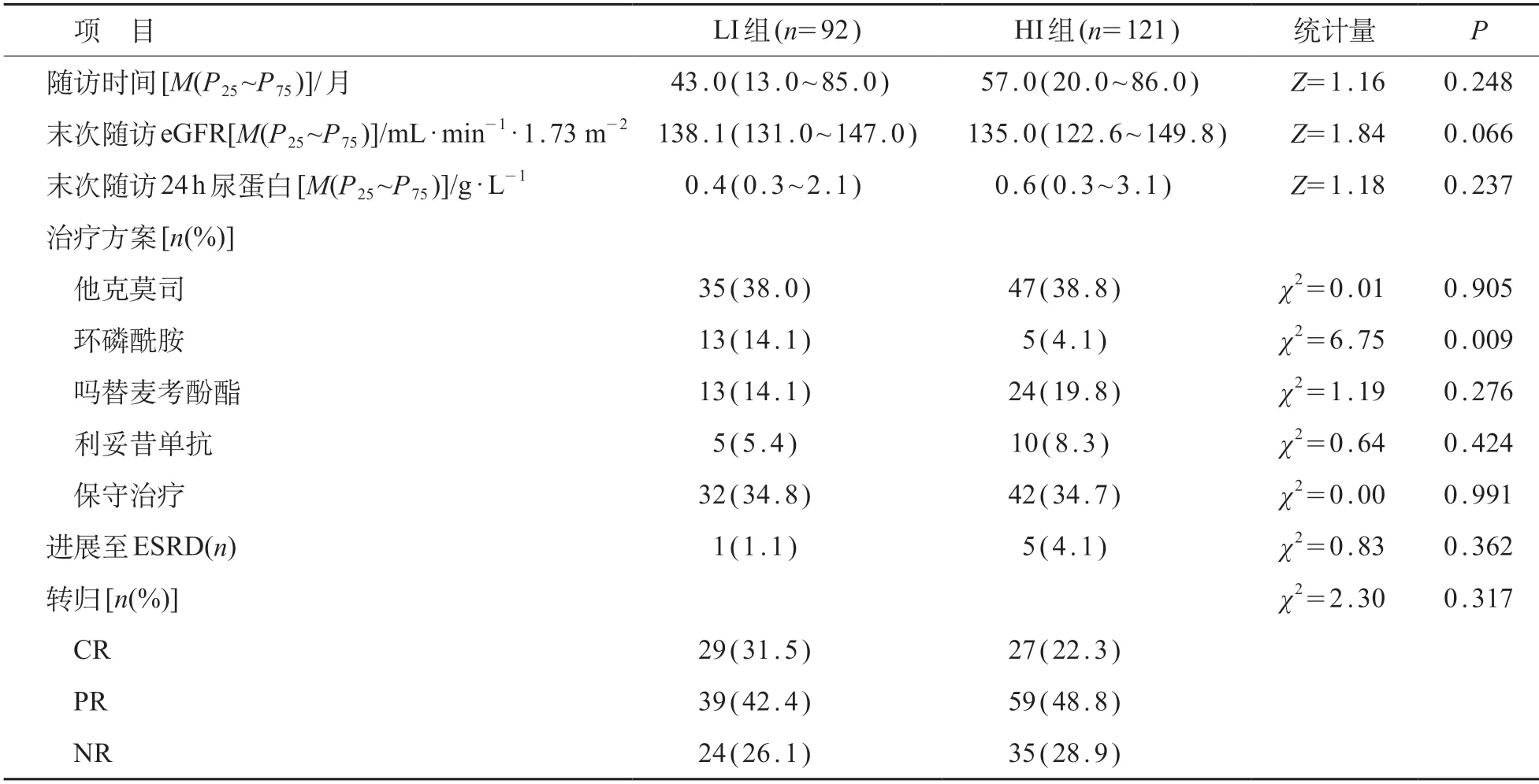
表2 肾小球C3染色LI组与HI组治疗方案和转归比较
2.3 LI组与HI组远期预后比较及与预后相关的危险因素分析
使用Kaplan-Meier 法比较LI 组与HI 组患者进展至ESRD的累积肾脏生存率(图1)和累积缓解率(图2),经log-rank 检验发现两组患者进展至ESRD的远期累积肾脏生存率(χ2=0.56,P=0.454)和远期累积缓解率(χ2=2.85,P=0.091)差异均无统计学意义。

图1 肾小球C3 染色LI 组与HI 组达ESRD 的累积肾脏生存率

图2 肾小球C3 染色LI 组与HI 组患儿的累积缓解率
以PMN 患儿ESRD 为终点状态,采用log-rank检验比较不同组间达ESRD 时间差异,发现基线时eGFR≤90 mL·min-1·1.73 m-2,达ESRD时间较短,差异有统计学意义(P<0.05)。见表3。进一步采用多因素Cox回归分析,发现基线时eGFR增加是延长患儿病情进展至ESRD的独立保护因素(HR=0.96,95%CI:0.929~0.987)。

表3 Log-rank检验比较213例PMN患儿不同组间达ESRD时间
3 讨论
PMN是一种自身免疫系统疾病,既往已有强有力的证据表明补体激活是组织损伤和蛋白尿发生的先决条件[4]。PLA 2 R-MN 的主要亚型IgG 4 不激活经典途径,因此,PMN C1q沉积通常较弱或呈阴性。实验证据表明IgG 4可以激活补体凝集素途径。IgG1的膜性肾病亚型(EXT1/EXT2,NELL-1和信号素3 B)主要激活补体经典途径。无论是哪种途径发起补体级联反应,补体旁路途径的作用很可能是放大并维持补体激活,并导致形成膜攻击复合物(membrane attack complex,MAC)C5b-9[5]。既往研究表明,C 3 b 的沉积、MAC 和尿中C 3 dg 的排泄与补体旁路途径有关[6]。本研究回顾性分析肾小球C3沉积在儿童PMN中的临床和预后意义。
PMN 患者免疫荧光通常表现为IgG 和C 3 沿肾小球毛细血管袢分布,这些免疫沉积物被认为是原发性免疫机制的结果。之前的研究已探讨PMN 的组织病理学参数与预后之间的关系,但结果差异较大[7-8],且补体沉积与临床病理学表现也相互矛盾。相关研究发现,与LI-C 3 相比,HI-C 3 患者血清抗PLA2R抗体阳性率较高,尿蛋白排泄和血清肌酐水平较高,血清白蛋白水平较低,但肾小球C3沉积并不能预测肾脏不良预后[9]。另有研究报道肾小球C3沉积与ESRD 无关[10]。然而,有研究证明了补体沉积与肾脏进展之间的密切关系,但由于半定量和未经验证的分级系统以及用于评估补体沉积试剂的特异性变化,该研究不能对结果作出准确的判断[11]。本研究中,肾小球HI-C3组基线时的24 h尿蛋白定量、大量蛋白尿患者的比例均高于LI-C3组,血清白蛋白水平和eGFR 均低于LI-C 3组,且肾小球C3 沉积并不是进展至ESRD 的危险因素。研究结果的差异主要原因为不同研究的随访时间和肾小球C 3 沉积分类不同,以及不同人群疾病病程不同。
本研究中,男性并不是ESRD的预测因素。尽管之前的研究表明,男性与不良预后相关[12-13],但此结果尚未得到所有的研究证实[14]。一般来说,蛋白尿和/或低白蛋白血症的程度被认为是疾病严重程度的主要决定因素[15],与本研究结果一致;而有研究表明大量蛋白尿与ESRD无关[16],相关研究也发表了类似的结果[17]。这一发现可能受到非特异性支持治疗的影响如肾素血管紧张素系统阻断,以及与研究样本量较小有关。本研究中,由于儿童膜性肾病缺乏标准的治疗方案,HI-C 3 患者环磷酰胺使用较少可能会影响研究结果。
本研究具有回顾性研究存在的局限性。部分患者肾穿刺时未检测抗PLA2R抗体,肾组织未行PLA2R染色。因此,我们未分析肾小球C 3 沉积与血清抗PLA2R抗体水平之间的关系。另外部分患者在肾穿刺前已接受治疗,因此对研究结果会产生一定的影响。
综上,广泛的肾小球C 3 沉积不是儿童PMN 患者肾功能衰竭的预测因子。
