肺孤立性结节样腺癌PET/CT表现与丙酮酸激酶M2、硒结合蛋白-1表达的相关性
2022-12-28赵佳佳邢媛媛贾丽美
赵佳佳,邢媛媛,张 欣,贾丽美,杨 杰
(承德医学院附属医院核医学科,河北 承德 067000)
孤立性肺结节恶变率达50%,早期诊断极为重要[1-2];PET/CT可为鉴别诊断肺良、恶性肿瘤提供参考[3]。丙酮酸激酶M2(pyruvate kinase M2, PKM2)为糖酵解限速酶,其表达升高可促进恶性肿瘤生长、增殖[4]。硒结合蛋白-1(selenium binding protein 1, SBP-1)是硒在人体中的存在形式,在食管癌、肺癌及乳腺癌等实体肿瘤中呈低表达[5]。本研究观察肺孤立性结节样腺癌PET/CT表现与PKM2和SBP-1表达的相关性。
1 资料与方法
1.1 一般资料 选取2020年3月—2021年12月承德医学院附属医院101例肺孤立性结节样腺癌患者(观察组),男58例、女43例,年龄40~75岁、平均(57.5±5.5)岁;临床Ⅰ期31例、Ⅱ期58例、Ⅲ期12例;低分化10例、中分化60例、高分化31例。纳入标准:①经病理学确诊肺腺癌;②接受肺癌根治术;③患者及家属签署知情同意书。排除标准:①肺部其他疾病;②其他部位恶性肿瘤;③肺癌根治术前接受放射和/或化学治疗;④重要脏器器质性病变。另纳入68例肺良性肿瘤患者作为对照组,男40例、女28例,年龄42~75岁、平均(58.5±4.3)岁;其中肺错构瘤42例,肺软骨瘤18例,肺纤维瘤5例,肺血管瘤2例及肺脂肪瘤1例。本研究经院伦理委员会审核批准。
1.2 仪器与方法 嘱患者检查前禁食6 h,控制其空腹血糖不超过7.4 mmol/L。经静脉注射18F-FDG 3.70~4.81 MBq/kg体质量后,嘱患者安静休息1 h。采用Siemens Biograph mCT-S 64 PET/CT显像仪及住友HM-10mev医用回旋加速器,嘱患者仰卧、上举双臂,行早期显像,扫描范围自颅底至股骨中段;参数:螺距0.8,管电压120 kV,转速0.5 s/rot,层厚3 mm,每个床位采集2 min,共采集6~7个床位。90 min后,以肺部病灶为中心行延迟显像,参数同前;以标准有序子集最大期望值迭代法及CT衰减校正进行自动图像融合。
由2名具有10年工作经验的核医学副主任医师采用盲法阅片,记录肺部病灶形态、部位、大小及边缘,获取其最大标准摄取值(maximum standard uptake value, SUVmax)、峰值标准摄取值(peak standard uptake value, SUVpeak)及肿瘤代谢体积(metabolic tumor volume, MTV);产生分歧时,提请另1名具有15年以上工作经验的主任医师决定。
1.3 PKM2和SBP-1检测 针对观察组手术切除标本及对照组活检组织行常规切片、脱蜡,以3%过氧化氢去离子水封闭10 min,以0.01 mol/L磷酸盐缓冲液(phosphate buffer saline, PBS)行热修复;自然冷却后,以山羊血清封闭30 min,加入三重基序蛋白25(tripartite motif-containing protein 25, TRIM25)单克隆抗体,于4℃条件下过夜;复温后加入山羊抗兔荧光二抗,于37℃下孵育1 h;加入显色剂,依次行苏木素复染、梯度乙醇脱水、二甲苯透明、中性树胶封片等,最后置于荧光显微镜下观察。设置阴性样本,以PBS替代一抗,其余步骤同上。
将PKM2和SBP-1染色程度分为无染色(0分)、弱染色(1分)、中度染色(2分)及强染色(3分);PKM2染色细胞比例分为未见染色细胞(0分)、0<染色细胞<25%(1分)、染色细胞25%~50%(2分)、51%~75%(3分)及>75%(4分),SBP-1染色细胞比例分为未见染色细胞(0分)、染色细胞<10%(1分)、10%~50%(2分)、51%~75%(3分)及>75%(4分)。计算染色指数:染色指数=染色程度×染色细胞比例;以同组PKM2/SBP-1染色指数中位数为分界点,<该值为PKM2/SBP-1低表达,≥该值为PKM2/SBP-1高表达。
1.4 统计学分析 采用SPSS 22.0统计分析软件。以±s表示符合正态分布的计量资料,行独立样本t检验;采用χ2检验比较计数资料。行Spearman相关性分析,评估参数的相关性。P<0.05为差异有统计学意义。
2 结果
2.1 一般资料 2组患者性别、年龄、体质量指数、吸烟情况、高血压、冠心病及糖尿病占比差异均无统计学意义(P均>0.05),见表1。
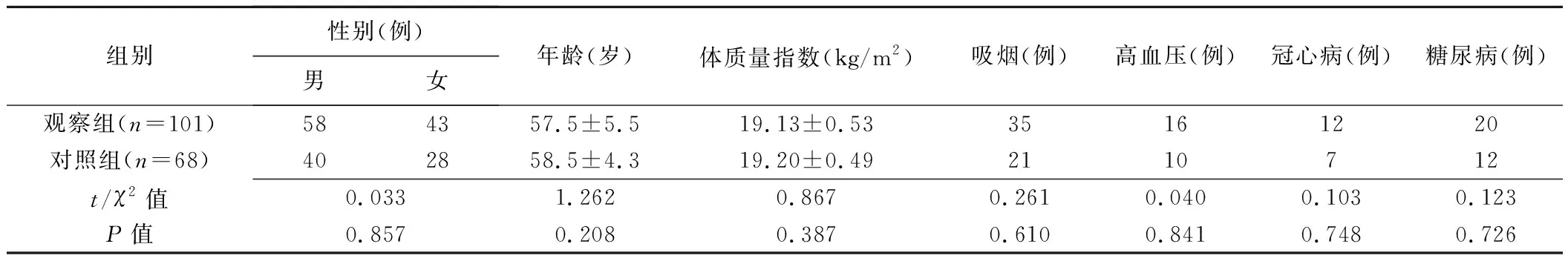
表1 肺孤立性结节样腺癌与良性肺肿瘤患者一般资料比较
2.2 PKM2和SBP-1表达 观察组病灶PKM2高表达率高于(P<0.001)、SBP-1高表达率低于对照组(P<0.001)。见表2。
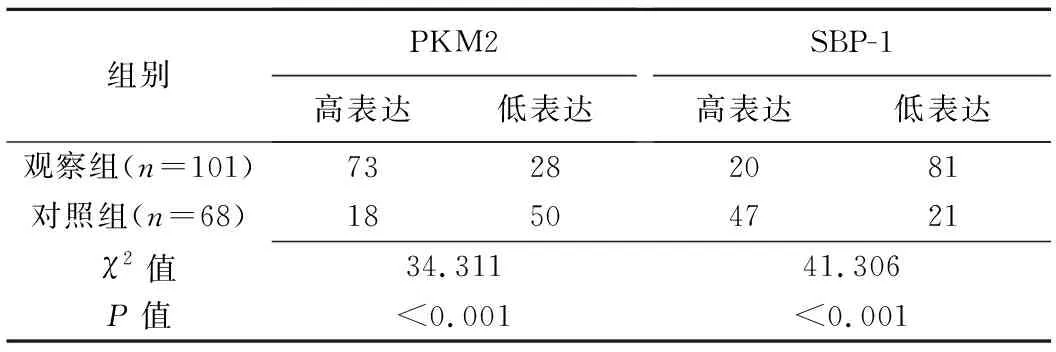
表2 肺孤立性结节样腺癌与良性肺肿瘤PKM2和SBP-1表达比较(例)
2.3 PET/CT参数 观察组病灶SUVmax、SUVpeak及MTV均高于对照组(P均<0.05),见表3及图1、2。
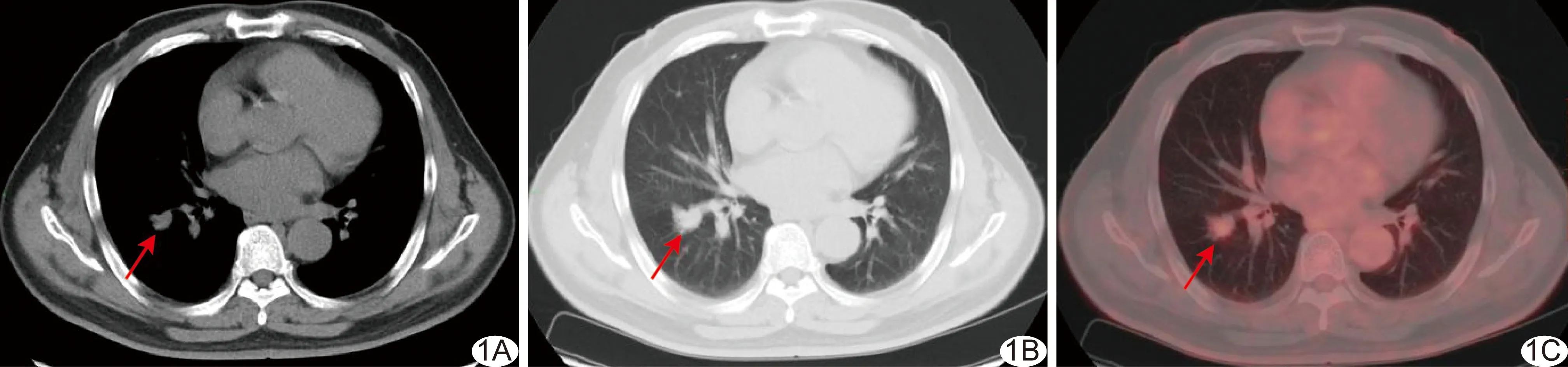
图1 观察组患者,男,55岁,肺腺癌 A.胸部纵隔窗CT图示右肺下叶软组织结节,密度均匀、边缘不规则; B.胸部肺窗CT图示右肺下叶结节边缘不清,可见分叶征及毛刺征; C.胸部PET/CT融合图示右肺下叶结节FDG代谢明显增高 (箭示病灶)
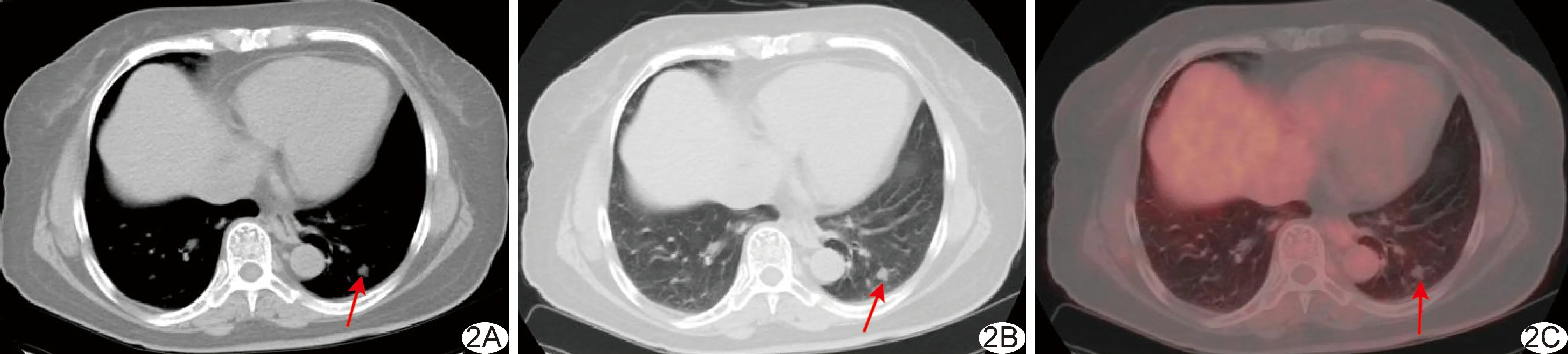
图2 对照组患者,男,48岁,肺错构瘤 A.胸部纵隔窗CT图示左肺下叶软组织结节,密度较不均匀、边缘较光滑; B.胸部肺窗CT图示左肺下叶结节可见分叶征; C.胸部PET/CT融合图示左肺下叶结节FDG代谢未见明显异常 (箭示病灶)
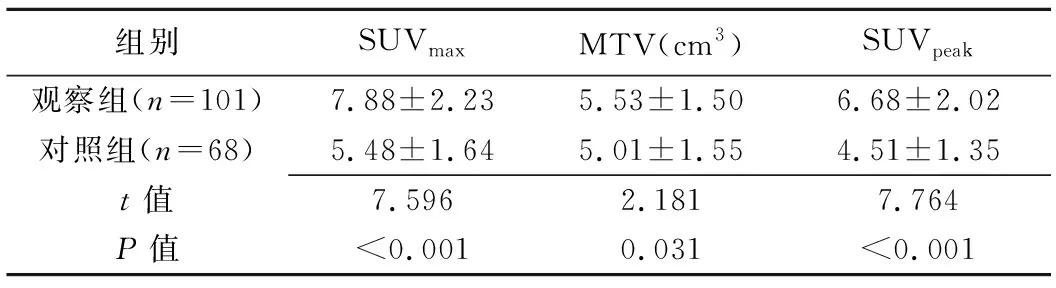
表3 肺孤立性结节样腺癌与良性肺肿瘤PET/CT参数比较
2.4 相关性分析 观察组内,PKM2高表达结节出现分叶征、多边形/不规则形和胸膜凹陷征占比及其SUVmax、SUVpeak及MTV均高于PKM2低表达结节(P均<0.05),见表4;SBP-1高表达结节出现分叶征和胸膜凹陷征占比及其SUVmax、SUVpeak及MTV均低于SBP-1低表达结节(P均<0.05),见表5。
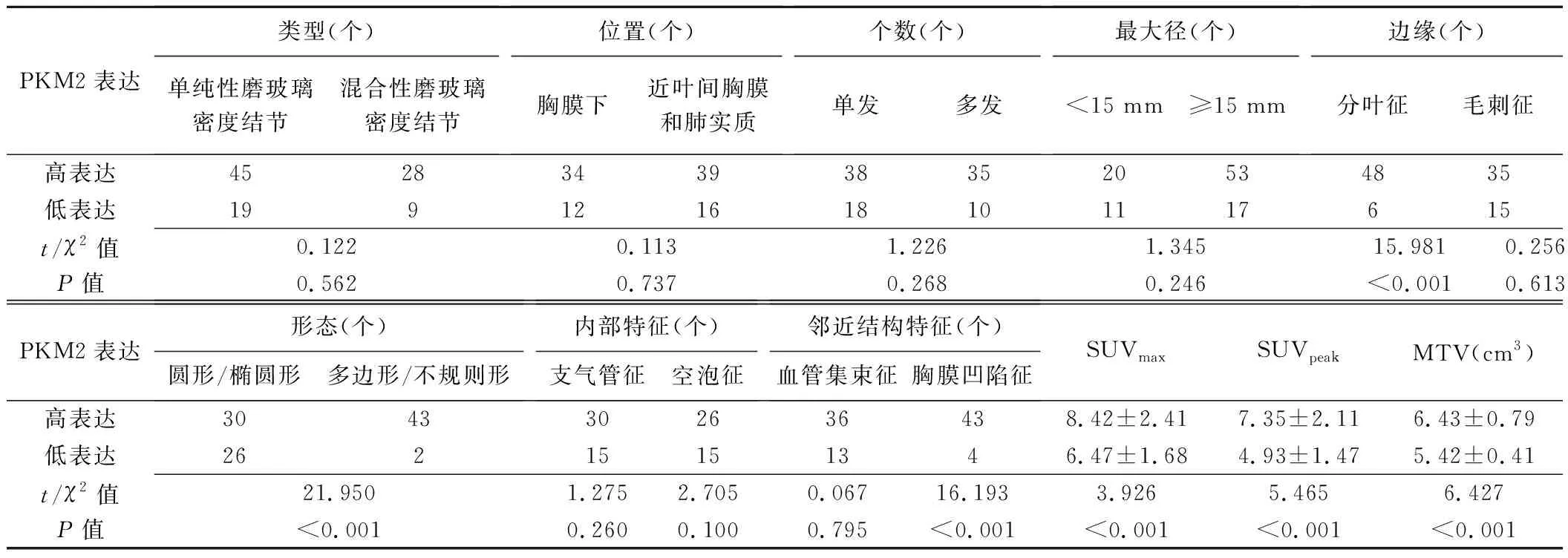
表4 高、低表达PKM2的肺孤立性结节样腺癌的PET/CT表现比较
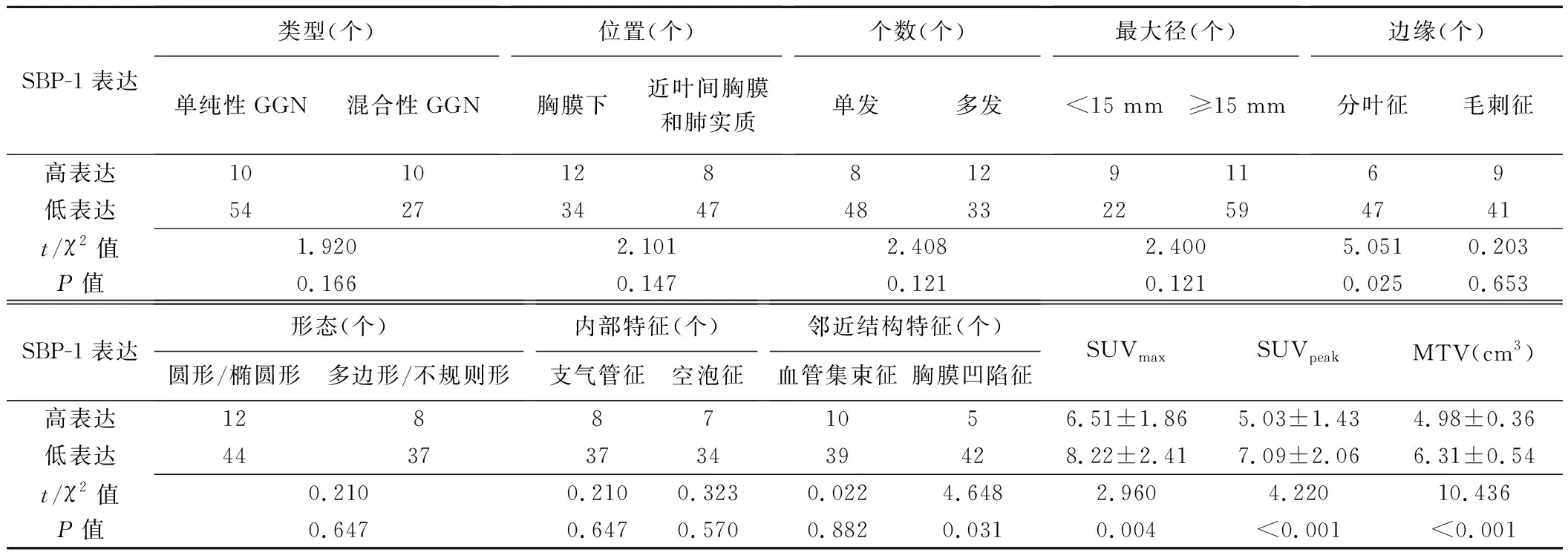
表5 高、低表达SBP-1的肺孤立性结节样腺癌的PET/CT表现比较
针对上述组间差异有统计学意义的参数行相关性分析,结果显示肺孤立性结节样腺癌出现分叶征、胸膜凹陷征及其SUVmax、SUVpeak和MTV均与PKM2表达呈正相关、与SBP-1表达呈负相关(P均<0.05)。见表6。
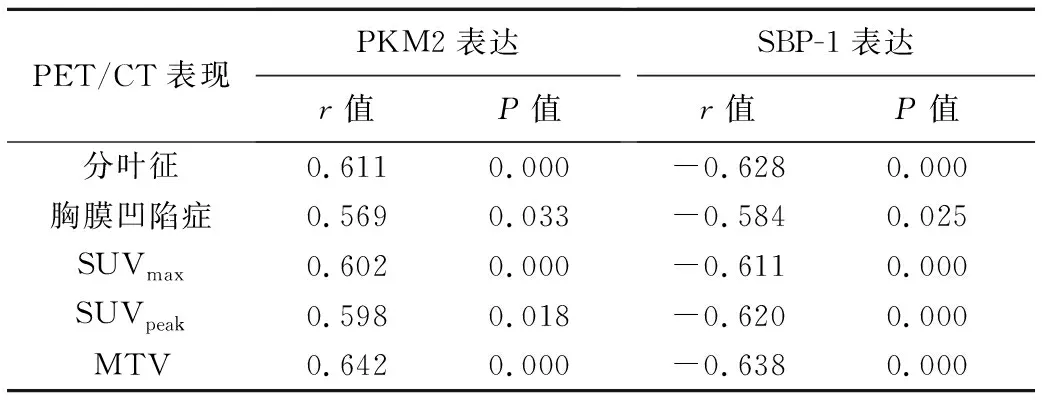
表6 肺孤立性结节样腺癌PET/CT表现与其PKM2和SBP-1表达的相关性
3 讨论
PKM2为蛋白络氨酸磷酸化家族成员之一,且在乳腺癌、卵巢癌、食管癌等多种恶性肿瘤中均有表达[6]。肺腺癌呈PKM2异常高表达[7]。本研究中,观察组PKM2高表达率高于对照组,提示PKM2参与肺孤立性结节样腺癌发病过程。生理条件下,机体激酶及磷酸化酶的磷酸化-去磷酸化处于动态平衡,一旦该平衡被打破,即可激活多种细胞信号传导通路,促进肿瘤细胞增殖、分化,且可与低氧诱导因子1α协同促进有氧糖酵解和肿瘤血管生成,加速恶性肿瘤进程;由此推测,下调PKM2表达有望抑制肿瘤生长及侵袭、促进疾病良好转归。
硒属微量营养素,人体硒摄入量不足可增加罹患胰腺癌、结肠癌及肺癌风险[8]。SBP-1为肿瘤抑制因子,是硒元素在人体内的蛋白结合物。本研究发现,观察组病灶SBP-1高表达率低于对照组。既往研究[9]发现,摄入足量硒元素可使SBP-1转录升高,增强机体对癌症的抵抗能力。SBP-1抗恶性肿瘤机制可能在于减轻过氧化物对脂质、DNA及蛋白的损伤,抑制由致癌物质介导的共价DNA复合物形成,上调抑癌基因p53表达;但也有学者[10]认为肺腺癌呈SBP-1低表达与基因缺失和甲基化并无明显相关,有待进一步观察。
PET/CT可反映肿瘤细胞增殖分化及新生血管生成情况,有助于鉴别肺良、恶性肿瘤;其常用参数包括SUVmax、SUVpeak及MTV。肺良性病变呈FDG低摄取、快清除,而恶性病变为高摄取、慢清除。此外,肺良性肿瘤多呈圆形或类圆形纯磨玻璃影,边缘整齐,少见分叶征及毛刺征;随着肿瘤细胞增殖、侵袭并向恶性进展,肿瘤逐渐呈多边形,并出现毛刺征及分叶征等异常表现[11]。本研究研究组病灶SUVmax、SUVpeak及MTV均高于对照组。
本研究发现肺孤立性结节样腺癌出现分叶征、胸膜凹陷征及其SUVmax、SUVpeak和MTV均与PKM2和SBP-1表达相关。PKM2和SBP-1是鉴别肺良、恶性结节的重要分子标志物,PKM2升高、SBP-1降低提示恶性;分叶征与肿瘤内部纤维组织收缩和肿瘤边缘细胞分化程度不一、生长速度不同等有关;胸膜凹陷征的形成机制为瘤内纤维化,肺腺癌细胞增殖分化旺盛,易造成组织内缺氧,致肿瘤细胞纤维化而收缩。
综上,肺孤立性结节样腺癌PET/CT表现与其PKM2表达及SBP-1表达均相关。但本研究为单中心、回顾性研究,且样本量有限,有待后续加以完善。
