3,5-二氯苯胺在水中的光解及水解特性
2022-12-27钟言茹孔令茹王鸣华施海燕
钟言茹, 孔令茹, 来 祺, 王鸣华, 施海燕
(南京农业大学 植物保护学院,南京 210095)
3,5-二氯苯胺 (3,5-dichloroaniline,3,5-DCA)是二甲酰亚胺类杀菌剂(DCFs)腐霉利、异菌脲、乙烯菌核利和菌核净制备的中间体,也是腐霉利、异菌脲、乙烯菌核利的主要代谢产物,被广泛应用于农药、化妆品、橡胶和染料的生产中[1-2]。美国环境保护局曾报道,3,5-DCA 比其母体化合物腐霉利具有更强的毒性和持久性,并且认为腐霉利和3,5-DCA 是可能的致癌物[2]。3,5-DCA 在24 h 内对肾脏和肝脏具有急性毒性[3],对大鼠的急性毒性约为其母体化合物腐霉利的10 倍[4],对人肝癌细胞Hep G2 的细胞毒性是其母体化合物异菌脲的3.3 倍[5]。目前已发现,二甲酰亚胺类杀菌剂腐霉利、乙烯菌核利等在大豆和黄瓜等植物上的代谢物中都含有3,5-DCA[6]。乙烯菌核利的残留定义为乙烯菌核利及其代谢物3,5-DCA 之和,以乙烯菌核利表示。另有研究表明,异菌脲的代谢产物3,5-DCA 是导致土壤微生物多样性和功能性下降的主要原因[7]。
农药环境行为是农药环境安全性评价的重要指标。农药的光解、水解及在土壤中的降解是农药在环境中迁移转化的重要途径,对农药的残留、药效、毒性和环境安全有重大影响。农药的降解特性除了与农药本身性质有关,也与环境共存物质和土壤性质密切相关[8-11]。目前,有关腐霉利、异菌脲和乙烯菌核利环境行为方面均有相关研究[12-14],然而,尚未见有关3,5-DCA 在环境行为方面的研究报道。基于此,本研究采用室内模拟方法,通过高效液相色谱 (HPLC) 和气相色谱-质谱联用仪 (GC-MS),研究了3,5-DCA 的光解和水解特性及影响因素,以期为二甲酰亚胺类杀菌剂合理使用准则制定和环境安全性评价提供科学依据。
1 材料与方法
1.1 仪器与试剂
Agilent1260 型高效液相色谱仪配UV 检测器(HPLC,美国Agilent 科技有限公司);Agilent 6890N 型气相色谱-质谱联用仪 (GC-MS,美国Agilent 科技有限公司);R-200 型旋转蒸发仪 (瑞士BUCHI 公司);JN25-12D 型超声波清洗机 (宁波江南仪器厂);EOFO-945066 数显型多管涡旋混合器 (Henry Troemn 公司);XT5409 型光稳定性试验箱 (杭州雪中炭恒温技术有限公司);MUL9000(A)-H-30 型超纯水系统 (南京总馨纯水设备有限公司);TDZ5 型台式离心机 (湖南赫西仪器装备有限公司);TH-3560 型全自动高压灭菌锅 (造鑫企业有限公司)。有机相滤膜 (0.22 μm) 及水相滤膜(0.22 μm) (上海安谱实验科技股份有限公司)。
98% 3,5-DCA 标准品 (上海迈瑞尔化学技术有限公司);乙腈及正己烷 (色谱纯,美国TEDIA 公司);甲醇、乙腈及正己烷 (分析纯,天津科密欧化学试剂有限公司);邻苯二甲酸氢钾、磷酸二氢钾、硼酸、氯化钾、氢氧化钠、十二烷基磺酸钠及十六烷基三甲基溴化铵 (分析纯,广东西陇化工股份有限公司)。
缓冲溶液:Clark-Lubs 缓冲溶液按《化学农药环境安全评价试验准则》配制[15],使用前灭菌20 min,灭菌后的溶液重新校正pH 值。
1.2 分析方法
1.2.1 检测条件
HPLC 分析条件:Eclipse Plus C18柱 (150 mm ×4.6 mm,4.0 μm),柱温30 ℃,流动相为V(乙腈) :V(水) = 60 : 40,检测波长208 nm,流速1.0 mL/min,进样量20 μL。在此条件下,3,5-DCA的保留时间为4.1 min。
GC 条件:色谱柱为DB-1701 毛细管柱 (30 m ×0.25 mm × 0.25 μm);进样口温度为290 ℃;载气(He) 流速为1.5 mL/min;进样量1.0 μL,不分流进样;柱升温程序为初始温度100 ℃,保持1 min,20 ℃/min 升至280 ℃,保持1 min。
MS 条件:电子轰击电离源,电子能量为70 eV;离子源温度230 ℃;接口温度280 ℃;选择离子扫描模式,扫描范围m/z50~450;溶剂延迟为4 min。
1.2.2 标准溶液配制及标准曲线绘制 准确称取3,5-DCA 标准品,用乙腈为溶剂,配制成质量浓度为1 000 mg/L 的标准品母液,再用V(乙腈) :V(水) = 60 : 40 的混合溶液梯度稀释,分别配制成0.1、0.5、1、5 和10 mg/L 的标准工作溶液,在上述HPLC 条件下进行测定。以3,5-DCA 峰面积为纵坐标,3,5-DCA 质量浓度为横坐标绘制标准曲线,得到的线性方程为y= 208.67x+ 29.983,R2=0.999 1,线性关系良好。
1.2.3 样品前处理方法
水样、甲醇样品和乙腈样品:取待测样品,过0.22 μm 滤膜,用HPLC直接检测样品中3,5-DCA 含量。
正己烷样品:用氮气吹干后用V(乙腈) :V(水) = 60 : 40 的混合溶液溶解,过0.22 μm 滤膜,用HPLC 检测样品中3,5-DCA 的含量。
正己烷中的光解产物样品:取待测样品,过0.22 μm 滤膜,用GC-MS 直接检测。
1.3 3,5-DCA 光解
1.3.1 光源对3,5-DCA 光解速率的影响 参照文献方法[16]。取质量浓度为5 mg/L 的3,5-DCA 标准工作溶液,置于具塞石英管中 (长200 mm,内径25 mm),待光解仪稳定后进行光解试验。分别选择紫外灯和氙灯作为照射光源,紫外灯发射的紫外光强度为3.00 mW/cm2;氙灯为500 W,光照度为10 500 lx。在 (25±1) ℃下照射不同时间后分别取样1 mL。每处理设3 次重复,并设黑暗对照。采用HPLC 检测溶液中3,5-DCA 的含量。
1.3.2 pH 值对3,5-DCA 光解速率的影响 选择紫外灯作为照射光源,分别用pH= 4、7 和9 的缓冲溶液配制初始质量浓度为5 mg/L 的3,5-DCA 溶液,照射不同时间后分别取样,采用HPLC 检测溶液中3,5-DCA 的含量。
1.3.3 溶剂对3,5-DCA 光解速率的影响 分别以正己烷、乙腈和甲醇为溶剂配制5 mg/L 的3,5-DCA 溶液,选择紫外灯作为照射光源,照射不同时间后分别取样。采用HPLC 检测溶液中3,5-DCA 的含量。
1.3.4 初始质量浓度对3,5-DCA 光解速率的影响
选择紫外灯作为照射光源,配制初始质量浓度分别为1、5 和10 mg/L 的3,5-DCA 正己烷溶液,于不同时间分别取样。采用HPLC 检测溶液中3,5-DCA 的含量。
1.3.5 3,5-DCA 的光解产物分析 用色谱纯正己烷溶解3,5-DCA 标准品配制50 mg/L 的标准溶液,选择紫外灯作为照射光源,分别照射0、0.5、1、1.5、2、3、6 和16 h 取样,采用GC-MS 检测光解产物。
1.4 3,5-DCA 水解
1.4.1 pH 值对3,5-DCA 水解速率的影响 使用前,pH 缓冲溶液和试验器皿均高温高压灭菌20 min(120 ℃,1.1 × 105Pa) 以排除微生物对3,5-DCA 水解的影响。同时,整个试验过程避光以避免光解作用。
分别向pH 4、7 和9 的Clark-Lubs 缓冲溶液中加入3,5-DCA 溶液,使其初始质量浓度均为5 mg/L。裹上锡箔纸,置于25 ℃恒温培养箱中避光培养。分别于不同时间取样,每次取样1 mL,每处理3 次重复,采用HPLC 检测溶液中3,5-DCA的含量。
1.4.2 表面活性剂对3,5-DCA 水解速率的影响 在pH 7 的Clark-Lubs 缓冲溶液中加入两种常见的表面活性剂十二烷基磺酸钠 (SDS) 和十六烷基三甲基溴化铵 (CTAB),使其质量浓度分别为100、300和500 mg/L,同时设空白对照。分别向溶液中添加3,5-DCA 丙酮溶液,使其初始质量浓度均为5 mg/L。裹上锡箔纸,置于25 ℃恒温培养箱中避光培养。分别于不同时间取样,每次取样1 mL,每处理3 次重复,采用HPLC 检测溶液中3,5-DCA的含量。
1.5 数据处理
3,5-DCA 在溶液中的光解和水解可按一级动力学方程描述。分别按公式 (1) 和 (2) 计算3,5-DCA 在不同条件下的降解方程和半衰期。
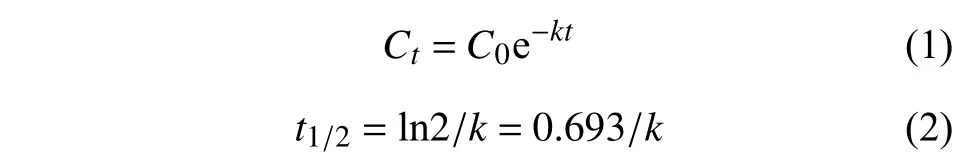
式中,C0和Ct分别为3,5-DCA 的初始浓度和t时刻3,5-DCA 的浓度 (mg/L 或 mg/kg);k为速率常数 (min-1、h-1或d-1);t为降解时间;t1/2为降解半衰期 (min、h 或d)。
2 结果与讨论
2.1 3,5-DCA 的光解作用
2.1.1 光源对3,5-DCA 光解速率的影响 3,5-DCA在不同光源照射下的光解动力学参数 (表1) 表明,3,5-DCA 在紫外灯和氙灯下的光解均符合一级反应动力学方程,R2均大于0.98。3,5-DCA 在紫外灯和氙灯照射下的光解速率存在很大差异,在紫外灯下其光解半衰期为11.6 min,在氙灯下为49.5 min。
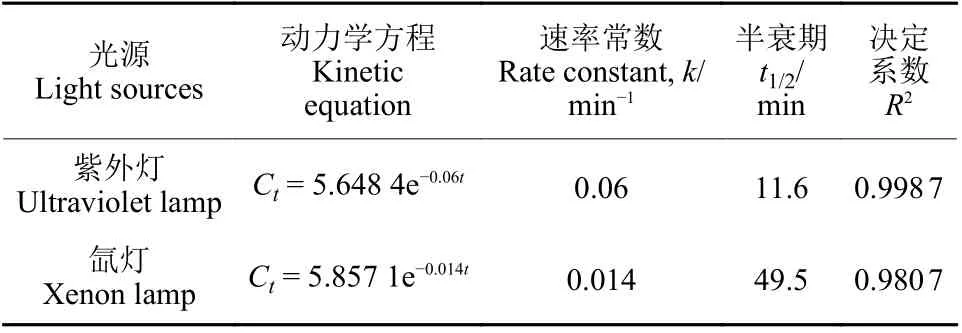
表1 不同光源下3,5-DCA 的光解动力学参数 (n = 3)Table 1 The photolysis kinetic parameters of 3,5-DCA using different light sources (n = 3)
3,5-DCA 的光解速率产生差异,可能与这两种光源的发射光谱与3,5-DCA 分子的吸收、传递光能及自身受光影响的特性不同所致[17],氙灯和太阳光比较相似,发射的光谱范围大都集中在300 nm 以上,紫外灯的发射光谱范围在100~400 nm,而3,5-DCA 的最大吸收光谱约为208 nm。因此3,5-DCA 在紫外灯下的降解速率大于氙灯。
2.1.2 pH 值对3,5-DCA 光解速率的影响 3,5-DCA 在不同pH 值的缓冲溶液中的光解动力学参数见表2。在3 种不同pH 条件下的光解均符合一级反应动力学方程,R2均大于0.98。在pH 值为7 和9 条件下,3,5-DCA 光解速率差异不大,光解半衰期分别为9.9 和10.7 min,光解速率较快;而在pH 4 时,其光解速率明显减慢,光解半衰期为168 min,分别是pH 7 和9 时的17.0 和15.7 倍。其原因可能与它们的光化学反应机理有关[12],碱性、中性介质中存在大量的OH-,在紫外条件下易产生过氧自由基,从而极易氧化3,5-DCA。
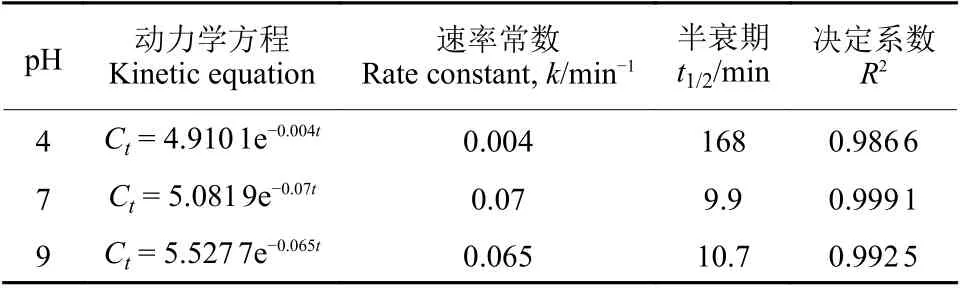
表2 不同pH 条件下3,5-DCA 的光解动力学参数 (n = 3)Table 2 The photolysis kinetic parameters of 3,5-DCA under different pH conditions (n = 3)
2.1.3 溶剂对3,5-DCA 光解速率的影响 3,5-DCA 在3 种不同溶剂中的光解均符合一级反应动力学方程,R2均大于0.99。3,5-DCA 在乙腈、甲醇和正己烷中的光解半衰期分别为2.69、4.10 和0.58 h (表3)。根据GB/T 31270.1—2014《化学农药环境安全评价试验准则》[15],按农药光解半衰期对农药光解性进行等级划分,3,5-DCA 在甲醇中属于较易光解,在乙腈和正己烷中属于易光解。
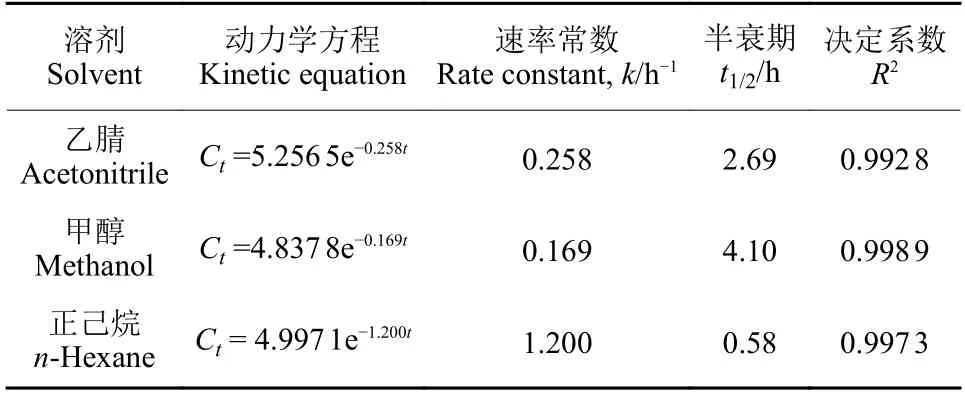
表3 不同溶剂中3,5-DCA 的光解动力学参数 (n = 3)Table 3 The photolysis kinetic parameters of 3,5-DCA in different solvents (n = 3)
光解速率可能与溶剂性质、溶剂与3,5-DCA分子间的作用力以及溶剂本身对光的吸收有关[16,18]。从极性角度可知[19],正己烷、乙腈和甲醇的极性指数分别为0.06、6.2 和6.6,存在极性越小,光解速率越大的可能。但相对于水溶液 (pH = 7) (表2),正己烷、乙腈和甲醇对3,5-DCA 均表现为光猝灭作用[20]。正己烷、乙腈和甲醇的最大吸收波长分别约为195、190 和205 nm[16,18-19],均与3,5-DCA的最大吸收波长 (208 nm) 比较接近,可能在光解中大部分光量子被溶剂所吸收,从而导致3,5-DCA降解较慢。此外,正己烷的吸收能力较弱,其对3,5-DCA 降解的影响也相对较弱。
2.1.4 初始质量浓度对3,5-DCA 光解速率的影响
在不同初始质量浓度条件下,3,5-DCA 在正己烷中的光解速率存在差异。3,5-DCA 在不同初始质量浓度中的光解均符合一级动力学方程,R2均大于0.92。当3,5-DCA 初始质量浓度分别为1、5 和10 mg/L 时,其光解半衰期分别为0.41、0.49和1.02 h,光解速率随初始质量浓度的增加而减慢(表4)。当3,5-DCA 的初始质量浓度分别为1 和5 mg/L 时,其光解速率差异不大,这是由于当3,5-DCA 的质量浓度为5 mg/L 时,光能充足,分子间竞争较少,而当3,5-DCA 的质量浓度上升为10 mg/L 时,分子间对光能的竞争作用加强,导致光解速率降低[18]。
2.1.5 3,5-DCA 的光解产物分析 将3,5-DCA 的正己烷溶液置于紫外灯下照射,分别于0、0.5、1、1.5、2、3、6 和16 h 取样,使用气相色谱-电子轰击电离源质谱仪 (GC-EI-MS) 对其代谢产物进行鉴定。3,5-DCA 正己烷溶液照射0 和6 h 的总离子流图和质谱图见图1。从0 h 的总离子流图和质谱图 (图1A 和1B) 可以发现,3,5-DCA 的保留时间为6.2 min,相对分子质量为161,且存在同位素峰163 的丰度为161 的2/3,说明含有2 个氯原子,与3,5-DCA 的相对分子质量和结构相符。随着紫外灯光照时间的延长,3,5-DCA 逐渐减少,至6 h 时完全降解,且在5.0 min 出现了一个明显的光解产物e (图1C),从其质谱图 (1D) 可以看出其质量数为127,减少了35。结合同位素峰确定,两个氯原子同位素峰为主峰的2/3,一个氯原子是主峰的1/3,因此可以推断其代谢产物e 为单脱氯产物。
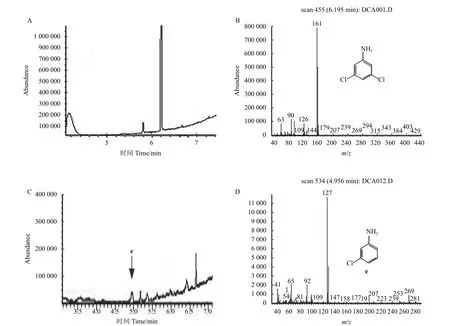
图1 3,5-DCA 正己烷溶液在光照时间为0 h (A) 和6 h (C) 的总离子流图,以及3,5-DCA (B)和其光解产物e (D) 的质谱图Fig.1 Total ion chromatograms of 3,5-DCA in n-hexane solution at 0 h (A) and 6 h (C), mass spectrum of 3,5-DCA (B) and its metabolite e (D)
2.2 3,5-DCA 的水解作用
2.2.1 pH 值对3,5-DCA 水解速率的影响 3,5-DCA在3 种pH 值不同的缓冲溶液体系中的水解速率有所差异,水解均符合一级反应动力学方程。在pH 4、7 和9 条件下,3,5-DCA 的水解半衰期分别为77.0、40.8 和86.6 d (表5),即在中性条件下水解速率较快,而在酸性和碱性条件下较慢。根据GB/T 31270.1—2014《化学农药环境安全评价试验准则》[15],按农药水解半衰期对农药水解性进行等级划分,3,5-DCA 在3 种不同pH 条件下均属于中等降解类化合物。
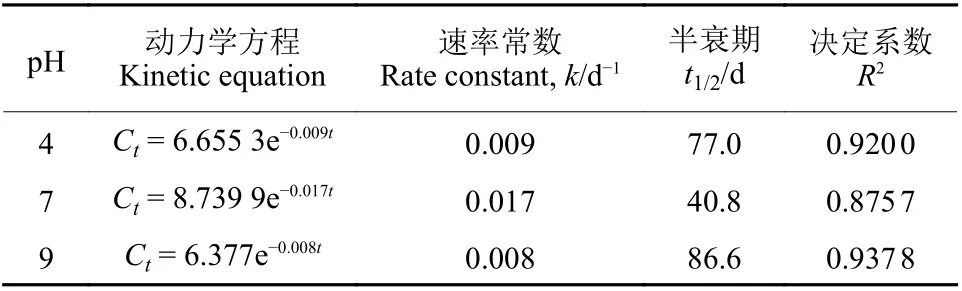
表5 不同pH 条件下3,5-DCA 的水解动力学参数 (n = 3)Table 5 The hydrolysis kinetic parameters of 3,5-DCA under different pH conditions (n = 3)
2.2.2 表面活性剂对3,5-DCA 水解速率的影响 在SDS 质量浓度分别为0、100、300 和500 mg/L 的条件下,3,5-DCA 的水解半衰期分别为40.8、115、115 和99 d,均符合一级反应动力学方程 (表6)。结果表明,3 种浓度的SDS 均抑制了3,5-DCA 的水解。
在CTAB 浓度分别为0、100、300 和500 mg/L的条件下,3,5-DCA 的水解半衰期分别为40.8、138.6、173.3 和173.3 d,均符合一级反应动力学方程 (表6)。3 种浓度的CTAB 均抑制了3,5-DCA的水解,且CTAB 对3,5-DCA 水解的抑制效果强于SDS。
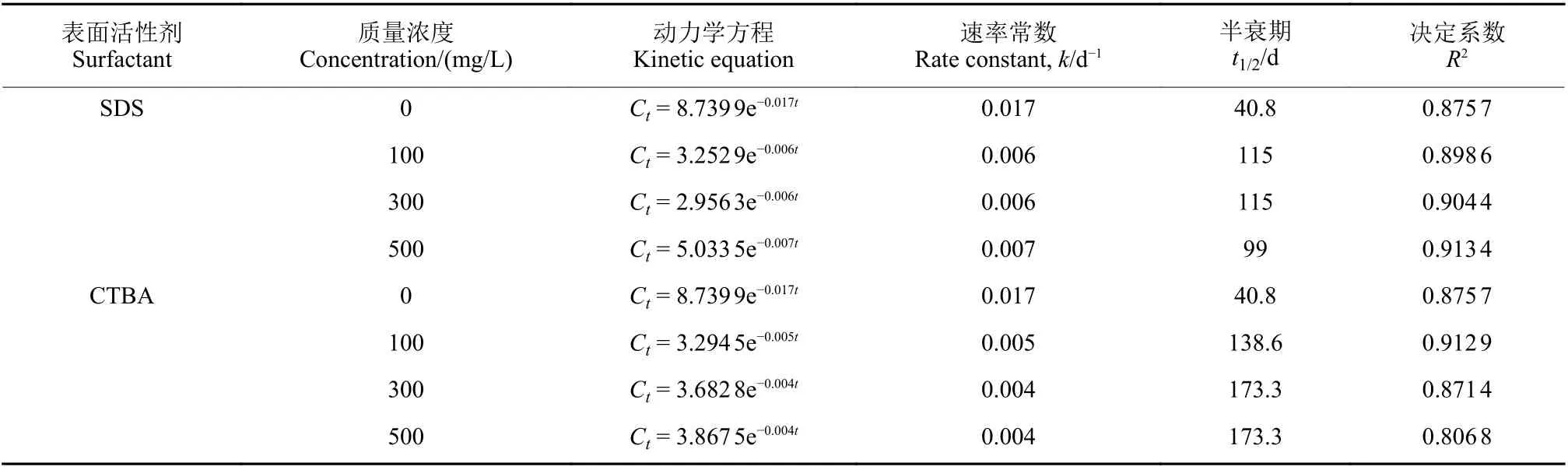
表6 3,5-DCA 在不同浓度的表面活性剂中的水解动力学参数 (n = 3)Table 6 Hydrolysis kinetic parameters of 3,5-DCA in different concentrations of surfactants (n = 3)
3 结论与讨论
在室内模拟条件下,3,5-DCA 在紫外灯下的光解速率快于氙灯;在酸性条件下较为稳定,在中性和碱性条件下光解速率较快;在不同溶剂中的光解速率为:正己烷 > 乙腈 > 甲醇,且在正己烷溶液中的光解速率随3,5-DCA 初始浓度的增加而减慢,光解产物为单脱氯产物。3,5-DCA 在中性条件下水解速率最快,在酸性和碱性条件下水解较慢。3,5-DCA 在3 种pH 条件下均属于中等降解,在水体中有较强的持久性,应注意其对水生生物的危害作用。不同浓度SDS 和CTAB 溶液均可抑制3,5-DCA 的水解,CTAB 的抑制效果强于SDS。这两种表面活性剂可能通过降低3,5-DCA在水溶液中的溶解度,从而抑制3,5-DCA 的水解作用,具体抑制机制有待进一步研究。
有研究表明,常用的二甲酰亚胺类杀菌剂腐霉利、异菌脲、乙烯菌核利在环境中都会有代谢物3,5-DCA 的产生[1-2,5,21-22],而3,5-DCA 对斑马鱼表现出比母体 (腐霉利、异菌脲) 更高的毒性[23],在人类尿液中也检测到了约0.17~1.17 μg/L 的含量[24]。而本研究发现,3,5-DCA 虽然易光解,但在水体中具有较强的持久性 (半衰期为40.8~86.6 d),同时在实际水环境中,表面活性剂的存在可抑制3,5-DCA 的水解,这无疑增加了二甲酰亚胺类杀菌剂对水生生物和人类的风险。
