昆虫信息化合物的筛选及鉴定技术研究进展
2022-12-27钱沉鱼苑鹏宇温秀军
钱沉鱼, 苑鹏宇, 马 涛, 温秀军
(华南农业大学 林学与风景园林学院,广东省森林植物种质创新与利用重点实验室,广州 510642)
昆虫在其生活史和生态学的许多方面都会利用化学信号和线索,化学通讯在昆虫的觅食、求偶、栖息、交配等生理行为中起着重要作用。信息素是具有挥发性、半挥发性和非挥发性的化学物质,可引起受体生物体的生理或行为反应[1-3],分别参与长距离、中距离和短距离通信,根据其行为结果,可分为性信息素、聚集信息素、告警信息素和示踪信息素等。自1959 年提出“信息素”一词以来[4],第一个信息素组分bobbykol 在蚕蛾Bombyx mori身上得以鉴定[5],随后越来越多的研究揭示了这些信息物质在众多昆虫中的化学和生物学作用。当信息素与诱捕器结合使用时,可以有效地监测和控制害虫的危害[6]。昆虫信息素是农林害虫综合管理的重要组成部分,尤其是信息素的高效灵敏性,在害虫种群密度较低时,表现出巨大的潜力[7-8]。此外,信息素具有物种特异性、对哺乳动物无毒、对环境无害等优点,可在对天敌影响最小的情况下长期减少害虫种群。大量研究表明,利用化学信息素作为生物农药,通过监测、大规模诱捕、交配中断、吸引、杀死和推拉策略来管理农业、储存产品和森林害虫,可以显著减少传统杀虫剂的使用,减缓病虫抗药性,从而提供可持续和生态友好的害虫防控技术[7,9]。
昆虫的触角是连接昆虫与大自然之间的主要化学信息通讯工具,尤其是触角上的各类化学感受器,能接受外部环境刺激后形成化学信号[10],通过化学感受器上的微孔进入水溶性淋巴液,与周围的气味结合蛋白 (odorant binding protein,OBP)、气味受体 (odorant receptors, OR)、信息素结合蛋白 (pheromone binding protein, PBP)、化学感受蛋白 (chemosensory protein, CSP) 和感觉神经元膜蛋白 (sensory neuron membrane proteins,SNMP) 结合,形成亲水性的复合物,这些复合物可穿过感受器淋巴而激活信息素受体[11-13]。OR构成了气味检测的核心,位于嗅觉受体神经元(olfactory receptor neuron, ORN) 的树突膜上[14],介导特定气味分子与嗅觉神经元的结合,将化学信息信号转换为电信号,负责嗅觉神经元的敏感性和特异性[15]。最后通过高级脑中枢的信息整合,支配和调节昆虫的行为反应[16]。目前,已在100 多种昆虫中检测到了OBP 的存在,例如蚕蛾[17]、玉米象Sitophilus zeamais[18]、韭菜迟眼蕈Bradysia odoriphaga[19]、东方果实蝇幼虫寄生蜂Diachasmimoorpha longicaudata[20]、棉铃虫Helicoverpa armigera和烟青虫Helicoverpa assulta[21]等。昆虫通过其嗅觉系统感知气味分子,如性信息素[22]、聚集信息素[23]和植物源挥发物[24]等。破解昆虫与昆虫、昆虫与寄主植物之间的化学信息,实际是对昆虫触角及触角上化学感受器的深入研究[25-26],因此,电生理技术作为昆虫触角研究方法中最重要的技术之一,也是化学生态学研究中最常用的技术方法。
目前,常用于昆虫信息化合物筛选及鉴定的仪器有触角电位仪 (electroantennography, EAG)、气相色谱-触角电位联用仪 (gas chromatographyelectroantennographic detection, GC-EAD)、气质联用仪 (gas chromatography-mass spectrometer, GCMS)、单感器记录仪 (single sensillum recordings,SSR) 和气相色谱-单感器记录联用仪 (GC-SSR)。EAG 主要用于引起昆虫触角活性反应的已知化合物的筛选与测定;而GC-EAD 可直接用于混合物的高效筛选,与单独使用EAG 相比,其可极大地提高筛查效率,降低工作量;SSR 和GC-SSR 技术则用于区分昆虫触角不同感受细胞的电位反应。信息素的化学结构多种多样,包括碳氢化合物、醇、酯、环氧化物、醛、酮、内酯、羧酸和异戊二烯等[27-29],这种结构多样性是信息素具有特异性的关键。不同组分的作用有可能是无关的、拮抗的或协同的,其具体效能取决于组分之间的比例。因此,GC-MS 技术作为破解化合物质谱信息和结构信息的有力手段和前提条件,通过选择合适的毛细管柱,能实现大多数挥发性有机化合物的定性与定量分析。由于电生理技术具有较强的选择性和灵敏性,已经广泛地应用于昆虫的嗅觉行为及其化学生态学的研究,成为昆虫信息化合物鉴定、筛选及其其他挥发性有机化合物生物活性测定的重要工具,使得信息素化学物质的结构信息与作用机制更加清晰,为害虫生物防治及绿色防控提供了更多途径和技术支撑。本研究对上述昆虫信息素的鉴定与分析技术进行了总结归纳,结合近年来国内外研究报道,讨论了电生理技术和气质联用技术的作用原理及应用,分析了不同技术在昆虫信息素鉴定中的优势与不足,并对未来电生理技术在化学生态分析领域中可能面临的机遇与难点进行了展望,以期为昆虫信息素的研究提供有价值的参考。
1 触角电位技术
触角电位仪 (EAG) 是昆虫化学生态中最常用的电生理学方法,最早是由科学家Schneider[30]利用EAG 技术测定了蚕蛾性信息素的嗅觉生理反应,记录了在化合物的刺激作用下,蚕蛾触角的尖端和根部之间产生了一个细微的电压波动,是由昆虫触角内的嗅觉神经元被电化消磁所引起的。EAG 是一种快速测量由嗅觉刺激引起的触角远端和近端部分之间电位变化的优越技术,也可使用纯化合物来评估昆虫触角对某种刺激的反应和引发可检测反应所需的剂量[31]。如图1 所示,该仪器主要包括:数据采集控制器、刺激放大器、微动操作仪及触角电位探头、计算机、巴斯德管等构成。昆虫触角上存在着大量的化学感受器,每一个感受器细胞都包含着类似于电源和电阻的结构,这样整根触角就组成了无数的电源和电阻,从而形成串联的闭合电路[32]。当触角受到活性化合物刺激时,大量的感受细胞就会产生相应的电生理反应,从而在触角的基部和端部形成一个总的电位变化 (去极化的直流信号),得到触角电位图,通常用毫伏 (mV) 表示。这种电位的变化幅度与化合物的种类和属性等密切相关,并随着化合物浓度的增长而增长,直至饱和状态。除此之外,还与昆虫的种类及生理状态、昆虫触角的活性、离体触角的寿命和触角电位仪放大器输入信号的质量及温湿度状况等相关[33]。
目前,EAG 被广泛应用于从一系列疑似化合物中筛选出可以引起昆虫触角活性反应的物质[34],以测定昆虫触角对活性化合物的电生理反应 (图1)。如Zhao 等[35]等在东方蜜蜂Apis cerana中发现其气味结合蛋白AcerOBP6 与大多数被测气味具有亲和力,并用EAG 判定该蜜蜂对2-庚酮反应最强烈,在沉默AcerOBP6 后,发现所选配体的 EAG 记录值全部降低,由此推测出了参与觅食嗅觉识别的关键蛋白质。Du 等[36]用 GC-EAD探究红火蚁Solenopsis invicta对异构体混合物中报警信息素的反应时,发现GC-EAD 响应太小而无法满足研究的需要,继而改用EAG 直接测量,获得了显著的触角反应。近年来, Jacob 等[37-38]还新开发了一种EAG 结合电流源密度 (CSD) 模型预测的分析方法,并在实蝇科昆虫身上验证了该方法可用于绘制单个触角的功能激活图,能更加快速和全面地评估触角对化合物的敏感性。

图1 EAG 仪器原理示意图[32]Fig.1 Schematic diagram of EAG equipment[32]
2 气相色谱-触角电位联用技术
由气相色谱 (GC) 和触角电位仪 (EAG) 组成的气相色谱-触角电位联用仪 (GC-EAD),是一个联合的分析系统,将基于 EAG 的方法提高到了更高水平。通常在选择分析样品的色谱柱时,根据目标化合物的特征可采用弱极性柱 (如DB-5MS、HP-5 和HP-5MS 等)、中等极性柱 (DB-17 和DB-17MS 等) 或强极性柱 (如HP-Wax、HP-INNOWax和DB-Wax 等)。虽然色谱柱固定相有着不同的极性,但适用范围广,对大多数化合物都具有比较高的灵敏度和质谱完整性,如醛类、烯烃和萜类等。然而,相对于弱极性柱而言,强极性柱可改善低沸点分析物的分离度,尤其适用于酸、酯和甘醇等物质的分离。气相色谱柱出口端接Y 型分流器,使得色谱柱馏出物在火焰离子化检测器(FID) 和 EAD 之间以 1:1 的分流比通过加热的传输线进行分流。控制气流的支路长度相同,使到达FID 和EAD 的时间基本保持一致,这样GC和EAG 的响应峰可以同时一一对应记录,收集的气味化合物被迅速筛选,其他没有引起活性反应的物质不予考虑 (图2)。虽然GC-EAD 不能提供相关化合物的结构信息,但比较适用于从复杂混合物中筛选出主要成分或次要组分中具有活性的化合物,节省大量的时间和精力。
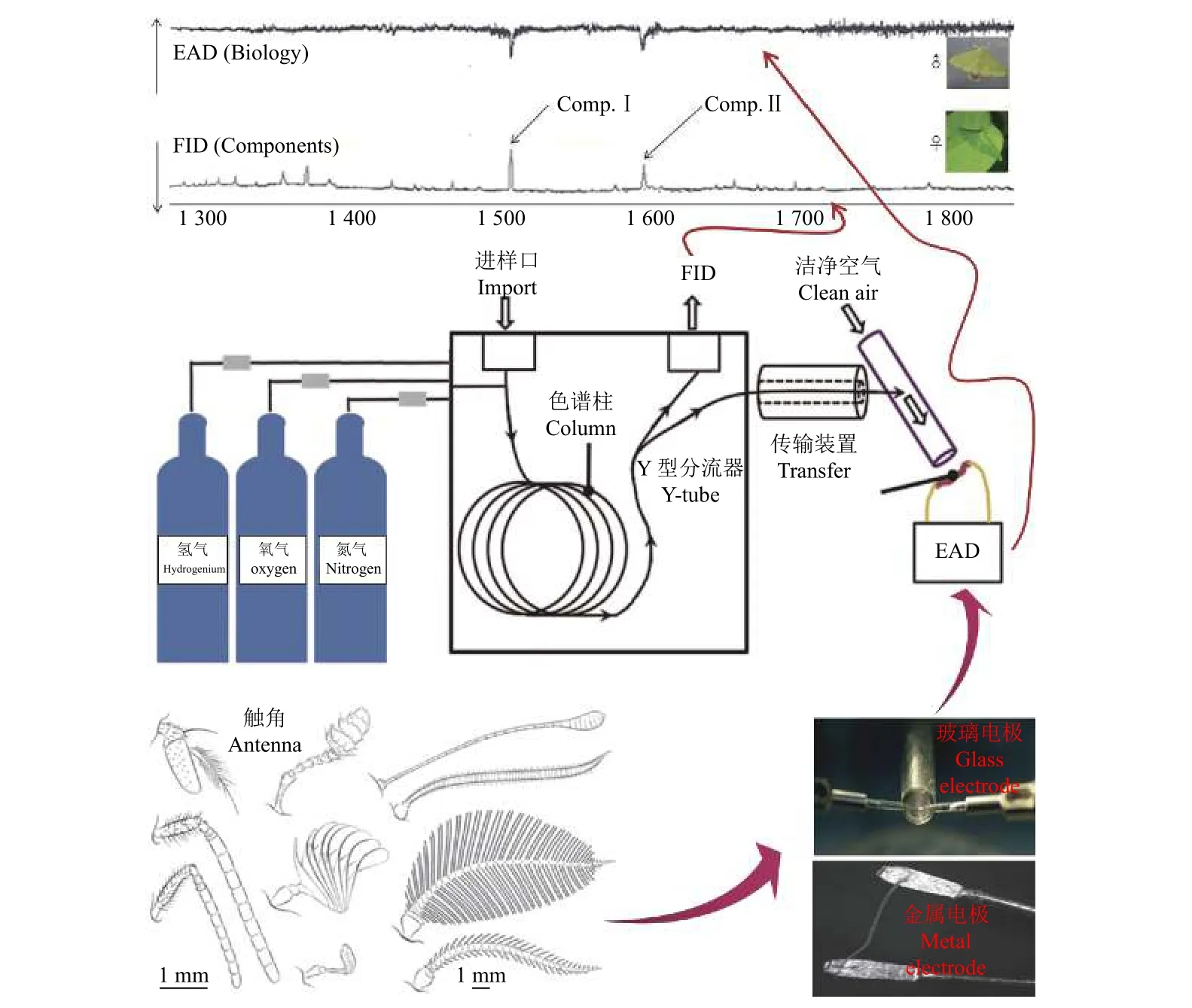
图2 GC-EAD 仪器操作原理图Fig.2 Schematic diagram of GC-EAD equipment
表1 和表2 中列举的例子包含了从 2012—2022年期间针对不同昆虫的性信息素、表皮挥发物、聚集信息素、告警信息素以及植物源挥发物组分,验证昆虫电生理反应的GC-EAD 适用条件以及相应的参考文献。
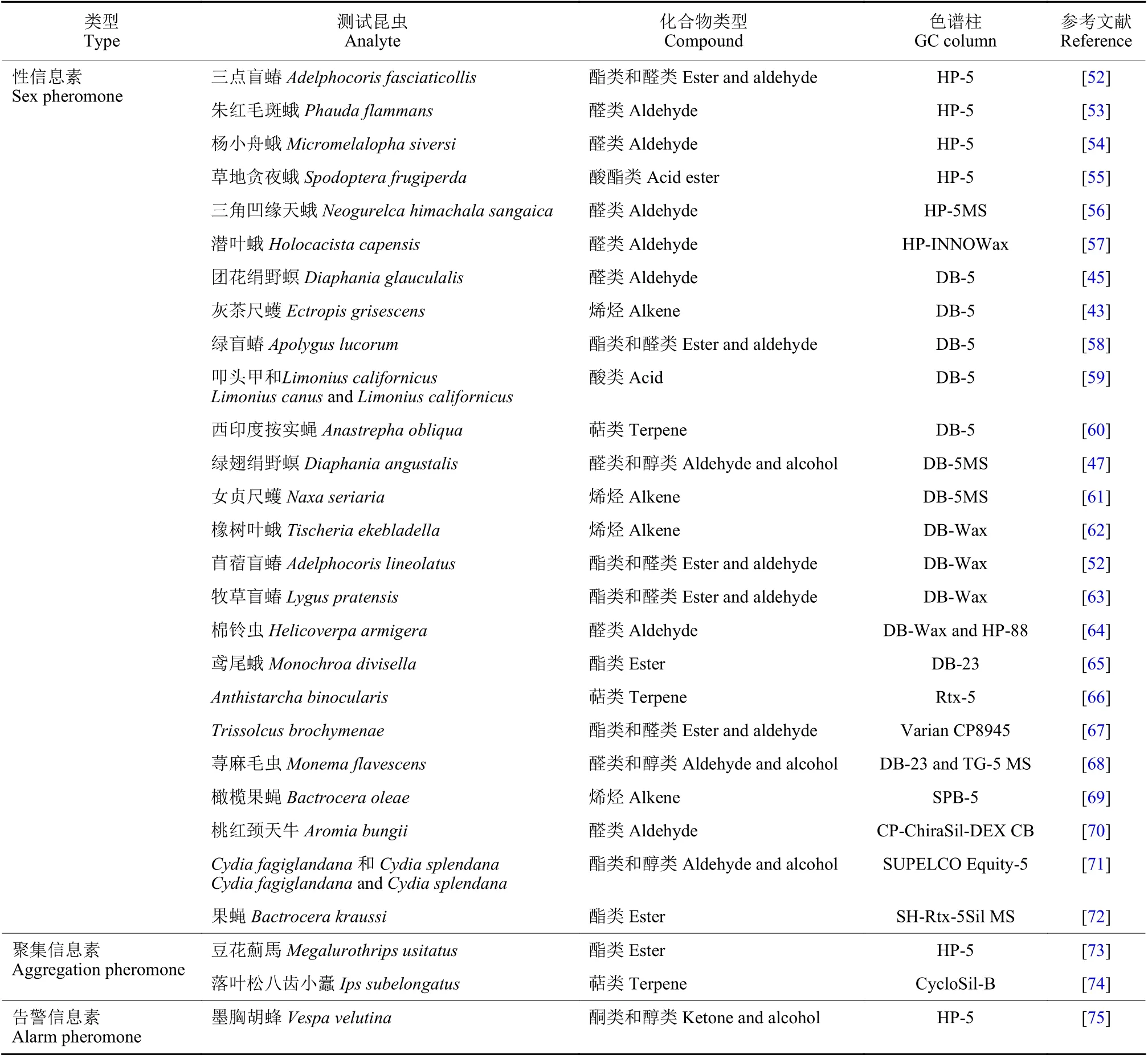
表1 适用于不同信息素类型的GC-EAD 条件 (2012—2022)Table 1 The application of GC-EAD on pheromones (2012-2022)
Moorhouse 等[39]最早提出GC-EAD 联合使用测定昆虫触角的反应,但由于EAG 反应容易被噪音 (仪器放大器输入噪音、触角本身噪音及外部电路噪音等) 或者基线漂移所覆盖,无法得到令人满意的结果。直到1975 年, Arn 等[40]使用气相色谱柱对选择性及敏感性很高的化合物进行检测,弄清了GC 和EAG 联用的GC-EAD 技术,得到了葡萄花翅小卷蛾Lobesia botrana雄蛾触角对雌蛾性信息素腺体粗体物的GC-EAD 反应,从此大量的昆虫信息化合物得到准确鉴定[41-42]。GC-EAD 技术已广泛应用于昆虫性信息素、植物源挥发物、表皮挥发物和示踪信息素等物质的初筛 (表2)。本实验室也采用GC-EAD 技术分别筛选出了皮暗斑螟Euzophera batangensis、团花绢野螟Diaphania glauculalis、麻楝蛀斑螟Hypsipyla robusta、灰茶尺蠖Ectropis grisescens和绿翅绢野螟D.angustalis等昆虫的性信息素活性组分[43-47]。

表2 适用于不同挥发物类型的GC-EAD 条件 (2012—2022 年)Table 2 The application of GC-EAD on volatiles (2012-2022)
然而,对于植物源化合物,由于引起昆虫触角反应的峰值较小,更容易被噪声覆盖,因此需要提高信噪比 (signal to noise ratio,SNR) 以避免该现象的发生[48],而新型装置 (MEMS-GC-EAG)可迅速鉴定出低浓度下的挥发性有机化合物 (volatile organic compounds,VOCs)[49]。GC-EAD 还存在一些缺陷,比如:EAD 只显示是否产生了嗅觉反应,不能提供引起昆虫触角反应的有关化合物准确信息;即使在样品制备和气相色谱条件最佳的情况下,仍有一些昆虫也很难对EAD 做出响应,仅靠 GC-EAD 技术不一定能覆盖所有的关键线索。最近,Shuttleworth 等[50]改进了原来的一次只能用一种固定的运行方法,通过四通分流器可以同时在极性和非极性色谱柱上运行样品,大大提高了对活性化合物的分离度和鉴定。由于GC-EAD和GC-MS 是两个独立的系统,因此通常使用不同的气相色谱系统。然而,两种气相色谱系统的类型、载气和色谱柱不同,所分析化合物的峰形、保留时间和数量也有所不同,在比较两个色谱图中所对应的化合物时更加耗时;如果样品量太少,无法保证第2 次进样,则无法进一步进行分析筛选。因此,Li等[51]通过在气相色谱中添加毛细管分离器来改进GC-EAD 技术,FID 被质谱取代。该方法将GC-EAD 和GC-MS 结合在一个系统中,不仅降低了一台GC 和一台FID 设备的成本,而且避免了不同色谱图的比较,提高了工作效率。更重要的是,EAD 响应本身不能与昆虫生物吸引力等特定功能直接相关,因此,GC-EAD实验结果需用野外生物活性测定加以验证,进而确认已鉴定化合物的生物活性。
3 气相色谱与质谱联用技术
使用 GC-EAD 可筛选出引起昆虫电生理行为反应的活性成分,而GC-MS 可以通过毛细管色谱
柱先对复杂混合物中的组分进行高效分离,再经过质谱信息鉴定其中能引起昆虫的电生理活性反应的单个或混合组分。Imrei 等[100]通过GC-MS 技术对截尾丽虎天牛Plagionotus detritus雄性体表挥发物中能引起GC-EAG 响应的两个物质进行了分析,将样品的保留时间与在弱极性柱 (HP-5 MS)和极性柱 (DB-Wax) 上标准品的质谱信息和保留时间对比,再结合手性色谱柱 (Cyclodex B) 分离对提取物的绝对构型进一步分析表明,雄虫产生的活性信息素组分为 (R)-3-羟基己烷-2 酮和 (S)-2-羟基辛烷-3-酮。类似地,Binyameen 等[102]在发掘棉花Gossypium hirsutum和丁香花Syringa vulgaris提取物中能引起夜蛾科害虫Spodoptera littoralis生理活性的化合物时,为了防止组分在弱极性HP-5 色谱柱上有共馏出现象,用极性DB-Wax 对化合物重新进行了分离。Būda 等[103]用Stabil-Wax极性色谱柱发现了沙棘实蝇Rhagoletis batavad雄虫信息素中潜在对映异构体的存在,并分离出了能引起雌虫EAD 反应的活性化合物,并随后利用基于环糊精的固定相手性色谱柱 (Rt®-bDEXsm)分离出了(-)-δ-庚内酯和(+)-δ-庚内酯,其中只有前者能引起触角反应。此外,结合质谱信息可对活性物质进行结构确认,其中保留指数 (RI) 是判断信息素的化学特性的重要参数。通常使用正构烷烃混合物来计算保留指数:

其中: RTX是未知物X 的保留时间,RTn是其中第n个碳的烷烃在 X 之前洗脱的保留时间,RT(n+1)是在 X 之后洗脱的n+ 1 个碳的烷烃的保留时间[104]。为了确保鉴定结果的可靠性,通常采用从至少两个不同固定相的气相毛细管柱 (包括弱极性柱和极性柱) 中获得的保留数据进行 RI 计算[57,80]。通过与合成的或购买的标准品的质谱和保留时间进行比较,最终得到准确的物质信息。在缺乏标准品的情况下,可将未知化合物的质谱与谱库中的质谱信息进行对比,而此时往往需要多个数据库 (如NIST、Wiley/NBS registry) 的交叉多重验证,再结合文献或与已发表的化合物的保留指数进行比对,以提高化合物定性的准确度[99,101,105]。
飞行时间质谱检测器 (TOFMS) 结合全二维气相色谱 (GC × GC) 是一种更为先进的化学分析技术。原理上,该方法由两个配备不同极性色谱柱的串联系统组成,通过调制器进行连接[106]。随后调制器经过反复调制,从第1 根色谱柱洗脱的每份组分释放到第2 根色谱柱,进行二次分离。由于调制之后所产生的二维峰宽比较窄 (低至50 ms,取决于低温调制的频率),因此需要具有较高采集频率 (最低每秒50 Hz) 的质谱检测器才能提高系统精度[107]。在全二维色谱图中,包含了化合物在一维色谱柱 (以分钟为单位) 和二维色谱柱 (以秒为单位) 分离后的保留时间,使用该技术既可以减少共馏出峰的出现,也能实现痕量化合物的检测。相对于传统的一维气相色谱系统,全二维气相色谱更有利于发现隐藏在高含量物质下的微量共馏出活性物质[108]。由于许多昆虫挥发性化合物的组成成分复杂,存在一些化学性质相似的同分异构体,仅靠一维气相色谱难以达到理想的分离效果[109],因此,GC × GC-TOFMS 技术也引入到了许多昆虫信息素的分离鉴定中,如非洲果蝇表皮挥发物[99]、蜡螟科Ahomia sociella雌虫求偶信息素[110]和灰茶尺蠖E.grisescens性信素[43]等。通过GC × GC-TOFMS 得到的高分辨质谱信息,发现了灰茶尺蠖的两种性信息素成分为单环氧化物和三烯,具有II 型鳞翅目信息素成分的特征[43]。地中海果蝇C.capitata雄性挥发物包括了多种化学结构接近的复杂混合物,在用GC-EAD 检测时,发现辛酸乙酯和(E)-3-辛烯酸乙酯两种化合物都有响应,可在一维GC 上两种化合物几乎同时被洗脱[101],无法精确鉴定。而借助于GC × GC 系统中两根不同极性的色谱柱 (一维:弱极性DB-5 色谱柱;二维:极性BPX-50 色谱柱),则大大提高了共馏出化合物的分离度。如图3 所示,在EAD 图上可以明显看到辛酸乙酯(36)和(E)-3-辛烯酸乙酯(37)两个化合物的响应信号,且辛酸乙酯的信号要强于(E)-3-辛烯酸乙酯;GC × GC-TOFMS 也证实了这两个化合物的存在,但(E)-3-辛烯酸乙酯的质谱响应要明显高于辛酸乙酯。可见,在一维GC分析时会误以为只有(E)-3-辛烯酸乙酯的EAD 响应。

图3 地中海果蝇雄性信息素的GC × GC-TOFMS分析及EAD 响应[101]Fig.3 The GC × GC-TOFMS analysis and GC-EADs response of C. capitata male pheromone[101]
4 单感器记录仪
单感器记录仪 (SSR) 是一种用于研究昆虫对化学刺激引起的嗅觉神经元反应及细胞外动作电位变化的技术,是筛选特定气味受体活性配体的有效方法,常用于昆虫化学生态学和神经生理学研究[111]。嗅觉受体是嵌在ORN 膜上的通道,负责将化学信号转换为电信号[112]。由于信号转导改变了ORN 膜上的活性电位频率,可作为神经元反应幅度的指标。在操作SSR 时,先用牙科蜡将活体昆虫安装在显微镜载玻片上。使用两个钨丝电极,将接地端的参比电极插入昆虫的复眼或腹部,另一端记录电极连接到前置放大器并插入感受器以完成电路。前置放大器连接到模数信号转换器,该转换器又连接到计算机以便于记录和可视化信号[113]。刺激控制器控制经过活性炭过滤的恒定气流,通过硅胶和玻璃管引至昆虫处。昆虫触角和触须上的嗅觉感觉神经元 (olfactory sensory neurons, OSN) 可将嗅觉信息从外界环境传送到昆虫大脑。OSN 的受体活性会诱导电尖峰的产生,因此SSR 能够监测感受器和参比电极之间的电位差[114]。Park 等[115]使用单感器记录技术研究了雄性和雌性卷叶蛾Cydia succedana中OSN 对宿主和非宿主挥发物的反应,发现雌蛾触角上的ORN和OSN 类别都比雄蛾丰富。其中,两种最丰富的OSN 对宿主植物释放的β-月桂烯和 (E) -β-罗勒烯表现出高度特异性反应,而其他的OSN 对非寄主植物的几种化合物产生反应,说明卷叶蛾可能利用具有高度特异性的OSN 来区分寄主植物和非寄主植物[115]。
在单感器记录中,尖峰数量的变化代表昆虫对特定刺激的敏感性,不同类型嗅觉感受器的神经信号对化学线索有着不同的动作电位类型和幅度[116]。根据尖峰幅度差异可用于评估每个感受器中的ORN 活性,因此可用于研究昆虫对特定化学物质的编码过程。例如,致倦库蚊C u l e x qsuinquefasciatus短钝毛状Ⅱ型 (short blunt trichoid II, SBTII) 感受器上神经元细胞 A 和B 对不同类别的气味表现出明显不同的反应模式。芳烃和杂环化合物可激发SBTII A 的强烈响应,而引起SBTII B 最积极反应的是醛类化合物。此外,SBTII B 对2-己酮 ((60 ± 14 ) 尖峰/s) 和3-甲基吲哚 ((75 ±4)尖峰/s) 有反应,但SBTII A 则没有反应[117]。其次,不同神经元响应化合物刺激的时间动态也各不相同,从瞬时到阶段性或持久响应。象鼻虫Apion fulvipes触角上其中1 类OSN 对吲哚的反应是强烈且持久的。当吲哚剂量在1~10 μg 时,即使是在刺激的几分钟后,尖峰幅度仍远高于无刺激时的;而当吲哚剂量为0.1 μg 时,虽然引起的反应较弱,但同样是持续的。与此同时,在其他6 类OSN 中,随着化合物剂量的减少,因刺激产生的响应在时间动态上表现为从持久响应变为阶段性响应[118]。相反,梨小食心虫Grapholita molesta雄虫触角ORN 上的细胞能对Z8-12:Ac产生反应,但受刺激后的响应时间不足1 s[119]。
此外,化学刺激物通常需要先在溶剂中溶解和稀释,以测试不同浓度的剂量效应。甲苯在0.01 μg/μL 的低阈值下便可引发致倦库蚊短钝毛状Ⅱ型 (SBTII) 感受器上神经元细胞A 的响应,当甲苯质量浓度达到10 μg/μL 时甚至可引起强烈和兴奋的反应[117]。由于昆虫对石蜡油具有低敏性,因为在测试许多昆虫受体神经元对化合物的反应时,通常以石蜡油为溶剂来溶解不同的刺激物[120]。在臭虫的研究中,同时验证了石蜡油和二甲亚砜(DMSO) 溶解刺激物的效果[121-122],发现同种刺激物在DMSO 中稀释相同剂量会引发感受器更强的神经反应[123]。SSR 技术的应用范围极为广泛,Jiang 等[55]利用SSR 技术验证了草地贪夜蛾Spodoptera frugiperda雄性触角中的感受器对雌虫产生的性信息素的反应,发现雄性触角中存在两种功能类型的长毛状感受器,分别对信息素Z9-14:Ac 和Z7-12:Ac 敏感。Dong 等[124]通过SSR 评估了大灰优食蚜蝇Eupeodes corollae雌虫和雄虫触角对10 种花香挥发物的嗅觉神经反应,根据尖峰幅度确定了该虫触角上感受器I 亚型中能够对甲基丁香酚和其他芳香族化合物起反应的神经元。还有研究者利用SSR 表征了致倦库蚊神经元对化学驱虫剂的反应,这对今后筛选新的驱蚊剂具有重要意义[113]。单感器记录仪是一种强大的勘测技术,为昆虫在嗅觉神经元的响应动态过程提供了的宝贵见解,开辟了探索昆虫神经反应的新途径,有利于将来开发有效的害虫防治新试剂。
5 气相色谱-单感器记录仪联用技术
气相色谱-单感器记录仪联用仪 (GC-SSR) 在近年来得到较快发展,通过该仪器可明确昆虫对特定信息化合物具有生理反应的嗅觉受体神经元ORN 及其灵敏程度,进而验证信息化合物诱发神经信号传导的过程[125]。操作GC-SSR 时,需将记录电极轻轻地压入感受器的底部,以建立与ORN 的电接触[126]。目前,该仪器可通过两种方式将电极与触角感器细胞接触:一种为玻璃刀片切除感觉器的顶端,将充满电解质溶液的电极与去顶的感觉器连结;另一种方法为用极细的钨丝电极从感觉毛基部一侧插入,电极顶端就和感觉细胞内部接触。随后,将样品放置在巴斯德管口的滤纸条上,通过刺激感觉器来确定样品的生物活性。通过接口放大器放大位于感觉器中的 ORN 的动作电位,当提取物引起 ORN 的响应时,随后将样品通过加热传输线注入到与 SSR 记录装置相连的气相色谱仪中。在气相色谱仪中,色谱柱末端安装一个分流器,一半的洗脱物通过加热传输线流向昆虫触角,另一半流向到FID 中,便可得到同时记录了ORN 的活性和在色谱柱上分离组分的色谱图。当受到不同气味的刺激时,ORN 表现出不同程度的特异性,可由神经元的尖峰幅度差异来区分单个ORN[127]。
GC-SSR 已成功运用在许多昆虫对特殊气味化合物的反应验证。Binyameen 等[102]通过GC-SSR,用GC 分离棉花和丁香花顶空提取物中的单个成分,用以刺激夜蛾科害虫Spodoptera littoralis细胞,从而判断一个神经元是否对 45 种刺激物中的任何一种做出反应。与使用GC-EAD 或使用单一SSR 的研究相比,使用GC-SSR 检测到OSN 和活性化合物的功能类别分别增加了40%和34%。Wang 等[85]在研究雌性烟青虫H.assulta识别烟草挥发物以及将哪些气味化合物用作产卵线索时,首先用GC-MS 初筛了14 种挥发性化合物,随后用SSR 验证了其对壬醛和庚醛可作出反应,且对壬醛的反应明显更强,而壬醛是烟青虫气味受体的主要配体。此外,GC-SSR 主要记录的是单个神经元的电位变化,而GC-EAD 主要记录的是昆虫整个触角的电位变化,故而GC-SSR 具有更高的分辨率和灵敏度。对于植物源挥发物活性组分的筛选、以及通过GC-EAD 无法筛选而遗漏的生物活性化合物,GC-SSR 可以作为 GC-EAD 的有力补充。例如使用GC-SSR,在蓝桉Eucalyptusglobulus中得到了6 种可以引起桉树蛀干害虫Phoracantha semipunctata的活性化合物,而使用GC-EAD 却无法检测到[128]。这可能是由于少量OSN 的活动导致受体电位的总和很小,达不到GC-EAD 的信号检测阈值,表明在识别具有生理活性的气味上,GC-SSR 是比GC-EAD 更优越的仪器。
6 展望
随着昆虫电生理学技术的快速发展,在信息素的分析、鉴定和表征方面,可获得的方法更加多样化,其应用范围也从信息素的快速鉴定扩展到分子细胞水平上的嗅觉机制及神经传导研究。EAG、GC-EAD、GC-MS、SSR 和GC-SSR 作为化学生态学研究的重要技术手段,各有优缺点,相辅相成。
1) 气相色谱与电生理技术的联合使用在提高了对昆虫性信息素的识别能力,具有快速分离、反应灵敏、可操作性强等优点,而GC-SSR 的出现将电生理技术推向了更精准的高度,可以灵敏、准确地检测到触角上不同感受器对信息素组分的特异性反应。目前,信息素的鉴定仍以GC-MS 为主,但该技术难以判定化合物双键位置、顺反构型以及手性异构的判定。
2) 国内对于Type II 信息素的鉴定以及一些带有旋光构型的物质仍难以筛选和鉴定,而一些具有重大危害的害虫,如春尺蠖Apocheima cinerarius和油桐尺蠖Buzura suppressaria等的性信息素至今尚未能成功破解。因此,核磁共振 (NMR) 和质谱 (MS) 等仪器分析技术也应加入鉴定的过程中,以确保准确获取挥发性代谢物的化学特性。
3) 全二维气相色谱飞行质谱联用仪 (GC × GCTOFMS) 等高分辨仪器在对具有EAG 活性化合物的分离鉴定中也起着非常重要的作用,但目前尚未看到有研究将全二维气相色谱技术与EAG 耦合使用的研究报道,在未来的研究中应注重不同技术的结合,提高化合物的分离度和结果的准确性。
4) 昆虫信息素通常具有挥发性较强、含量较低、组成复杂等特点,当仪器鉴定和量化信息素的灵敏度较低时,需要采用一些特殊的前处理方法进行捕获及富集。近年来,一些快速、高富集、高效提取方法正在应用于信息素的采集,比如固相微萃取技术、动态顶空分析法、顶空-固相微萃取和直接接触吸附萃取等,可将目标化合物富集在不同吸附材料 (如多孔聚合物、活性纤维或特殊涂层材料) 上,而吸附强度很大程度上依赖于材料对挥发性分子的亲和力,因此可根据不同化合物的分子质量来选择或优化不同的吸附材料性能。这些方法具有应用范围广、专一性高的优点,尤其是可从生物活体中直接获得VOC,在信息化合物采集及富集方面具有很大优势。
综上所述,研究者应根据研究目的,采用合理的试验方法才能得到准确的研究结果。随着对理论研究的不断深入,相信电生理技术将在化学生态分析领域中会有更广阔的应用前景。
