血清补体及IL-25 在SLE 中的表达及临床意义
2022-12-27王杨罗钰鸿廖媛
王杨 罗钰鸿 廖媛
SLE 是一种典型的、全身性的自身免疫性疾病,以多脏器系统受累及多种自身抗体阳性为主要临床特征。如果SLE 患者未得到及时诊治或病情长期未得到控制,将出现不可逆的器官损伤,甚至死亡。狼疮性肾炎(LN)是SLE 最常见和最重要的并发症;精神神经性狼疮(NPSLE)、血液系统受累也是SLE 的严重并发症[1-2]。补体(C)是一组在激活后存在于血清、组织液和细胞膜上的酶活性物质,是抗体发挥溶细胞功能的辅助物质,具有抗感染、免疫调节功能。C3 是血浆中含量最高的补体活性物质。C4 可以通过C1s 的水解过程产生C4a 和C4b 两种片段,这两种片段促进补体活化、细胞吞噬。总补体(CH50)活性检测结果反映C1~C49 的综合水平。在自身免疫性疾病中,疾病活动期补体被过度激活,CH50 水平下降,而当病情稳定时CH50 水平反应性升高。SLE的病理变化使患者血清中存在多种自身抗体,这些自身抗体与相对应的自身抗原形成大量免疫复合物(IC),广泛沉积于多脏器及系统中,激活补体可能造成这些部位的炎症损伤[3]。既往研究者认为,补体系统参与SLE,可用于SLE 患者的诊断和疾病活动情况的监测[4]。CRP 是急性时相蛋白,在SLE 中更常见的抗CRP 自身抗体并不针对天然循环CRP,而是针对表面上CRP 解离时暴露的表位[5]。双链DNA(dsDNA)是重要的遗传物质,抗dsDNA 抗体与DNA 结合形成的免疫复合体,其水平主要用于判断SLE 疾病活动度的情况以及疗效的监测[6]。IL-25 由2 型辅助性T 淋巴细胞(Th2)和肥大细胞、肺泡巨噬细胞等产生,调节机体的免疫反应,从而促进机体的炎症反应。研究表明,IL-25 通过抑制炎性细胞因子(包括IL-1α、IL-1β、IL-6、IL-12p70、IL-17A)的产生,缓解了SLE 小鼠的临床症状[7]。本研究探讨补体及IL-25 等指标在SLE 患者中的变化,为SLE 患者的诊断和疗效评价提供选择依据。
对象与方法
一、研究对象
2021 年7 月至2022 年3 月在本院诊治的151例SLE 患者,均符合《2020 中国系统性红斑狼疮诊疗指南》中的SLE 诊断标准[8]。根据2019 年欧洲抗风湿病联盟/美国风湿病学会(EULAR/ACR)SLE 分类诊断标准,按SLE 累及器官情况将151例患者分为单纯SLE 组 58 例、单器官损伤组67例(包括51 例LN、13 例SLE 血液系统损伤、3例其他器官损伤)、多器官损伤组26 例(包括25例LN 合并其他器官损伤、1 例血液系统损伤合并脑损伤)。排除标准:有其他风湿性疾病者,有恶性肿瘤者,合并其他基础代谢性疾病者,有感染性疾病者,有其他原因如心血管疾病、继发颅内病变、药物不良反应等所导致的器官损伤者。本研究经中山大学附属第三医院伦理委员会批准(批件号:中大附三医伦[2019]02-309-01),入组患者均已签署知情同意书。
二、方 法
于患者空腹状态下抽取静脉血,分离血清,使用日立7600 全自动生化分析仪以免疫比浊法检测C3、C4、CH50、CRP,其中C3 参考值范围为0.80~1.60 g/L,C4 参考值范围为0.10~0.40 g/L,CH50 参考值范围为23~46 kU/L,CRP 参考值范围为0~6 mg/L;以化学发光法检测抗dsDNA 抗体,将 ≥10 kU/L 定义为阳性;以ELISA 检测IL-25,通过标准曲线计算血清中IL-25 的水平。
三、统计学处理
使用SPSS 25.0 进行统计分析。计数资料采用例(%)表示,组间比较采用χ2检验。正态分布的计量资料采用 表示;非正态分布的计量资料采用M(P25,P75)表示,3 组间的比较采用Kruskal-Wallis H 检验,2 组间的比较采用Wilcoxon符号秩检验,组间两两比较采用Bonferroni 法校正,即P <0.05/3 = 0.017 为差异有统计学意义。α= 0.05。
结 果
一、3 组SLE 患者的一般资料比较
单纯SLE 组、单器官损伤组、多器官损伤组患者的性别构成比较差异无统计学意义(P >0.05)。与其他2 组相比,单纯SLE 组患者的年龄较大、病程较长(P 均<0.017)。见表1。

表1 3 组SLE 患者的一般资料比较
二、3 组SLE 患者的血清C3、C4、CH50、IL-25 和CRP 水平比较
单纯SLE 组、单器官损伤组和多器官损伤组患者间血清C4、CH50、IL-25 和CRP 水平比较差异均无统计学意义(P 均> 0.017)。3 组患者的血清C3 水平比较差异有统计学意义(P <0.05),其中多器官损伤组患者的血清C3 水平低于单纯SLE组(P <0.017)。见图1。

图1 3 组SLE 患者的血清IL-25、C3、C4、CH50 和CRP 水平比较
三、SLE 患者的血清C3 与C4、CH50、IL-25、CRP 水平的相关性分析
Spearman 相关性分析显示,SLE 患者的C3 水平与C4 水平(rs= 0.73,P <0.001)、CH50(rs=0.81,P <0.01)呈正相关,而与IL-25 水平呈负相关(rs= -0.14,P <0.001),与CRP 无相关性(P >0.05)。见图2。
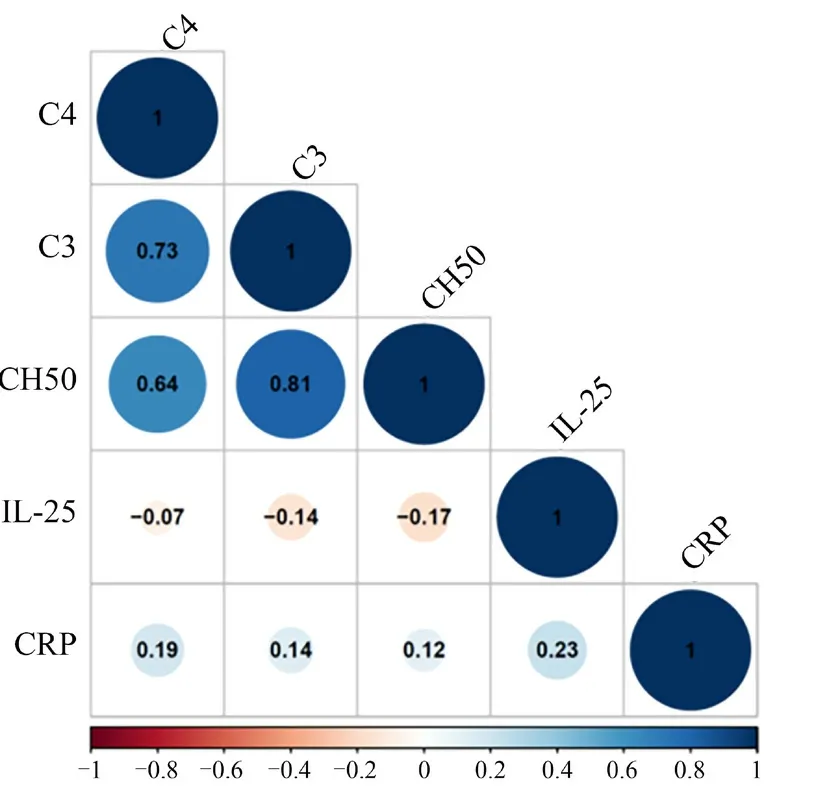
图2 SLE 患者的血清C3 与C4、CH50、IL-25、CRP水平的相关性分析
四、3 组SLE 患者抗dsDNA 抗体阳性率比较
单纯SLE 组、单器官损伤组和多器官损伤组患者的抗dsDNA 抗体阳性率分别为29%(17/58)、45%(30/67)和58%(15/26),组间比较差异有统计学意义(χ2= 6.663,P = 0.030);多器官损伤组的抗dsDNA 抗体阳性率高于单纯SLE 组(χ2=6.132,P = 0.013);单纯SLE 组与单器官损伤组间(χ2= 1.251,P = 0.263)、单器官损伤组与多器官损伤组间(χ2= 3.169,P = 0.075)的抗dsDNA抗体阳性率比较差异均无统计学意义。
讨 论
SLE 发病机制复杂,能够同时造成多种器官及系统损伤,且因免疫系统异常可出现多种自身抗体高表达,而自身抗体积累、IC 沉积以及无法建立免疫耐受可导致各种靶器官出现炎症性损伤[9]。
SLE 患者体内在疾病活动期和感染期均存在着大量IC,补体系统会被激活清除IC,从而导致C3和C4 被大量消耗,故C3、C4 在SLE 疾病活动期和发生感染的情况下会有所降低。CH50 反映血清中补体经典激活途径的溶血活性,其与C1~C9 各成分的数量及活性均有关,但随着C3、C4 水平及活性降低,血清CH50 活性及含量均会降低。虽然C3、C4 可以反映SLE 的疾病活动,但因为SLE急性期补体基因拷贝数和表达的个体差异及个体补体代谢率差异与疾病变化不同步,部分患者虽病情有所缓解但C3、C4 水平仍未恢复[10]。LN 是SLE 常见的重要脏器受累表现。研究显示,血清低C3 水平而非低C4 水平是LN 复发的标志[11]。本研究显示,多器官损伤组患者的C3 水平低于单纯SLE 组患者。CRP 是一种急性时相反应蛋白。在感染过程中,CRP 能针对侵入细胞发挥免疫调节作用和吞噬作用,并参与炎症反应[12]。本研究显示,单纯SLE 组、单器官损伤组及多器官损伤组的血清CRP 水平在组间比较差异无统计学意义,这可能与SLE 疾病活动期伴随IC 的清除,血浆CRP 清除加快有关。IL-25 是一种Th2 因子,通过异二聚体受体(IL-25R)发出信号。它通过信号级联、上皮和活化的T 淋巴细胞的成分参与促进2型炎症。Selvaraja 等[13]研究显示,IL-25 在SLE 患者中升高,高水平的IL-25 与SLE 疾病活动相关,但本研究显示3 组SLE 患者血清IL-25 水平比较差异无统计学意义,故IL-25 在SLE 中的作用还有待进一步研究探讨。本研究显示,SLE 患者的C3 水平与C4、CH50 水平呈正相关,而与IL-25 呈负相关,结果显示SLE 患者体内补体水平和炎症反应有一定关系。
抗dsDNA 抗体参与肾脏、皮肤和中枢神经系统(CNS)等多个终末器官的IC 形成和炎症损伤过程[14]。本研究显示,3 组SLE 患者的抗dsDNA抗体阳性率比较差异有统计学意义,其中多器官损伤组的抗dsDNA 抗体阳性率高于单纯SLE 组。
综上所述,血清C3 水平下降和抗dsDNA 抗体阳性提示SLE 患者可能出现多器官损伤,血清C3 水平和抗dsDNA 抗体检测对SLE 患者诊疗方案的制定和预后评估有积极意义。
