乙烯法合成氯乙烯中催化剂的研究进展
2022-12-27任跃功董建军
任跃功,董建军,杨 晨
(天津渤化化工发展有限公司,天津 300000)
乙烯法合成氯乙烯是吸热反应,需要引入适量催化剂来提高反应的进度和氯乙烯的产率。自Todo等人首次报道金属氯化物能够催化乙烯氧氯化合成氯乙烯以来[1],有关催化剂(如CrCl3、CuCl2、FeCl3等)的研究和专利连续被报道,并在科研人员多年攻关下逐步实现了部分催化剂的工业化应用。基于工艺的不同,目前乙烯法合成氯乙烯主要有两种路线,一是乙烯、氧气、氯化氢以及乙烯、氯气先合成1,2-二氯乙烷(EDC),随后1,2-二氯乙烷高温裂解成氯乙烯的两步法,该方法经过多年的运行和完善,已经在国内外多套化工装置上得到了熟练运用;二是乙烯、氧气、氯化氢直接氯化合成氯乙烯的一步法,该方法合成氯乙烯流程短、耗能相对较低,虽然仍处在实验室阶段,但已经成为各大高校和研究所的研发热点。不同工艺路线所采用的催化剂有所不同,本文基于大量的研究成果详细论述了两种乙烯法所用催化剂的发展情况和在反应中的作用机理。
1 乙烯两步法合成氯乙烯
经过多年的探索和实践,工业上主要采用乙烯两步法合成氯乙烯,该工艺以乙烯、氯化氢、氧气或者乙烯与氯气为原料,在催化剂作用下反应得到
1,2-二氯乙烷(EDC),随后1,2-二氯乙烷在高温条件下裂解生成氯乙烯,其反应流程见图1。

图1 乙烯两步法合成氯乙烯反应流程
乙烯、氯气直接氯化制备1,2-二氯乙烷需要在一定温度(50~100℃)和压力(0.2~0.5 MPa)下与L酸型催化剂(主要是Fe基催化剂)作用下才能快速进行,该反应符合典型的亲电加成机理,能够产生纯度很高的1,2-二氯乙烷,可以直接用于裂解生产氯乙烯[2]。乙烯、氯气、氧气反应不仅能够制备1,2-二氯乙烷,还可以实现HCl的循环,所使用的催化剂一直是科研人员研究的重点。以下着重介绍乙烯氧氯化反应制1,2-二氯乙烷中催化剂的技术进展。
1966年Todo等人报道了几种能够催化乙烯、氯化氢、氧气合成1,2-二氯乙烷的氯化物催化剂,其活性符合以下规律:CrCl3>CuCl2>MnCl2>NiCl2,值得注意的是,CuCl2催化体系中得到的1,2-二氯乙烷选择性远高于CrCl3催化体系。随后Hall等人[3]采用气体吸附色谱法在较低温(≤150℃)条件下测试了乙烯在含不同d电子金属氯化物上的吸附热,结果发现测试温度下乙烯在多种材料上的吸附能力遵循如下规律:CuCl2>NiCl2>CrCl3>FeCl2>MnCl2>CuCl。乙烯氧氯化反应测试结果表明,铜催化体系中可以得到较高的1,2-二氯乙烷产率,而镍催化体系中乙烯没有发生转化。随后科研人员从载体、助剂等方面研究,开发了具有工业化前景的铜系催化剂。
1.1 载体对催化剂的影响
科研人员以不同的氧化物(γ-Al2O3、α-Al2O3、SiO2、天然浮石等)为载体浸渍制备了铜系催化剂,并考察了其在乙烯氧氯化合成1,2-二氯乙烷中的催化性能。结果发现,CuCl2和载体表面之间的强相互作用力是影响催化剂活性、稳定性以及产物选择性的重要因素。
Leofanti等人[4]采用EPR技术分析了CuCl2/Al2O3催化剂上的铜物种,发现低铜负载量的载体上存在着与孤立的二价铜离子关联的不对称和轴对称信号。其中与轴对称信号关联的二价铜离子与载体之间作用力非常弱,能够通过有机溶剂清洗掉。采用SiO2代替Al2O3制备铜催化剂,EPR测试中并没有得到与二价铜离子相关联的信号,证明了铜离子与Al2O3之间存在较强的作用力。Rouco等人采用溶剂提取法对比了CuCl2与γ-Al2O3、α-Al2O3、SiO2之间的作用力,结果发现α-Al2O3和SiO2上的CuCl2可以100%溶解、提取出来,而γ-Al2O3上只有16%的CuCl2能够提取出来。XRD测试显示,浸渍法制备的CuCl2/α-Al2O3和CuCl2/SiO2上存在较小的CuCl2颗粒,而CuCl2/γ-Al2O3上只能测试到副氯铜粒子,这可能与γ-Al2O3表面含有大量的OH-基团有关[5]。
经过大量的研究可以得到载体与CuCl2之间的作用力强弱符合以下规律:γ-Al2O3>TiO2>SiO2>α-Al2O3。因为γ-Al2O3具有合适的孔结构、高比表面积、高机械性能、高抗热性及适度的酸性,更有利于抑制铜活性位的移动,进而更能提高铜系催化剂在乙烯氧氯化中的性能。代表性的载体负载铜催化剂在乙烯氧氯化中的催化活性数据见表1,CuCl2/γ-Al2O3催化剂表现出了最优的催化性能。
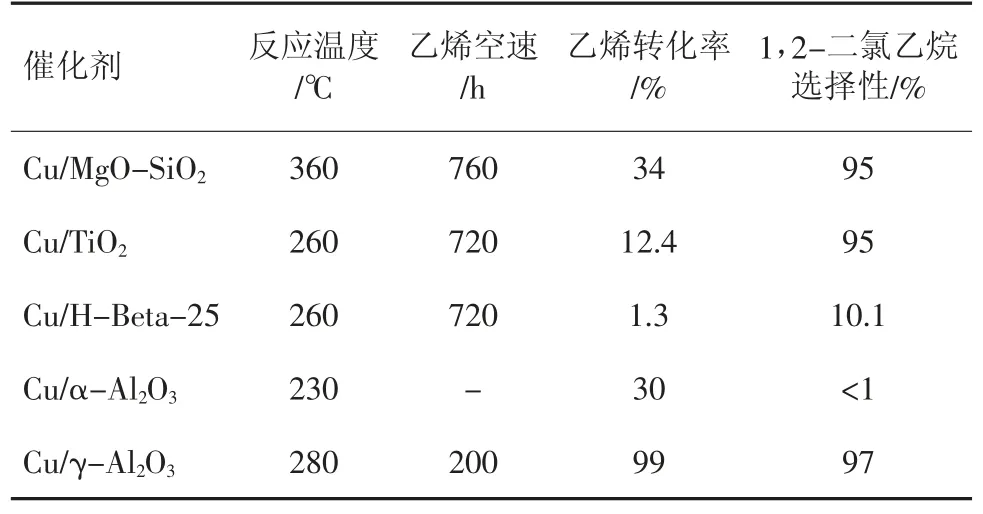
表1 铜系催化剂在乙烯氧氯化中的活性数据[6]
1.2 助剂对催化剂性能的影响
经过大量的研究可以获悉,CuCl2/γ-Al2O3催化剂上存在两种铜物种,即非活性的铝酸铜和具有催化性能的氯化铜。随着反应的进行,催化剂中的活性铜会因为升华和聚集导致催化剂快速失活,而通过引入合适的助剂填充氧化铝的空位可以增加活性位的含量,进而提高催化剂的活性和稳定性。目前所研究的助剂主要可以分为碱金属(Li、Na、K等)、碱土金属(Ca、Mg等)和稀土金属(Ce、La等)3大类。
一些具有代表性的助剂对CuCl2/γ-Al2O3催化剂的改性结果见表2。从表中数据可以得出,含锂、镁、镧的化合物助剂能够明显改善催化剂上铜组分的分散度,同时增加催化剂表面的B酸酸性,也在其表面形成了以金属离子为中心的L酸酸性位,但这些助剂的存在导致铜组分在乙烯氧氯化反应中易被还原成单质铜,造成铜离子活性组分的减少。含铯、钾的化合物助剂能够和催化剂上的铜离子形成复合化合物,这种化合物能够在反应中抑制铜离子的还原,同时对催化剂表面的L酸酸性位没有明显影响。

表2 不同助剂对铜催化剂的改性结果[6]
鉴于许多工业反应中采用多种助剂对催化剂进行改性和提升,科研人员随后探索了双组分和多组分助剂对铜催化剂促进作用的研究。其中研究最广泛的是K-La双组分助剂体系。例如,Garcia等人[7]采用连续浸渍和共浸渍的方法考察了K-La双组分助剂对Cu/SiO2、Cu/Al2O3催化剂的改性效果。研究发现K和La的协同作用对铜催化剂有很大影响,通过优化K、La的引入量可以明显提升铜催化剂的活性和抑制反应中积碳的形成。Rouco课题组随后采用流化床反应器考察了C2H2/N2、空气、HCl/空气和乙烯氧氯化反应气中CuCl2/γ-Al2O3催化剂上CuCl2、KCl、LaCl3活性组分的变化,发现Cu和K活性组分在乙烯氧氯化反应和C2H2/N2气中不断变化,而镧一直未受影响。丙酮选择性萃取实验、XRD和TPR表征结果表明KCl、LaCl3不仅和载体γ-Al2O3之间存在强相互作用,还能够在不影响铜化学价态的前提下改善铜活性位的分散性,特别是La组分能够在不影响反应活化能的前提下提升催化剂性能。此外还发现,当反应温度低于250℃时,KCl反而会对催化剂起到副作用,可能与KCl改变了反应的活化能有关。目前关于多种组分助剂对铜催化剂改性的研究还比较少,一部分专利中提到了采用贵金属或贵金属氯化物(Eu、Pd、Au)修饰含Cu-Mg-K体系催化剂,不仅可以提升催化剂的性能和主产物的选择性,还能抑制产物过度氧化为碳化物[8]。
目前工业上主要采用固定床反应器和流化床反应器来催化乙烯氧氯化制备氯乙烯。其中研究最多的是固定床反应器中助剂对CuCl2/γ-Al2O3催化剂的改性效果,并取得了非常不错的成果。而不同助剂修饰的铜催化剂在流动床反应器中的研究较少。这主要是由于CuCl2/γ-Al2O3催化剂在流化床反应器流化过程中易粘结,虽然添加适量的助剂(例如Li、K、Cs、Ba和La)能够部分抑制催化剂的黏性,但这种附加方法只能起到部分作用,并不能消除氯化铜活性组分的本质缺陷以及在反应过程中的机械稳定性。
1.3 铜催化体系反应机理
科研人员基于实验和表征结果在分子水平上对铜催化乙烯氧氯化的反应机理、固体表面动力学以及催化剂结构-性能关系进行了深入探索。由于氯化氢氧化和氧氯化反应相似,早期研究认为,反应过程中氯化氢首先被氧气氧化为氯气,随后产生的氯气与乙烯反应形成氯乙烯,并伴随着许多副反应发生(称为Deacon机理)。不过Deacon机理不能合理解释基元反应中1,2-二氯乙烷(EDC)高选择性的原因。随后的动力学实验发现,在180℃进行测试时无法得到适合乙烯氧氯化过程的动力学关系式。Todo等人随后通过计算发现,乙烯氧氯化反应过程中铜系催化剂上形成的氯气几乎可以忽略,进一步表明Deacon机理不适合解释乙烯氧氯化过程。Lamberti等人采用近原位XAS技术详细的研究了乙烯、氧气、氯化氢在新鲜的、反应后的催化剂上的吸脱附过程,推测铜催化乙烯氧氯化反应过程主要经历3个重要步骤(MvK机理见图2)。

图2 铜催化乙烯氧氯化反应的MvK机理
(1)乙烯与氯化铜反应形成氯化亚铜和氯乙烯;(2)氯化亚铜与氧气反应形成氧氯化物(Cu2OCl2);(3)氧氯化物与氯化氢反应形成氯化铜,其中CuCl的氧化可能是反应的决定性步骤。近期,Rout课题组采用紫外可见近红外(UV-vis-NIR)和质谱(MS)结合技术研究了乙烯氧氯化的中间过程,印证了MvK机理的准确性[9]。
当前,铜系材料仍然是乙烯氧氯化合成1,2-二氯乙烷的重要催化剂,无论其催化性能还是制备成本都具有很大优势。自1955年陶氏化学在美国建立第一套乙烯氧氯化工业化装置以来,铜系催化剂已经成为世界各国化工企业生产氯乙烯体系中非常重要的部分。
2 乙烯一步法合成氯乙烯
在乙烯两步法合成氯乙烯过程中,乙烯的转化程度、中间产物1,2-二氯乙烷的选择性高低等因素的微小波动都会影响企业的生产能耗、产品氯乙烯的纯度和后期“三废”的处理。在当前新化工技术快速发展的基础上,开发多功能催化材料和工艺方法促使乙烯、氧气、氯化氢一步反应合成氯乙烯,简化工艺过程、降低生产成本,已经成为众多化工人的期望。乙烯一步法合成氯乙烯反应流程图见图3。

图3 乙烯一步法合成氯乙烯反应流程图
早期科研人员期望通过优化反应工艺,在不改变乙烯两步法合成氯乙烯的工业装置和催化剂的前提下实现一步法合成氯乙烯的目标。但由于乙烯两步法工艺中两个反应之间的温度差距较大,工业上的铜系催化剂还无法弥合两步过程的温度差距,主要是因为在高温下金属活性组分容易挥发、流失。早期的专利[10,11]中显示,含不同助剂的钯、铑氯化物催化剂在乙烯、氧气、氯化氢一步法合成氯乙烯具有一定活性,得到了少量氯乙烯产物。共沉淀法合成的氧氯化镧(LaOCl)则可以催化乙烯氧氯化一步得到选择性78%的氯乙烯[12],但LaOCl在反应中需要3.6~8.7 s的接触时间才能达到较优效果,极大限制了其大规模的应用。以下详细介绍了近些年研究的氧化铈催化剂在乙烯一步法合成氯乙烯中的研究成果。
Scharfe等[13]采用共沉淀法合成了纳米级的RuO2、IrO2、CeO2催化剂,在常压、350~400℃反应温度下催化乙烯、氯化氢和氧气反应,能够实现10%~18%的乙烯转化。然而IrO2催化体系中只能得到CO和CO2产品,RuO2催化体系中则可以得到选择性8%左右的1,2-二氯乙烷和5%的氯乙烯,CeO2催化体系中可以获得选择性86%的1,2-二氯乙烷、10%的氯乙烯和极少量的CO。作者考察了4种组分1,2-二氯乙烷、1,2-二氯乙烷+O2、1,2-二氯乙烷+HCl、1,2-二氯乙烷+O2+HCl在不同床层温度下与CeO2催化剂之间的作用机制(图4a),发现即使升温到450℃,1,2-二氯乙烷在CeO2上依旧没有发生变化。而分别引入O2、HCl以及两种混合气体后,1,2-二氯乙烷开始发生转化形成氯乙烯,并能得到最高90%的氯乙烯产率,表明一步法中氯乙烯来源于1,2-二氯乙烷的原位脱氯过程。采用NH3-TPD技术对反应前后CeO2催化剂上的酸性点进行分析,未反应的催化剂在中温度段有少量的酸性位,而反应后催化剂上的酸性量和酸性强度明显增强,在催化剂表面的氧化反应中心发生了乙烯氯化反应形成1,2-二氯乙烷,随后1,2-二氯乙烷在催化剂酸性位作用下裂解形成氯乙烯。

图4 不含和含O2、HCl、O2+HCl的1,2-二氯乙烷脱氯反应中氯乙烯产率(a)和反应前后CeO2催化剂的NH3-TPD结果(b)
Scharfe等[14]采用密度泛函数理论计算和动力学稳态实验对CeO2催化乙烯氧氯化过程进行了瞬态动力学研究,发现反应原料先原位合成1,2-二氯乙烷,随后1,2-二氯乙烷与HCl作用形成氯乙烯。其中CeO2表面氯化形成的CeOCl物种促进了氯乙烯的合成,而表面存在的氧空位则会导致反应过程中形成的1,2-二氯乙烷和氯乙烯转化为1,1-二氯乙烷。此外还发现反应过程中氯代烃和乙烯的燃烧会分别形成CO和CO2副产物,进而降低氯乙烯的选择性。
3 结论和展望
使用绿色催化剂的乙烯法合成氯乙烯工艺高效、环保,市场所占份额越来越大。工业上主要采用Cu基催化剂催化乙烯、氯化氢、氧气及Fe基催化剂催化乙烯与氯气反应合成1,2-二氯乙烷,随后1,2-二氯乙烷高温裂解得到氯乙烯,并最终实现氯化氢的循环。以CeO2为催化剂的乙烯一步法合成氯乙烯简化了工艺流程,进一步降低能耗、减少设备需求,得到了科研人员广泛的关注。尽管乙烯一步法合成氯乙烯还处在实验室阶段,但随着新技术的不断发展和科研成果的不断累积,科研人员在技术累积的过程中定能开发出一种高效的绿色催化剂,不仅能够催化乙烯、氯化氢、氧气一步合成氯乙烯,还能降低生产对环境的影响和降低氯乙烯单体和聚氯乙烯的生产成本,为企业创造更高的效益。
