不同程度近视患者视盘区视网膜微循环变化特点分析
2022-12-27程翠杰
程翠杰,谢 驰,方 严
0引言
高度近视是世界范围内视力丧失主要原因之一,每年患病率大幅度上升,尤以东亚地区显著[1]。轴性近视者屈光度的加深,实质是屈光介质生理性状的转变。眼轴轴向延长,主要是玻璃体腔深度上调,进而反馈调节角膜、晶状体补偿性改变。进展为高度近视阶段,长眼轴附加眼底血管相关病变的风险明显增加,特别是视网膜出血和裂孔、脉络膜新生血管等,对视力造成严重损害[2-3]。组织病理学研究,高度近视相较于其他近视群体,视网膜无灌注区、局部缺血缺氧程度显著增加[4],可见近视进展与视网膜灌注减少有关。由于视网膜微血管系统直接滋养视网膜组织,因此了解视网膜微循环变化规律有助于了解近视性眼底进展阶段及程度。光学相干断层扫描血管成像(optical coherence tomograph angiography, OCTA)是一种现代无创、活体眼部血管成像技术,主要基于红细胞运动信息可视化视网膜与视盘血流循环,能高分辨呈现分层区间内视网膜、脉络膜循环异常并定量分析血流变化情况,对隐匿性病变或细微损伤,仍能精准捕捉,具有良好的重复性及再现性,广泛应用于眼科疾病诊疗[5-6]。因此本研究旨在借助OCTA探讨不同近视程度患者视盘区微血管密度(microvessel density,MVD)与视网膜神经纤维层(retinal nerve fiber layer,RNFL)厚度的变化特征,为不同程度近视患者之间的生理变化提供基线信息,进一步发掘近视患者血流变化机制。
1对象和方法
1.1对象采用前瞻性病例对照研究,于2020-05/2021-01于安徽理工大学第一附属医院(淮南市第一人民医院)招募健康受试者,年龄16~62岁,标准对数视力表检查最佳矫正视力(BCVA)≥0.8,眼压<21mmHg并且双眼眼压差值≤5mmHg纳入研究范围。排除弱视、屈光参差、病理性近视、直系亲属青光眼病史、玻璃体或视网膜手术史,屈光介质混浊及糖尿病等波及眼部循环系统的全身疾病者。本研究严格遵循《赫尔辛基宣言》宗旨进行,通过本院伦理委员会批准,并向受试者详细解释说明本研究目的,征得同意后,签署知情同意书。
1.2方法所有受试者均给予全面眼部检查包括非接触式眼压器测量眼压;裂隙灯生物显微镜检查眼前段;IOL Master测量6次眼轴长度(axial length,AL)取其平均值作为分析量;0.1%复方托吡卡胺滴眼液充分麻痹睫状肌,解除晶状体调节进行静态视网膜检影验光同时完善眼底检查;AngioVue OCTA系统测量视盘周围血管密度和RNFL厚度。采用 Optovue 量化 Angio OCT 血流成像,由同一技术人员进行图像采集,模式选为Angio Disc 4.5mm×4.5mm。受试者下颌及前额紧贴于颌架内,保持至完整扫描结束。目光固视于设备内指示灯,最大程度降低瞬目及扫视的频率,以防引发双血管图案和运动伪影影响结果的准确性及读取图像的困扰。设备距视盘中心固定直径3.4mm附近处,连续两组对视盘区视网膜快速行水平方向及垂直方向的栅格扫描,运动校正对正交影像进行校准,内置计算软件自动测量 ISNT四个象限RNFL厚度和Garway Heath八个象限RNFL厚度及血管密度,并由一名经验丰富的专家对最终血流图、en face图等综合评估,将多次扫描结果仍血管成像不清晰或扫描信号强度指数<6;系统存在血管网络分割错误等不符病例排除。

2结果
2.1纳入研究的受试者一般资料本研究共纳入受试者51名102眼。因多次扫描信号强度仍低于6分或存在运动伪迹而排除8眼,最终纳入94眼,依据AL划分为三组,将23mm≤AL<24mm且等效球镜度数(spherical equivalent,SE):+0.50~-0.50D为正视组31眼,24mm≤AL<26mm且-0.75≤SE<-6.00D为低中度近视组32眼,AL≥26mm且SE≥-6.00D为高度近视组31眼。三组受试者眼压、年龄及性别比较差异均无统计学意义(P>0.05),见表1。

表1 纳入研究的受试者一般资料
2.2三组受试者RNFL厚度比较ISNT分区法中,三组受试者RNFL厚度比较 ,颞侧、上侧、鼻侧和下侧RNFL厚度差异均有统计学意义(P<0.05)。进一步两两比较时,正视组颞侧象限RNFL厚度低于低中度近视组和高度近视组,差异均有统计学意义(P<0.0167)。在上侧、鼻侧和下侧象限,高度近视组RNFL厚度均低于正视组和低中度近视组,差异均有统计学意义(P<0.0167)。在Garway Heath分区法中,三组受试者RNFL厚度比较 ,颞上、鼻上、鼻下和下鼻象限RNFL厚度差异均有统计学意义(P<0.05)。两两比较时发现,在鼻上、鼻下和下鼻象限,正视组和低中度近视组RNFL厚度高于高度近视者组,差异均有统计学意义(P<0.0167)。而在颞上象限,高度近视组RNFL厚度高于正视组,差异有统计学意义(P<0.0167)。其他象限RNFL厚度差异无统计学意义(P>0.0167),见图1,表2、3。
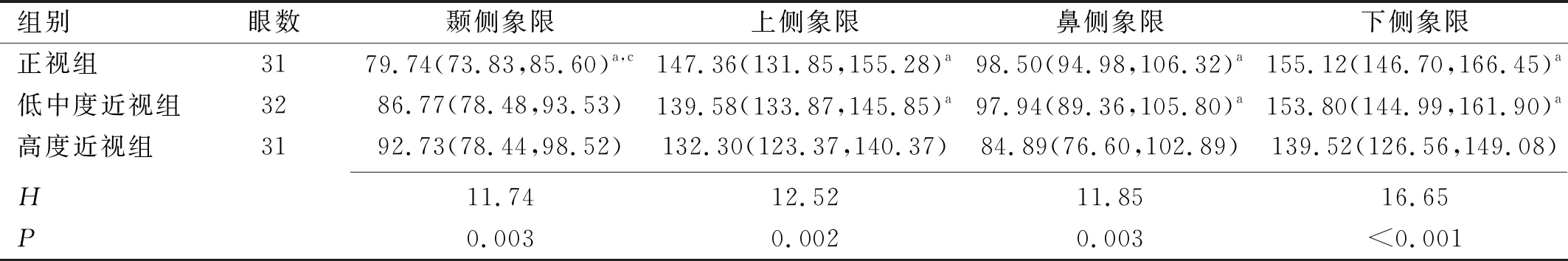
表2 ISNT分区法中三组受试者视盘周围RNFL厚度比较 [M(P25,P75),μm]
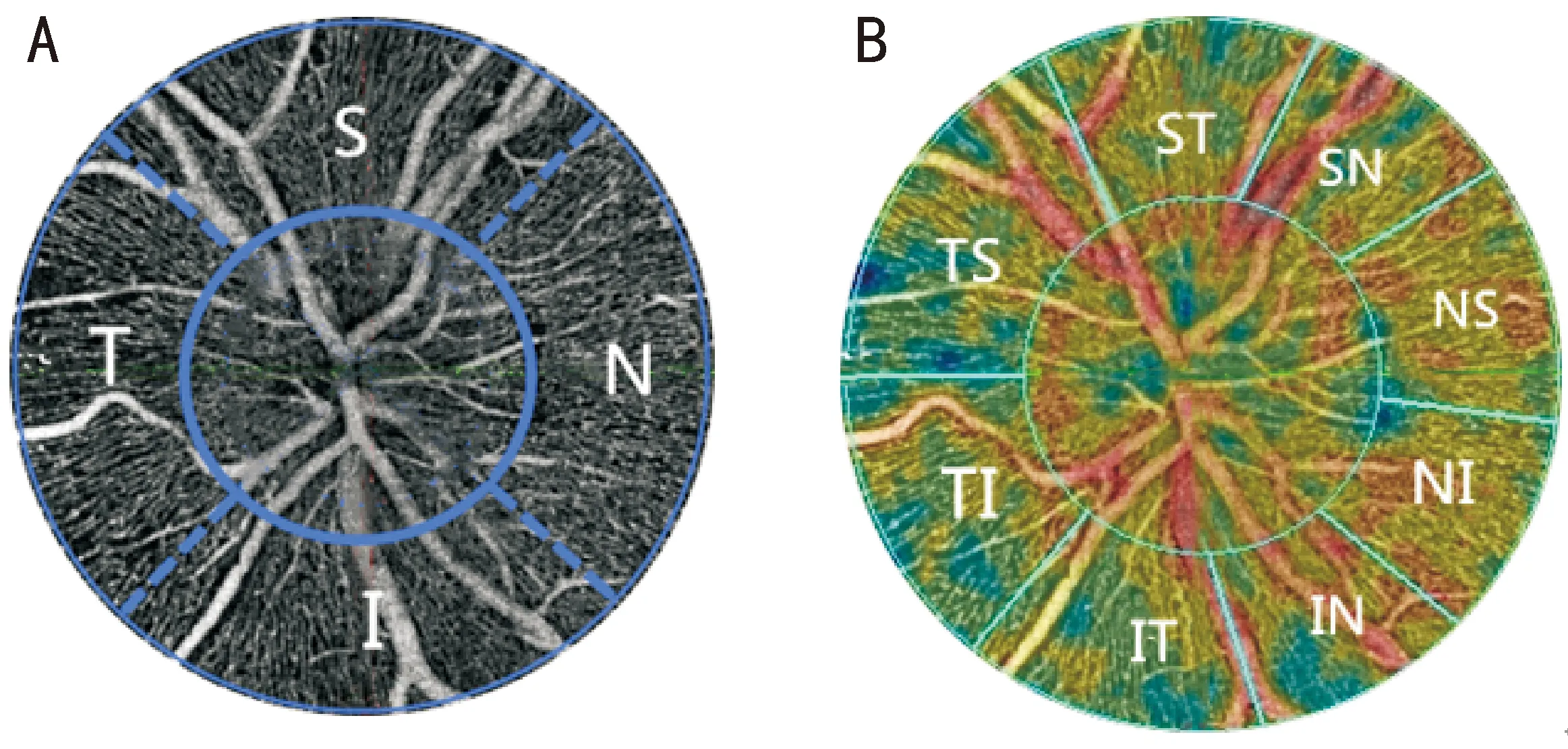
图1 视盘区两种分区法划分示意图 A:ISNT分区法;B:Garway Heath分区法。
2.3视盘区RNFL厚度与AL的相关性分析在ISNT四分区中,颞侧RNFL厚度与AL呈正相关(r=0.343,P<0.05),上侧、下侧及鼻侧象限与AL呈负相关(r=-0.341、-0.289、-0.269,均P<0.05)。 在Garway Heath分区法中,仅颞上象限RNFL厚度与AL呈正相关(r=0.382,P<0.05),鼻上、鼻下及下鼻象限RNFL厚度与AL呈负相关(r=-0.226、-0.211、-0.369,均P<0.05)。而上颞、下颞和颞下象限RNFL厚度与AL未见相关性(均P>0.05)。
2.4三组受试者视盘区MVD比较三组整体比较时鼻上象限、鼻下象限、下鼻象限、盘周整体及盘内整体MVD差异均有统计学意义(P<0.05),其他区域MVD差异均未见统计学意义(P>0.05)。两两比较时发现,在鼻上、鼻下象限,高度近视组MVD少于正视组与低中度近视组,差异均有统计学意义(P<0.0167)。正视组下鼻象限和盘周整体MVD高于高度近视组,差异均有统计学意义(P<0.0167)。而盘内整体MVD,高度近视者组多于正视组和低中度近视组差异均有统计学意义(P<0.0167)。其他区域MVD差异均未见统计学意义(P>0.0167),见表4。

表4 三组受试者视盘区微血管密度比较 [M(P25,P75),%]
2.5视盘区MVD与AL相关性分析鼻上、鼻下、下鼻象限和盘周整体MVD与AL呈现负相关(r=-0.316、-0.304、-0.241、-0.361,均P<0.05)。盘内整体MVD密度与AL呈正相关(r=0.376,P<0.05)。其他象限MVD与AL均无相关性(均P>0.05)。

表3 Garway Heath分区法三组受试者视盘周围RNFL厚度比较 [M(P25,P75),μm]
3讨论
近视是远距离视物清晰度下降的首要原因,但近视病因和发病机制尚未完全清楚[2]。目前,国内外较为公认的机制为多种因素共同促使眼球前后径长度增加,造成焦点无法集合于视网膜上。近视性眼底改变主要取决于AL,而与屈光度相关的角膜因子和晶状体透明度关联较小,且屈光度易出现折射误差,AL更加精准体现近视进程与视网膜微循环的潜在关系。眼球逐渐拉长过程中易造成视网膜微血流调控紊乱,作为视觉传导枢纽的视盘,微循环障碍对视功能造成潜在威胁。并且贴近生理构造层的血管成像才能最佳反映其病理变化,因此仅对Garway Heath分区法中的血管密度进行分析。本研究将AL设为自变量协控多种因变量,借助OCTA对视网膜细微异变的高度灵敏性,研究不同程度近视者视盘区微循环的变化情况。视盘区域MVD分析结果显现眼球轴向长度与MVD存在密切联系。本研究发现高度近视较非高度近视群体,鼻上、鼻下和下鼻象限MVD减少,且血流密度改变与AL呈现负相关。Yang 等[7]研究证实中国成年高度近视者鼻下、下鼻及鼻上区域血液灌注量明显低于低度、中度近视者,与本研究结果基本一致。Wang 等[8]证实相对于正视眼人群,高度近视眼盘周血流指数和血管密度明显降低,同时,血管特征改变可能增加血管相关眼病的易感性。同样的,Yang等[7]和Li等[9]研究证明高度近视人群视盘鼻侧视网膜血管密度明显降低,与本研究结果类似。然而,已有文献报道了不同结果,赵秋雅等[10]仅发现颞侧象限血管密度与AL呈显著负相关,可能存在个体异质性,导致眼底结构受AL影响程度不同。对于病理性高度近视者盘周血流密度是否进一步下降,Chen等[11]研究证将伴有病理改变的高度近视人群纳入队列,发现单纯高度近视组视盘周围MVD高于高度近视并发病理改变组。由此本研究推测非高度近视与高度近视间可能存在一临界状态进行转化。当血管弹性、神经纤维机械应力等逆牵拉反应逐渐突破极限难以抵抗邻近组织对视网膜外延力,微循环相对稳态被破坏,致使MVD下调低于该阈,刺激视网膜微循环产生质的变化,但需更多的研究来验证。
另外,本研究中其余象限MVD变化虽未见组间显著差异,但仍呈轻度下降趋势。由此可见,近视发展影响视盘区周围整体微循环灌注,只是区域受累程度不均,其中鼻侧受累损伤程度较为明显。这或许对于糖尿病合并高度近视患者来讲是保护性病变,视盘周围低代谢水平降低血糖紊乱带来的血管异变和神经毒性作用,从而降低或延缓糖尿病性视神经病变[12]。同样,糖尿病作为视网膜静脉阻塞(retinal vein occlusion,RVO)的高危因素,短眼轴是否会上调RVO患病率仍存在争议。现阶段OCTA仅可评估4.5mm×4.5mm内的视盘区视网膜,此范围内鼻侧视网膜由后极部逐渐衍变为中周部,伴随毛细血管网层数减少,神经纤维缺乏物理支持,而颞侧视网膜仍属于血管丰富,血液充足的后极部,这可能造就鼻侧视网膜对环境因素反应能力更加灵敏[13]。有趣的是,视盘内MVD随近视进展而逐渐密集,而沿生理凹陷弯曲环放射状进入视网膜表层后,血流灌注量却降低。本研究猜测可能后巩膜重塑对视盘牵拉的受力点主要位于盘沿曲折处,运送通道的异形、功能不良阻滞血液输送,但需进一步研究检验。
Akhtar等[14]和Kang等[15]研究观察到相较于正视者,高度近视RNFL厚度显著单薄化。同时,Vernon 等[16]报道长眼轴相较于短眼轴,鼻部RNFL变薄明显,与本研究结果一致。本研究还发现颞侧RNFL变化较为特殊,随AL延伸而呈现增厚趋势。Yang 等[7]研究也同样证实此结果,猜测可能与视盘颞侧视网膜牵拉神经纤维移位所致。而在Garway Heath分区中,高度近视鼻上、鼻下和下鼻象限RNFL厚度较其他近视群体变薄,仅在颞上象限观察到增厚趋势。可见根据视网膜生理特点细致分区,更加贴近真实近视眼底改变。
值得注意的是,高度近视和开角型青光眼可能共有相关基因,支持两种病变可能存在视盘重叠体征[17]。青光眼RNFL厚度跟随神经节细胞进行性凋亡而丢失,而近视患者RNFL缺失较为缓慢,似乎与AL改变保持同速化。Yu 等[18]报道青光眼患者较健康者视盘内微血流削减,且临床研究已证实高度近视眼底变化扰乱青光眼典型视盘改变,或许借助OCTA对视网膜细微异变的高敏感性,并划定视盘内正常基线微血流水平结合结构指标RNFL可以成为新型诊疗手段,并有效预测及监测青光眼的进程。
目前,对于引起长眼轴视网膜微循环改变的触发因素至今未明确。有报道猜测RNFL的丧失可能影响区域需氧,触发自动调节机制降低血液灌注水平[19]。而Li 等[20]认为视盘区MVD降低可能早于结构指标RNFL的变化。究竟源头是血管因素还是结构因素,更值得深入思考,毕竟不同触发点引发一系列级联反应机制并非相同。因此未来应确定首发改变,再进一步分析AL、视盘区MVD和RNFL相处模式,更好地认识疾病的本质,为近视有效预防及治疗提供正确方向。
综上所述,视盘区MVD和RNFL厚度与AL紧密相关,高度近视人群视盘鼻上、下鼻和鼻下象限MVD下降并且RNFL厚度变薄,而盘内血流呈增长趋势且OCTA可以作为研究近视发展的客观手段,并有助于发现与近视相关的疾病。但本研究样本量小,且缺乏纵向动态性研究,应排除局限因素,联合重复性优的OCTA,以获取更可靠的结果。
