不同情况淋巴瘤患者血清LDH、β2-MG、IL-2R及IL-10水平变化及临床意义
2022-12-27曾文兴敖继红
曾文兴,万 颖,敖继红
江西省宜春市人民医院检验科,江西宜春 336000
淋巴瘤原发于淋巴结或其他淋巴组织,发病率呈上升趋势,是严重威胁人类健康的恶性肿瘤[1]。淋巴瘤分为B细胞非霍奇金淋巴瘤(B-NHL)、T细胞非霍奇金淋巴瘤(T-NHL)和霍奇金淋巴瘤(HL)。有研究表明,EB病毒(EBV)的潜伏膜蛋白、核抗原1、编码的小RNA蛋白被激活时,与淋巴瘤的发生、发展存在密切关系,并影响淋巴瘤的转归[2]。随着研究的深入,近年来发现越来越多的血清标志物与肿瘤发病密切相关,而某些灵敏度及特异度较高的血清标志物对临床诊断、疗效及预后的评估至关重要。其中β2微球蛋白(β2-MG)与乳酸脱氢酶(LDH)在淋巴瘤诊断中的意义越来越受到重视[3];而国外研究表明,细胞因子具有细胞信号转导、促炎症和免疫调节功能,其中白细胞介素(IL)-2R表达异常与淋巴瘤的发生、发展相关[4]。因此,淋巴瘤作为人体免疫系统的恶性肿瘤,血清标志物LDH、β2-MG、IL-2R、IL-10水平与EBV感染相关淋巴瘤及其组织免疫学类型发生、发展等的关系值得研究。
1 资料与方法
1.1一般资料 选取2018-2021年于本院确诊的50例淋巴瘤患者作为淋巴瘤组,其中男32例,女18例;年龄23~76岁;HL患者3例作为HL组,B-NHL患者34例作为B-NHL组,T-NHL患者13例作为T-NHL组;临床分期Ⅰ~Ⅱ期15例,Ⅲ~Ⅳ期35例;存在EBV感染者35例作为EBV+组,不存在EBV感染者15例作为EBV-组;有骨髓浸润34例,无骨髓浸润16例。选取同期体检健康者20例作为对照组,其中男12例,女8例;年龄32~70岁。淋巴瘤组和对照组年龄、性别比较,差异无统计学意义(P>0.05),具有可比性。淋巴瘤纳入标准:(1)经病理组织或细胞学确诊;(2)患者年龄≥18岁。排除其他恶性肿瘤,溶血,心、肝、肾功能严重损伤,肝硬化,免疫性疾病等。本研究经本院医学伦理委员会批准,所有受试者均知情同意。
1.2仪器与试剂 LDH和β2-MG检测试剂购自宁波美康生物科技有限公司;IL-2R和IL-10检测试剂购自青岛瑞斯凯尔生物科技有限公司;ADVIA2400全自动生化分析仪购自美国西门子公司;流式细胞仪购自美国BD公司。
1.3检测方法 采集受试者空腹静脉血3 mL,室温静置20 min,以3 000 r/min离心10 min,分离血清。LDH采用速率法检测,β2-MG采用胶乳增强免疫透射比浊法检测,IL-2R和IL-10采用免疫荧光法检测。
1.4治疗方案 NHL患者接受CHOP方案(静脉推注环磷酰胺750 mg/m2,第1天;静脉推注长春新碱1.4 mg/m2,第1天;静脉滴注阿霉素50 mg/m2,第1天;口服醋酸泼尼松100 mg/m2,第1~5天,21 d为1个周期,疗程间隔3周),HL患者接受ABVD方案(静脉推注阿霉素25 mg/m2,第1及第15天;静脉推注博莱霉素10 mg/m2、长春碱6 mg/m2、达卡巴嗪375 mg/m2,疗程间隔2周),并结合放疗治疗;2个周期后观察患者血清LDH、β2-MG、IL-2R和IL-10水平变化。
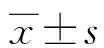
2 结 果
2.1淋巴瘤组与对照组血清LDH、β2-MG、IL-2R、IL-10水平比较 与对照组比较,淋巴瘤组血清中LDH、β2-MG、IL-2R及IL-10水平升高(P<0.05)。见表1 。
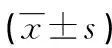
表1 淋巴瘤组与对照组血清LDH、β2-MG、IL-2R、IL-10水平比较
2.2血清LDH、β2-MG、IL-2R、IL-10水平在不同EBV状态淋巴瘤患者中的比较 与EBV-组比较,EBV+组血清LDH、IL-2R、β2-MG水平升高(P<0.05),但IL-10水平差异无统计学意义(P>0.05)。见表2。
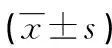
表2 血清LDH、β2-MG、IL-2R、IL-10水平在不同EBV状态淋巴瘤患者中的比较
2.3血清LDH、β2-MG、IL-2R、IL-10水平在不同组织免疫学类型淋巴瘤患者中的比较 与对照组比较,T-NHL、B-NHL、HL组血清LDH、β2-MG、IL-2R及IL-10水平升高(P<0.05);但T-NHL、B-NHL、HL组血清LDH、β2-MG、IL-2R、IL-10水平比较,差异无统计学意义(P>0.05)。见表3。
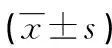
表3 血清LDH、β2-MG、IL-2R、IL-10水平在不同组织免疫学类型淋巴瘤患者中的比较
2.4血清LDH、β2-MG、IL-2R、IL-10水平在不同临床分期淋巴瘤患者中的比较 与临床分期Ⅰ~Ⅱ期患者比较,Ⅲ~Ⅳ期患者血清LDH、β2-MG、IL-2R水平升高(P<0.05),但IL-10水平差异无统计学意义(P>0.05),见表4。
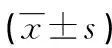
表4 血清LDH、β2-MG、IL-2R、IL-10水平在不同临床分期淋巴瘤患者中的比较
2.5血清LDH、β2-MG、IL-2R、IL-10水平在不同骨髓浸润情况淋巴瘤患者中的比较 与无骨髓浸润患者比较,有骨髓浸润患者血清LDH、β2-MG、IL-2R水平明显升高(P<0.05),但IL-10水平差异无统计学意义(P>0.05),见表5。
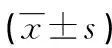
表5 血清LDH、β2-MG、IL-2R、IL-10水平在不同骨髓浸润情况淋巴瘤患者中的比较
2.6血清LDH、β2-MG、IL-2R、IL-10水平在淋巴瘤患者治疗前、后的比较 与治疗前比较,治疗后血清LDH、β2-MG、IL-2R、IL-10水平降低(P<0.05),见表6。

表6 血清LDH、β2-MG、IL-2R、IL-10水平在淋巴瘤患者治疗前、后的变化

组别nIL-2R(U/mL)治疗前治疗后IL-10(pg/mL)治疗前治疗后淋巴瘤组503 112.56±1127.09825.5±130.21a77.33±13.0825.37±11.76aEBV+组353 692.92±981.391 677.56±526.36a81.85±14.3934.12±14.56aEBV-组152 068.45±617.11607.25±113.36a74.25±4.7116.75±9.63a
3 讨 论
淋巴瘤是严重危害人体健康的恶性肿瘤之一,常以浅表淋巴结无痛性进行性肿大或伴发热、消瘦及肝脾肿大为表现。研究发现EBV基因组的相对高拷贝性、EBV的持续潜伏感染等均是致瘤的重要因素,与HL、伯基特淋巴瘤、弥漫大B细胞淋巴瘤、结外NK/T细胞淋巴瘤、外周T细胞淋巴瘤(非特指型)及血管免疫母T细胞淋巴瘤等的发生、发展密切相关[5]。原因[6]:(1)曾经患传染性单核细胞增多症的人群HL发病风险是健康人群的4倍;(2)EBV包膜抗原抗体效价上升;(3)淋巴瘤细胞中证实存在单克隆性的EBV附加体。(4)大多数淋巴瘤细胞中存在克隆游离的EBV。目前淋巴瘤EBV感染患者实验室检查仅表现为血清C-反应蛋白升高及白细胞、血小板、血红蛋白降低等,结果缺乏特异性[7]。随着研究的深入,某些灵敏度及特异度较高的指标对疾病的诊断、疗效及预后的评估至关重要。
LDH是一种糖酵解酶,在无氧酵解和糖异生中发挥重要作用。有研究认为恶性肿瘤患者LDH水平升高的原因为肿瘤细胞的糖酵解速度高于健康人群,且糖酵解会导致多种酶活性改变,而作为糖酵解重要酶类的LDH活性也随之升高,由于恶性肿瘤细胞的代谢加快及细胞膜通透性改变等,导致癌组织酶释放至血液,从而破坏了血液循环中酶的正常动态平衡,使患者血清LDH水平升高[8]。在本研究中,淋巴瘤组血清LDH水平高于对照组(P<0.05),EBV+患者血清LDH水平高于EBV-患者(P<0.05),临床分期Ⅲ~Ⅳ期患者血清LDH水平高于Ⅰ~Ⅱ期患者(P<0.05),有骨髓浸润患者血清LDH水平高于无骨髓浸润患者(P<0.05),治疗后淋巴瘤患者LDH水平较治疗前降低(P<0.05),但在不同组织免疫学类型淋巴瘤患者中LDH水平无明显差异(P>0.05)。分析原因可能与淋巴瘤细胞酵解酶系统活跃有关,特别是EBV影响酶代谢系统,使LDH酶活性升高,但其具体机制尚不十分明确;随着病情进展,淋巴瘤细胞大量增殖浸润,影响其他正常组织的代谢及造成组织细胞溶解破坏,广泛病变者LDH水平高于局限病变者,说明病情加重;当有效治疗后,大量淋巴瘤细胞被杀伤,酶活性减低,说明病情稳定。因此本研究提示淋巴瘤患者血清LDH水平与淋巴瘤负荷、分期、骨髓浸润及EBV感染有关,也是判断疗效及预后的一项重要指标,但不能反映淋巴瘤组织免疫学类型。有研究表明LDH水平提示恶性程度,恶性程度越高,血清LDH水平越高;LDH水平与肿瘤分期有关,分期越晚,血清LDH水平越高;LDH水平与结外转移相关,侵犯肝、脾及骨髓患者血清LDH水平升高;LDH水平与NHL肿瘤负荷有关[9]。
β2-MG主要由淋巴细胞产生,是细胞膜上完整组织相容性抗原的一部分,能够透过肾小球滤过膜,被近曲小管重吸收。近年研究报道显示,肿瘤细胞和淋巴细胞均可产生大量的β2-MG,且植物血凝素能够加速这一合成过程[10]。在本研究中,淋巴瘤组血清β2-MG水平高于对照组(P<0.05),临床分期Ⅲ~Ⅳ期患者血清β2-MG水平高于Ⅰ~Ⅱ期患者(P<0.05),有骨髓浸润患者血清β2-MG水平高于无骨髓浸润患者(P<0.05),治疗后淋巴瘤组β2-MG水平较治疗前降低(P<0.05),EBV+患者β2-MG水平高于EBV-患者(P<0.05),在不同组织免疫学类型淋巴瘤患者中β2-MG水平无明显变化(P>0.05)。分析原因为β2-MG是有核细胞膜可溶性成分,且淋巴瘤细胞本身可以合成及分泌大量β2-MG,但其具体机制尚不十分明确,可能与细胞周转增加有关;并与EBV感染相关;随着病情进展,淋巴瘤细胞大量增殖浸润,造成组织细胞溶解破坏,广泛病变者β2-MG水平高于局限病变者,说明病情加重;当有效治疗后,大量淋巴细胞被杀伤,β2-MG合成及分泌减少,说明病情稳定。因此本研究提示血清β2-MG水平与淋巴瘤负荷、分期、骨髓浸润及EBV感染有关,也是判断疗效及预后的一项重要指标,但不能反映淋巴瘤组织免疫学类型。有研究表明淋巴瘤、淋巴增殖性疾病等的β2-MG水平升高,提示病情恶化,治疗后β2-MG水平降低往往提示病情趋向稳定,其结外浸润的倾向更大,提示血清β2-MG水平测定不仅是恶性肿瘤诊断的重要指标之一,其动态监测还是疗效观察和判断预后的重要指标之一[3]。
细胞因子包括IL、干扰素、肿瘤坏死因子及各种造血相关细胞因子,由肿瘤细胞和周围的免疫细胞产生,在调节免疫的关键途径中起重要作用,在多种血液恶性肿瘤包括淋巴瘤中细胞因子的表达失调,并且使机体处于持续的炎症环境,影响肿瘤和基质细胞的存活和增殖。有研究表明一些细胞因子水平的升高可作为侵袭性淋巴瘤的标志物[11]。
IL-2R是一种免疫抑制物,研究表明与免疫功能紊乱有关的疾病如恶性肿瘤,IL-2R可在其细胞中持续存在或表达紊乱,可能在恶性肿瘤环境中扮演重要角色[12]。在本研究中,淋巴瘤组血清IL-2R水平高于对照组(P<0.05),EBV+患者血清IL-2R水平高于EBV-患者(P<0.05),临床分期Ⅲ~Ⅳ期患者血清IL-2R水平高于Ⅰ~Ⅱ期患者(P<0.05),有骨髓浸润患者血清IL-2R水平高于无骨髓浸润患者(P<0.05),治疗后淋巴瘤患者IL-2R水平较治疗前明显降低(P<0.05),在不同组织免疫学类型淋巴瘤患者中IL-2R水平无明显变化(P>0.05)。分析原因为IL-2R作为膜受体的一部分,在淋巴瘤细胞中持续存在或表达紊乱,特别是EBV感染的淋巴瘤细胞可使IL-2R水平升高,且延长IL-2R的半衰期,但其具体机制尚不十分明确,可能与人类嗜T淋巴细胞瘤1的PX基因产物相关;随着病情进展,淋巴瘤细胞大量增殖浸润,其膜受体IL-2R水平与淋巴瘤细胞呈正相关,说明病情恶化;当有效治疗后,大量淋巴细胞被杀伤,IL-2R水平降低,说明病情稳定。因此本研究提示血清IL-2R水平可以反映淋巴瘤负荷、分期、骨髓浸润,也是判断疗效及预后的一项重要指标。
IL-10通过抑制促炎细胞因子分泌而具有较强的免疫抑制作用,还可通过诱导B细胞的增殖和分化产生免疫刺激效应[13]。本研究表明,淋巴瘤组血清IL-10 水平高于对照组(P<0.05),治疗后淋巴瘤组IL-10水平较治疗前降低(P<0.05),但在不同组织免疫学类型、临床分期、有无骨髓浸润的淋巴瘤患者比较中,血清IL-10水平无明显差异(P>0.05)。分析原因可能为免疫功能紊乱的淋巴瘤患者,特别是EBV感染免疫功能低下的儿童或老年患者,可能对淋巴瘤细胞的免疫性清除功能减弱,肿瘤细胞使机体持续处于炎症环境,刺激机体免疫细胞分泌IL-10,使IL-10水平升高;当有效治疗后,大量淋巴瘤细胞被杀伤,机体炎症刺激减轻,免疫细胞分泌IL-10减少,说明病情稳定。因此本研究提示血清IL-10水平可以反映淋巴瘤负荷,是判断疗效及预后的一项重要指标。有研究表明IL-10水平升高在恶性肿瘤的发生、发展中起重要作用,可能是机体对肿瘤的一种免疫反应,由激活的免疫细胞产生,并非源于肿瘤细胞,其确切机制不明[14]。
一种肿瘤可含多种肿瘤标志物,通过选择特异性肿瘤标志物或最佳组合进行检测有利于恶性肿瘤的早期筛查,病情监测及对肿瘤治疗疗效、复发转移和预后的判断。本研究结果显示,在不同组织免疫学类型的淋巴瘤患者中,血清LDH、β2-MG、IL-2R及IL-10水平无明显差异,而LDH和β2-MG、IL-2R均反映了肿瘤的负荷、分期、骨髓浸润、EBV感染程度及疗效预后,IL-2R 及IL-10反映了免疫功能状况。因此,监测血清LDH、β2-MG、IL-2R水平的变化对淋巴瘤患者的辅助诊断、临床分期、疗效、预后及EBV感染评估具有重要的临床价值。
