两种国产化学发光系统检测HBsAg和HBeAg的效果分析*
2022-12-26谭延国王纪越张然星王晓宁聂秋燕李卓敏
谭延国,王纪越,张然星,田 野,刘 晴,王晓宁,古 媛,聂秋燕,李卓敏,于 洋
1.首都医科大学附属复兴医院检验科,北京 100038;2.首都医科大学医学检验系,北京 100038;3.中国中医科学院眼科医院,北京 100040
乙型肝炎病毒(HBV)血清标志物检测是入院或术前检查的常规内容,对于及时发现、及早治疗、阻断HBV感染以及防止其传播意义重大。我国曾广泛使用酶联免疫吸附测定、放射免疫法、板式化学发光法等检测上述项目,而微粒子或电化学发光等方法的效能则更具优势[1]。现进口化学发光系统仍为主流检测方法,如雅培、西门子、罗氏、贝克曼、希森美康等品牌[2]。近年来,随着国产化学发光检测系统的日臻成熟[3],其在成本控制、人机交互等方面都有着较进口化学发光系统更为明显的优势,虽然不乏对检测系统间性能比对的临床研究,但对本研究中评估的两个国产检测系统性能进行比对的文献仍少见,其定性与定量检测性能尚未被深入了解与认知。本研究以行业认可度较高的进口检测系统作参照,对国产检测系统乙型肝炎病毒表面抗原(HBsAg)和乙型肝炎病毒e抗原(HBeAg)定性、定量结果的一致性进行评估,进而为其临床应用提供参考。
1 材料与方法
1.1标本来源 实验使用的血清均来自复兴医院使用ARCHITECT®SYSTEM i2000SR系统常规检测患者HBsAg和(或)HBeAg结果为阳性(复测后仍为阳性)或阴性的静脉血标本[每例标本同时还检测了乙型肝炎病毒表面抗体(HBsAb)、乙型肝炎病毒核心抗体(HBcAb)和乙型肝炎病毒e抗体(HBeAb)等HBV血清标志物]。标本采集时间为2019年6月至2022年4月,均无黄疸、溶血和脂血。其中HBsAg标本共492例(阳性292例,阴性200例),男257例、女235例,年龄18~85岁;HBeAg标本464例(阳性250例,阴性214例),男243例、女221例,年龄19~83岁。均使用含惰性分离胶及促凝剂的真空采血管采集,4 000 r/min离心10 min,常规检测完毕后,分离剩余血清,储存于-80 ℃冰箱待用。本研究已在复兴医院伦理委员会备案。
1.2仪器与试剂 检测系统分别为美国雅培公司的ARCHITECT®SYSTEM i2000SR(以下简称S1)、迈克生物股份有限公司的Maccura i3000(以下简称S2)、迈瑞生物医疗电子股份有限公司的Mindray CL6000i全自动微粒子化学发光分析仪(以下简称S3)及配套试剂、定标品、质控品、辅助试剂及耗材。几个系统的检测原理均为基于双抗体夹心法的微粒子化学发光法。
1.3方法 所有设备均按要求进行维护、保养和校准;实验操作均按说明书进行,室内质控在控时方进行标本的检测。
标本从冰箱中取出,恢复至室温后均使用2个国产化学发光免疫分析系统S2和S3复测(每个标本同时用3种方法检测),进一步分析几个系统间定量和定性结果的符合性。对于3个系统有任意2个结果不符的标本及高于HBsAg检测上限(≥250 IU/mL)的标本,将再次使用S1检测1次(≥250 IU/mL的标本稀释后检测)。
定量数据偏倚的计算:(S2或S3-S1)/S1×100%。各检测系统HBsAg测定均为全定量方法;对HBeAg而言,S2为全定量检测(可溯源至国际标准物质),S1和S3均为定性检测。各系统具体特征如表1所示。

表1 各系统测定HBsAg和HBeAg的方法学特点
1.4统计学处理 使用IBM SPSS23.0对实验数据做统计学处理。非正态分布的定量数据以M(P25,P75)表示,数据之间比较采用配对秩和检验;采用Spearman相关分析S1与S2、S3检测结果间的相关性;定性数据比较采用配对χ2检验;一致性分析采用Kappa一致性检验。对于S1检测HBsAg<1.00 IU/mL结果的标本,采用受试者工作特征(ROC)曲线分别分析S1与S2、S3检测结果的最佳临界值。以P<0.05为差异有统计学意义。
2 结 果
2.1HBsAg的检测结果分析
2.1.1HBsAg定性结果的总体符合性分析 S2、S3对HBsAg的定性结果与S1的定性总符合率均为97.76%、阳性符合率均为96.58%、阴性符合率均为99.50%,定性结果一致检验均为Kappa值=0.954(P<0.001); S2、S3分别与S1相比,对HBsAg的定性结果差异均有统计学意义(均P=0.012)。见表2、3。

表2 S1、S2检测HBsAg定性结果的符合性分析(n)
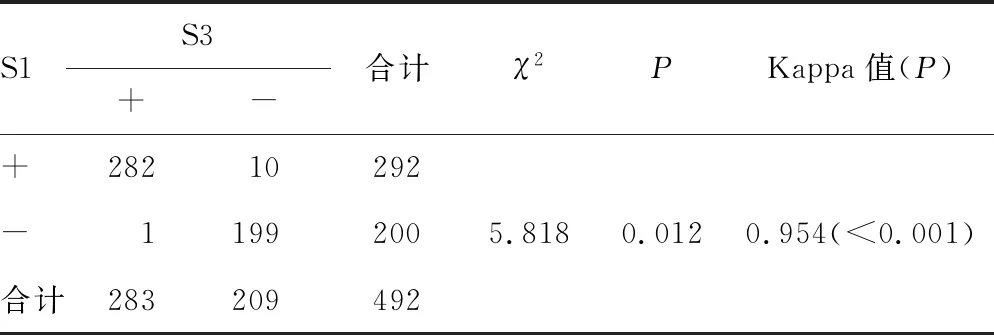
表3 S1、S3检测HBsAg定性结果的符合性分析(n)
2.1.2不同HBsAg定量区间各系统HBsAg定性结果的符合性分析 根据S1检测HBsAg的定量结果,划分了若干HBsAg定量水平区间,以进一步分析S2和S3检测HBsAg的定性结果与S1结果的符合情况。如表4所示,当S1检测的HBsAg≥1.00 IU/mL时,S2和S3检测HBsAg的结果与S1检测结果的定性符合率均为100.00%;而当S1检测的HBsAg处于0.50~<1.00、0.05~<0.50 IU/mL时,S2和S3检测HBsAg的结果与S1检测结果的定性符合率则均分别为91.67%和70.97%。
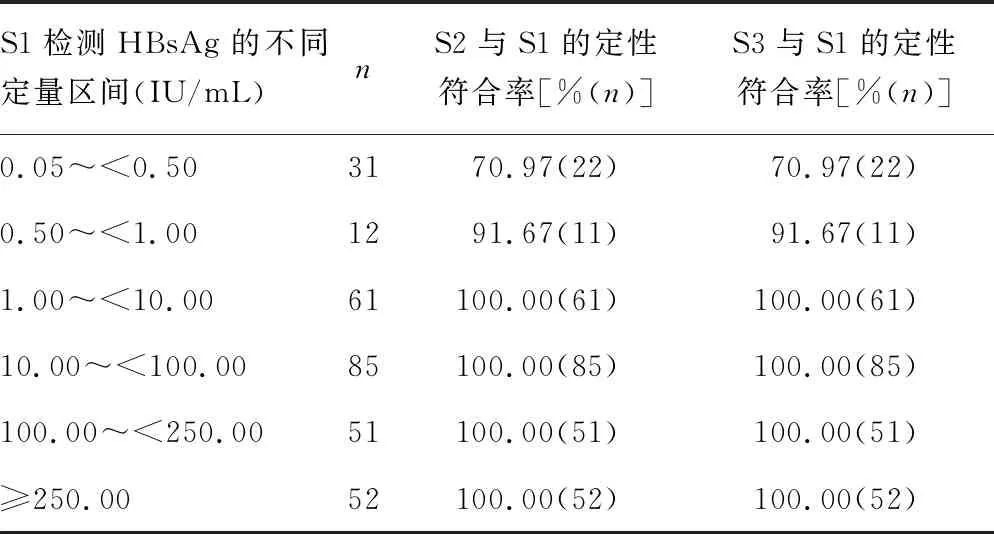
表4 不同HBsAg定量区间各系统HBsAg定性结果的符合性分析
S1检测HBsAg<1.00 IU/mL的所有标本,结合S2和S3结果绘制ROC曲线。结果显示,当S1检测的HBsAg <0.21 IU/mL时,S2检测HBsAg结果为阴性的比例为63.63%[曲线下面积(AUC)=0.829,P=0.002];当S1检测的HBsAg<0.18 IU/mL时,S3检测HBsAg结果为阴性的比例为70.00%(AUC=0.820,P=0.002)。
2.1.3不同检测系统间HBsAg定量水平的符合性分析 如表5所示,在S1检测HBsAg的不同定量水平区间内,分析了S1检测的HBsAg定量结果与S2和S3检测结果的相关性,计算了S1检测结果与S2和S3检测结果的相对偏差。结果表明,除HBsAg定量水平在0.50~<1.00 IU/mL,S3检测的HBsAg定量结果与S1之间无相关性(P>0.05),以及HBsAg水平在100.00~<250.00 IU/mL,S2检测的HBsAg定量结果与S1之间无相关性(P>0.05)外,在其他的HBsAg定量区间,S2、S3检测的HBsAg结果与S1的结果均相关(P<0.05)。配对秩和检验显示,在所有的HBsAg定量区间,S2检测的HBsAg定量水平均明显低于S1(P<0.05);而对于S3而言,除在0.50~<1.00 IU/mL和100.00~<250.00 IU/mL HBsAg定量区间,S3检测的HBsAg定量水平与S1差异无统计学意义(P=0.071、0.873)外,在其余的HBsAg定量区间,S3检测的HBsAg定量水平均明显低于S1(P<0.05)。S2检测HBsAg的定量水平与S1检测结果的相对偏倚为-59.03%~-45.82%,S3检测HBsAg的定量水平与S1检测结果的相对偏倚为-71.05%~-33.75%。
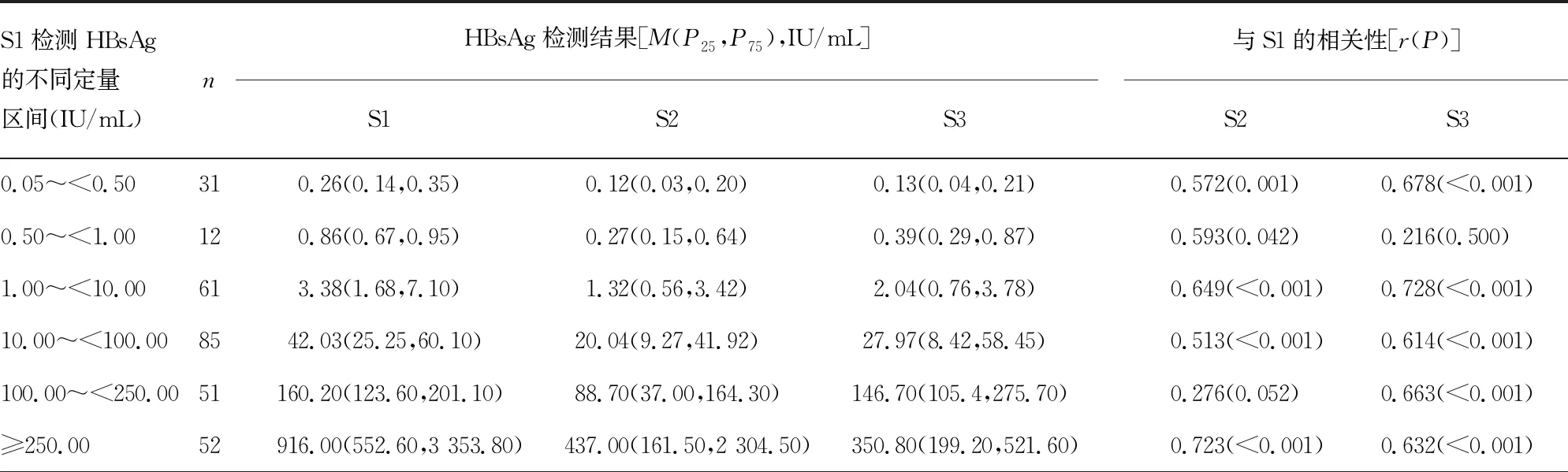
表5 根据S1的HBsAg定量结果划分区间后,各系统定量结果的统计学描述、相关性和差异性比较

S1检测HBsAg的不同定量区间(IU/mL)n与S1的平均偏倚(%)S2S3与S1的配对秩和检验[Z(P)]S2S30.05~<0.5031-59.03-52.60-3.842(<0.001)-4.529(<0.001)0.50~<1.0012-55.92-50.00-3.059(0.002) -1.804(0.071)1.00~<10.0061-58.15-47.53-5.473(<0.001)-5.240(<0.001)10.00~<100.0085-49.31-46.02-5.054(<0.001)-2.522(0.012)100.00~<250.0051-45.82-33.75-4.274(<0.001)-0.159(0.873)≥250.0052-47.59-71.05-3.634(<0.001)-6.275(<0.001)
2.1.4对任意2个系统HBsAg定性结果不符合标本的进一步分析 如表6所示,任意2个检测系统间HBsAg定性结果不符合的共15例。这些标本除55号和128号标本外,其余13例标本均为使用S1(只作为参照系统,而非金标准方法)检测HBsAg为阳性的标本,这13例标本其他HBV标志物的常规检测结果显示均为“小三阳”(HBsAg+、HBcAb+、HBeAb+);而仅S2或S3检测HBsAg阳性的2例标本(55号和128号),则仅为HBsAg呈单独阳性。
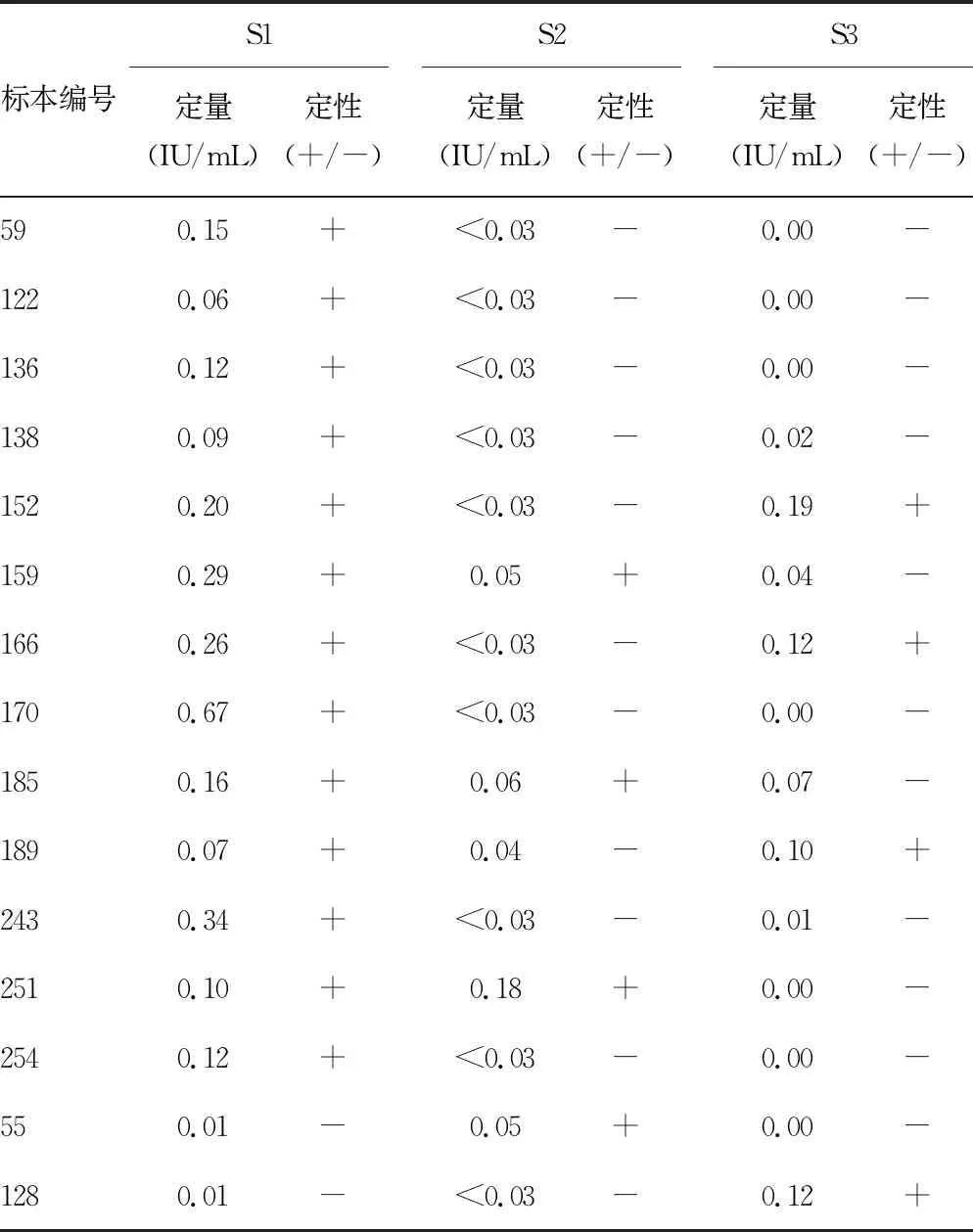
表6 任意2个检测系统间HBsAg定性结果(+/-)不符合标本列表
2.2各系统检测HBeAg的定性结果分析 S3检测HBeAg的定性结果与S1检测结果的总体符合率、阳性符合率、阴性符合率分别为96.77%、99.20%、93.93%,一致性检验Kappa值=0.936(P<0.001);S2检测HBeAg的定性结果与S1检测结果的总体符合率、阳性符合率、阴性符合率分别为97.84%、98.40%、97.20%,一致性检验Kappa值=0.957(P<0.001)。S3检测HBeAg的定性结果与S1差异有统计学意义(P=0.007);S2检测HBeAg的定性结果与S1差异无统计学意义(P=0.754)。见表7、8。

表7 S1、S2检测HBeAg定性结果的符合性分析(n)
如表9所示,任意2个检测系统间HBeAg定性结果不符合的共19例,这些标本在留取标本冻存前、使用S1检测5项HBV血清标志物时,除了86号外(S1、S2检测5项HBV血清标志物结果均为阴性,仅S3检测的HBeAg为单独阳性),其余标本检测结果均为“大三阳”(HBsAg+、HBeAg+、HBcAb+),只是有些临界值附近标本在冻存一段时间后,再次测定时,部分标本S1、S2检测HBeAg的阳性率明显下降,但S3可能受标本保存时间的影响较小,多数标本仍为阳性,具体原因仍待探讨。

表8 S1、S3检测HBeAg定性结果的符合性分析(n)
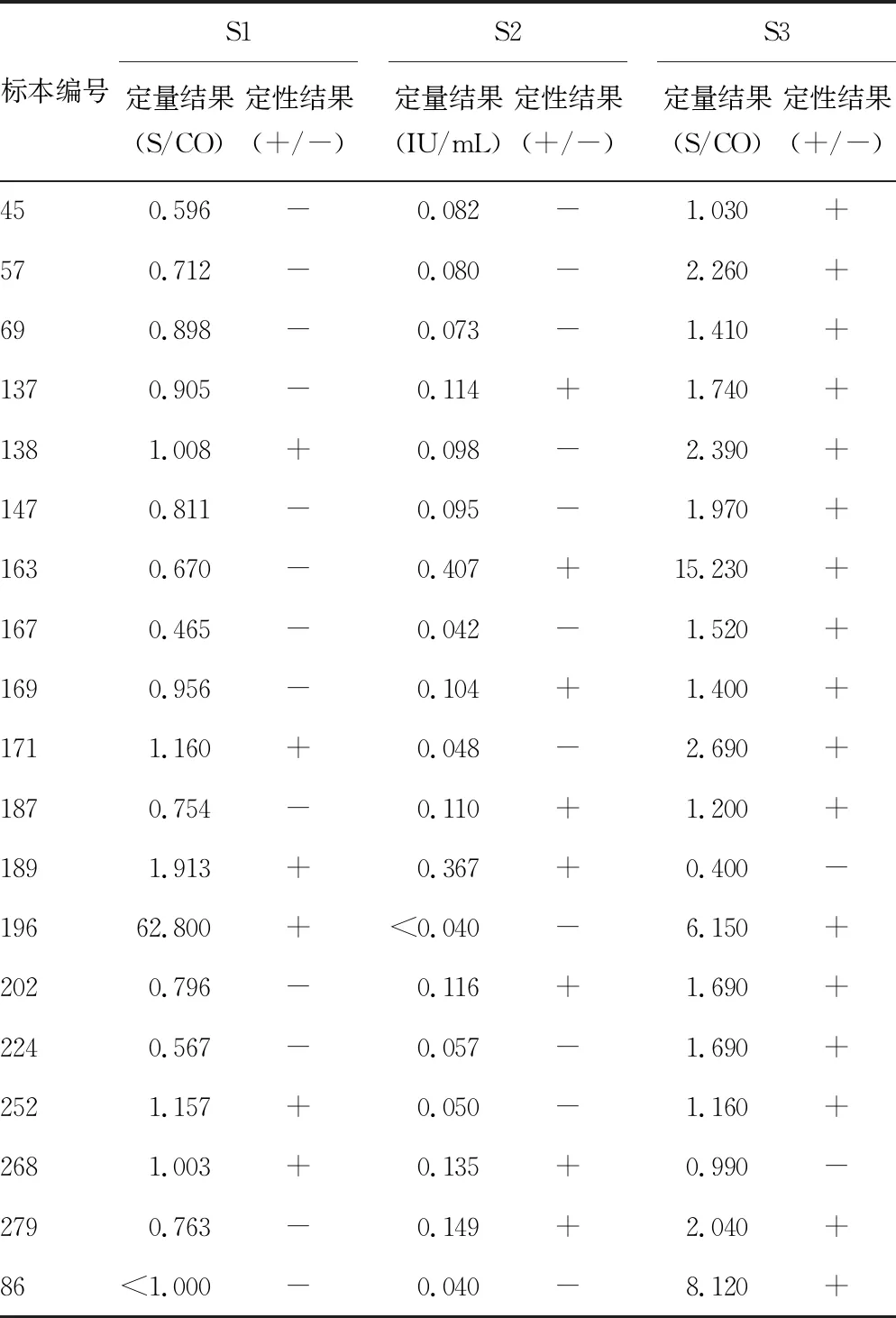
表9 任意2个检测系统间HBeAg定性(+/-)结果不符合者列表
3 讨 论
HBsAg是HBV感染后第一个出现的标志物,一旦确定HBsAg阳性,即可明确为HBV感染[4-6]。HBeAg阳性是HBV复制以及传染性强的标志物,高水平HBeAg与HBV DNA关系更为密切[7-8]。故对二者的准确检测十分必要。
目前,虽然关于方法学比对的研究较多,但对本研究探讨的检测系统而言,尚未见使用S2评估HBsAg和(或)HBeAg的相关文献,也仅见1篇文献评估了使用S3检测HBsAg的研究[9],但鲜见从定性、定量、定性结果符合情况以及对不符合标本进行深入分析的相关文献。
本研究显示,2个国产化学发光免疫分析系统检测HBsAg和HBeAg,与进口化学发光免疫分析系统均具有非常高的阳性、阴性符合率,显示国产化学发光检测系统测定HBV血清标志物已有了长足进步[9],其性能已可满足大规模应用于常规检测的需要。
就定性结果而言,对于S1检测结果HBsAg≥1.00 IU/mL的标本,S2和S3均可100%检出;对于15例任意2个系统检测不符的标本,其HBsAg定量值均<1.00 IU/mL,由于其中有13例HBV血清标志物检测皆为“小三阳”,故其HBsAg真阳性的可能性大。而国产化学发光免疫分析系统各检测出3例阳性。ROC曲线显示,当S1检测HBsAg的定量结果<0.21 IU/mL时,S2检测HBsAg阴性的概率为63.63%,而当S1检测HBsAg的定量结果<0.18 IU/mL时,S3检测HBsAg阴性的概率为70.00%。故国产化学发光免疫分析检测系统在低水平HBsAg的检出能力上可能尚待提高。而在临床实际工作中,HBsAg<1.00 IU/mL的HBV感染者占比很少。本研究也发现了2例S1检测HBsAg结果为阴性,而S2或S3检测HBsAg阳性且均为低值的标本(分别为0.05 IU/mL和0.12 IU/mL),且3个系统检测HBsAb、HBeAg、HBcAb、HBeAb结果均为阴性,故有理由认为此2例标本S2和S3 HBsAg假阳性的可能大。本研究未做HBsAg的确认试验和HBV-DNA的检测(即金标准方法),因为确认试验的灵敏度普遍偏低,且即使HBV-DNA阴性也不能排除HBsAg阳性的可能。由于本研究这方面设计的不足,也提示对于进口试剂阳性、两种国产试剂阴性的标本,也存在真阴性的可能。
除了检测下限,检测出HBsAg变异株的能力也是检测系统的重要性能指标之一,如HBsAg、HBsAb双阳性的标本[10-13],此类标本在本研究中也有2例(0.68%)。这方面的性能,尚需长期的临床实践验证。
对于HBV引起的乙型肝炎患者,HBsAg定量虽然与病毒载量的关系不如HBeAg密切,但同样可反映病毒水平[14-15],故准确定量检测HBsAg也非常重要。本研究显示,两个国产化学发光免疫分析系统S2、S3检测HBsAg的定量水平与进口化学发光免疫分析系统S1存在中等程度的相关性,但相关程度随其定量水平的区间变动,且相对于进口系统的负偏倚较大,在各个HBsAg定量水平区间,S2、S3检测结果与S1的偏倚基本都在-50%左右。这提示,如要根据HBsAg定量水平预测HBV拷贝数,最好使用同一检测系统进行监测,如果数据来自不同检测系统,则判断结果时应非常慎重。对于HBsAg为何定量试验存在如此大偏差的原因,仍不明确。本研究虽然使用了冻存标本,但由于保存条件为-80 ℃,标本质量还是有保障的;且对于这些任意2个系统检测HBsAg定性结果不符的标本也使用S1进行了复测,显示至少对这些弱阳性标本而言,新鲜标本与复测标本前后定量水平差异是非常小的,冻存后复测仍为阳性;对于HBsAg≥250.00 IU/mL标本,也用S1稀释后进行了复测,且S2、S3定量水平与S1间的偏倚仍与HBsAg其他定量区间的偏倚基本吻合。
对于HBeAg,S2的检出率与S1更为接近,可能同样受标本保存时间的影响。这提示对于HBeAg而言,即便是-80 ℃冰箱冻存,其临界值附近的结果也可能会受到影响。但实际工作中,HBV血清标志物检测为常规检测项目,基本当日即完成检测,可忽略这种储存因素的影响。
