阿片受体激动剂对肠缺血再灌注损伤大鼠NADPH氧化酶活性及eNOS-NO通路的作用机制
2022-12-25汪婷婷孔繁丽
汪婷婷,梁 翀,孔繁丽,王 燕
(华中科技大学同济医学院附属武汉儿童医院,湖北 武汉 430030)
肠缺血再灌注损伤是由休克、感染、创伤、烧伤、肠梗阻等导致的缺血性灌注损伤,是临床常见疾病,该病若不及时治疗,可造成全身炎症反应,甚至多器官损伤,严重威胁着患者的生命安全,故针对该病的治疗一直是临床工作者们密切关注的热点问题[1]。肠缺血再灌注损伤致病机制复杂,目前尚未完全阐明,但有研究表明,其与炎症反应和氧化应激异常密切相关,其中炎性介质以及活性氧簇过量产生是该病的关键环节[2]。NADPH氧化酶是活性氧簇产生的主要来源,其催化电子可从NADPH转移到分子氧,进而通过催化亚基产生活性氧簇,最终参与肠缺血再灌注损伤的发生、发展,因此如何调控NADPH氧化酶活性是近年来医学领域关注的焦点之一[3]。近年来研究发现,内皮型一氧化氮合酶/一氧化氮(Endothelial nitric oxide synthase-Nitric oxide,eNOS-NO)信号通路在缺血再灌注损伤中发挥重要作用,肠缺血再灌注损伤也不例外,该信号通路可有效改善血液循环,抑制炎症反应,减轻氧化应激,并对各器官具有一定保护作用[4]。目前临床上治疗肠缺血再灌注损伤的方法并不多,且均具有一定缺点,但近年来研究发现阿片受体在肠缺血再灌注损伤器官保护方面扮演着重要角色,激动阿片受体可以模拟缺血预适应,从而显著改善肠损伤,由此阿片受体激动剂应运而生,且安全性相对较高[5-8]。但其作用机制尚未明确,因此本文就阿片受体激动剂对肠缺血再灌注损伤大鼠NADPH氧化酶活性及eNOS-NO通路的作用机制进行研究探讨,为肠缺血再灌注损伤的治疗、改善及预后提供新靶点。
1 材料与方法
1.1 动物材料 本实验选取常州卡文斯实验动物有限公司提供的50只SPF级SD雄性大鼠(合格证书为:SCXK(苏)2019-0008),平均体重240~280 g,大鼠单笼喂养,室温生长,模仿12 h昼夜交替,在常温下进行无菌自由进食、饮水2周,按照《实验动物管理条例》规定进行实验。
1.2 实验材料 阿片受体激动剂DADLE(货号:L16970,BYGL-GC17677,南京北鱼有限公司);白介素-1受体拮抗剂(货号:C033,苏州近岸蛋白质股份有限公司);苏木素染液(货号:H9627,美国Sigma公司);伊红染液(货号:AG1100-100mL,上海吉至有限公司);光学显微镜(型号:CX-60,日本OLYMPUS公司);酶联免疫吸附测定(ELISA)试剂盒(货号:446502,美 国 R&D公司);全波长酶标仪(型号:Multiskan Sky,上海辅泽有限公司);NADPH-细胞色素C还原酶活性检测试剂盒(货号:PH0278,北京普非有限公司);eNOS试剂盒(货号:YS02062B,上海雅吉有限公司);NO试剂盒(货号:SZ-HAS-373,深圳海思安有限公司)。
1.3 建模 选取40只SPF级SD雄性大鼠,禁食12 h后,腹腔注射40 mg/kg 2.5%戊巴比妥钠麻醉大鼠,然后进行常规消毒、备皮处理,完成后暴露肠管,分离肠系膜上动脉,夹闭其根部造成缺血,观察到肠系膜血管前端搏动消失,肠壁由粉红变苍白时开始计时,同时将肠管回纳并缝合切口,1 h后原切口再次开腹,取出动脉夹,当血管搏动正常,肠壁出现明显充血时,说明灌注成功,再次将肠管回纳并缝合切口,消毒后将大鼠放回笼中,建模过程中大鼠死亡5只,其余全部建模成功。
1.4 分组及给药 从建模成功的大鼠中随机选取30只,将其分为模型(M)组,白介素-1受体拮抗剂(I)组,DADLE(D)组,每组10只,同时选取剩余正常大鼠10只作为正常(N)组,对I组尾静脉注射30 mg/kg的白介素-1受体拮抗剂,对D组尾静脉注射3 mg/kg的DADLE,两组均1 d 1次,治疗14 d,N组、M组同期静脉注射同体积生理盐水。
1.5 标本采集 实验完成后,大鼠腹腔注射40 mg/kg戊巴比妥钠麻醉处死,取肠组织,用4%的多聚甲醛溶液固定96 h后,用生理盐水漂洗干净,放入冰箱中密封保存,同时腹主动脉取血,在4 000 r/min条件下离心10 min,取上清液,放入冰箱中密封保存。
1.6 HE染色法检测肠组织病理形态 取各组大鼠肠组织,进行常规石蜡包埋、切片、二甲苯脱蜡、梯度乙醇水化后,用苏木素染色20 min,自来水冲洗后,1%的盐酸乙醇溶液浸泡30 s,伊红染液染色3 min,自来水冲洗,梯度乙醇脱水、二甲苯透明后,用中性树胶完成封片,用光学显微镜进行组织病理学观察,并用Matic Images Advanced 3.2图像分析系统采集图片。
1.7 Chiu’s评分评价肠组织损伤程度 肠组织病理评分:正常绒毛、黏膜和腺体为0分;绒毛顶出现变化,形成上皮下Gruenhagen间隙为1分;形成上皮下Gruenhagen间隙,且腺体轻微损伤为2分;上下皮间隙增大并伴有毛细血管充血为3分;上皮逐渐脱离固有层,且腺体受损为4分;部分顶部绒毛脱落为5分;绒毛脱落,且毛细血管出现扩张为6分;固有层绒毛脱落并,且腺体严重受损为7分;一固有层消化、崩解为8分;可见出血,溃疡为9分。
1.8 ELISA 法测定D-乳酸、内毒素含量 取各组大鼠血清,将标准品及待测样品加入微孔酶标板内,然后严格按照 ELISA 试剂盒测定D-乳酸、内毒素含量,实验完成后,立即用酶标仪测定每孔吸光度,按照吸光度绘制标准曲线,并计算D-乳酸、内毒素含量。
1.9 细胞色素C还原法检测NADPH氧化酶活性 取各组大鼠肠组织,提取总蛋白,将浓度调整为1 mg /mL,取100 μL,加入 500 μmol /L细胞色素C和100 μmol /L NADPH,温室孵育30 min,加入 200 U /mL过氧化物歧化酶,室温孵育 30 min,用酶标仪在550 nm 波长处检测每孔吸光度,通过不同吸光值进行比较计算 NADPH氧化酶含量。
1.10 eNOS-NO通路相关指标检测 取各组大鼠血清,比色法检测eNOS含量,硝酸还原酶法检测NO含量,严格按照试剂盒说明进行检测,实验完成后立即用酶标仪在450 nm 波长处,测定每孔吸光度 A,绘制标准曲线,然后通过标准曲线,计算eNOS、NO的含量。
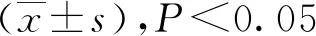
2 结果
2.1 各组大鼠肠组织HE染色结果 N组大鼠肠组织结构正常,腺体完整清晰,未见绒毛尖端上皮脱落及炎性细胞浸润,M组肠组织结构遭到破坏,黏膜上皮损伤脱落现象严重,可见明显腺体受损及大量裸露的绒毛,出现大量出血灶和溃疡,且有大量炎性细胞浸润,与M组相比,I组、D组病理状态明显,黏膜损伤明显减轻,炎性细胞明显减少(见图1)。

A:N组;B:M组;C:I组;D:D组。
2.2 各组大鼠Chiu’s评分结果 N组、M组、I组、D组大鼠Chiu’s评分分别为(0、5.01±1.22、3.38±1.09、1.98±0.54)分,与N组相比,M组Chiu’s评分显著升高(P<0.05),与M组比较,I组、D组Chiu’s评分显著降低(P<0.05),且D组比I组降低显著(P<0.05,见图2)。

*:与N组比较,P<0.05;#:与M组比较,P<0.05;a:与I组比较,P<0.05。
2.3 各组大鼠血清D-乳酸、内毒素含量结果 与N组相比,M组血清D-乳酸、内毒素含量显著升高(P<0.05),与M组比较,I组、D组血清D-乳酸、内毒素含量显著降低(P<0.05),且D组比I组降低显著(P<0.05,见表1)。
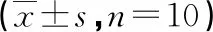
表1 各组大鼠血清D-乳酸、内毒素含量
2.4 各组大鼠肠组织NADPH氧化酶活性结果 N组、M组、I组、D组大鼠NADPH氧化酶活性分别为(10.56±1.54、21.57±3.44、16.77±2.11、11.04±1.99 )nmol /mg protein,与N组比较,M组肠组织中NADPH氧化酶活性显著升高(P<0.05),与M组比较,I组、D组肠组织中NADPH氧化酶活性显著降低(P<0.05),且D组比I组降低显著(P<0.05,见图3)。
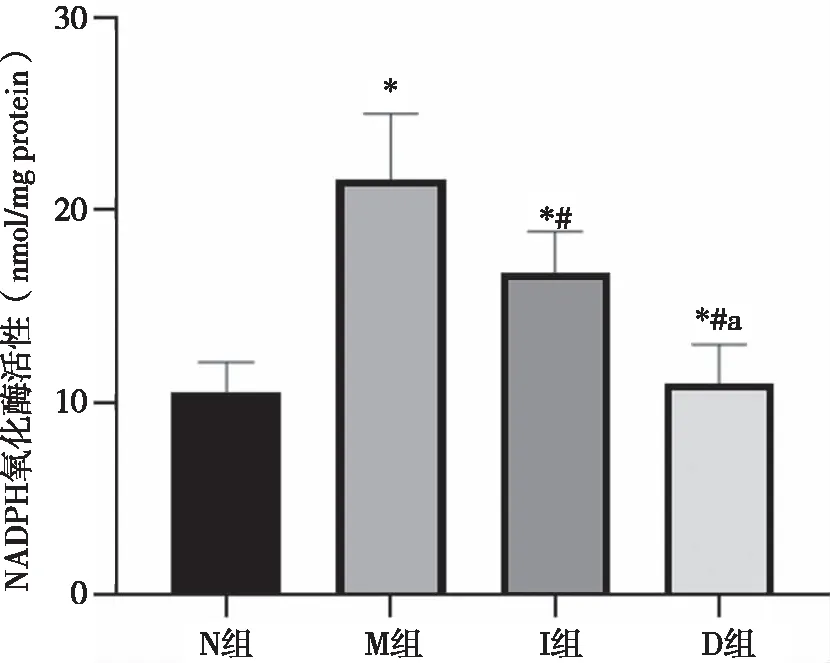
*:与N组比较,P<0.05;#:与M组比较,P<0.05;a:与I组比较,P<0.05。
2.5 各组大鼠血清eNOS-NO通路相关指标结果 与N组比较,M组血清eNOS、NO含量显著降低(P<0.05),与M组比较,I组、D组血清eNOS、NO含量显著升高(P<0.05),且D组比I组升高显著(P<0.05,见表2)。

表2 各组大鼠血清eNOS、NO含量
3 讨论
本文研究发现,DADLE可显著改善大鼠病理状态,并降低Chiu’s评分及血清D-乳酸、内毒素含量,这说明其具有显著疗效,可有效改善缺血再灌注损伤,并对器官具有保护作用。白介素-1受体拮抗剂是临床治疗缺血再灌注损伤的常用药物,是一种天然的抗炎因子,在抑制免疫炎症反应方面发挥着不可或缺的作用,此外研究表明其还具有清除自由基,改善机体氧化应激的作用,故本文选其作为对照组[9]。近年来研究发现,激动δ阿片受体可有效减轻肠缺血再灌注损伤,而DADLE一种高选择特异性δ阿片受体激动剂,研究表明其具有与冬眠诱导触发物相似的器官保护作用,可有效改善缺氧、缺血造成的中枢神经系统病变,此外对机体其他器官也具有保护作用,故选其作为本文的受试药物[10]。肠道是营养吸收的主要器官,富含大量毛细血管,十分脆弱和敏感,对血流、氧气的供应要求十分严格,因此当缺血再灌注出现时肠组织更易受到进一步损伤,加重病理生理现象[11]。此外,缺血再灌注损伤可破坏肠粘膜屏障功能,从而导致炎性介质大量释放,并致使细菌移位,进而引起全身性的免疫应答和多器官功能障碍,危及患者生命,因此如何改善肠屏障功能损伤一直是临床关注的焦点之一[12]。而D-乳酸是细菌发酵的代谢产物,内毒素是炎症反应的主要触发因素,检测血清中D-乳酸、内毒素含量可有效反映肠黏膜通透性变化以及损害程度,可为临床治疗提高有利依据[13]。而对于肠缺血再灌注损伤大鼠,DADLE可能是通过促进δ阿片受体的分泌,来促进其与配体结合并重构缺血区域微循环,从而调节缺血区域血流量、改善血液循环、抑制网状内皮系统发生系统反应、改善肠细胞代谢等,进而抑制炎症介质、内毒素、D-乳酸的合成及分泌、改善肠道屏障功能,最终有效改善大鼠肠组织病理损伤。Wang等[14]研究表明,DADLE对肠缺血再灌注损伤大鼠具有显著疗效,可显著改善大鼠病理状态,并提高大鼠肠道细胞存活率,这与本文结果类似。
本文研究表明,与M组比较,I组、D组肠组织中NADPH氧化酶活性显著降低,且D组比I组降低显著,这说明DADLE可显著抑制NADPH氧化酶活性。大量研究证实,肠缺血再灌注损伤是造成重伤伤员康复率和生存率低的关键因素之一,因此探寻其发生、发展机制对患者的治疗将具有积极而深远的意义[15]。近年来研究发现,氧化应激损伤在该病的发生、发展中扮演着重要角色,许多治疗策略都是通过减轻氧化应激来减轻肠缺血再灌注损伤,而NADPH氧化酶在氧化反应中发挥着至关重要的作用,其可促进活性氧大量分泌,从而激活氧化应激,进而导致氧化应激损伤的发生发展[16]。而对于肠缺血再灌注损伤大鼠,DADLE可能是通过调控上游相关信号,来抑制NADPH氧化酶活性,从而抑制活性氧的产生,达到有效清除氧自由基、抑制细胞因子和趋化因子、抑制促炎因子等的目的,进而有效抑制氧化应激、抑制炎症反应,最终有效改善病理状况。王靖等[17]研究发现,肠缺血再灌注大鼠NADPH氧化酶活性显著升高,给予治疗后NADPH氧化酶活性显著降低,病理状态显著改善,这与本文结果类似。
本文研究发现,与M组比较,I组、D组血清eNOS、NO含量显著升高,且D组比I组升高显著,这说明DADLE可有效激活eNOS-NO通路。众所周知,NO机体内重要的“第二信使”,参与了机体内的多种病理及生理过程,如舒张血管、抑制血小板聚集、减轻炎症反应和氧化应激、保护受损器官等,而eNOS-NO通路是调控内源性NO合成的经典途径之一,激活eNOS-NO通路可促使NO发挥其生物学作用[18]。近年来研究发现,肠缺血再灌注损伤存在时,eNOS 活性降低,内源性NO合成减少,而NO合成恢复或给予外源性NO可对缺血再灌注损伤具有保护作用,因此激活eNOS-NO通路是治疗肠缺血再灌注损伤的一个可能靶点[19]。而对于肠缺血再灌注损伤大鼠,DADLE可能是通过改善血液循环,来促进eNOS的转录及合成,从而催化NO的生成,抑制炎症介质的分泌、抑制氧化应激反应的发生,进而发挥器官保护的作用,有效减轻肠组织损伤,最终有效改善大鼠症状。孙孟彪等[20]研究发现,灯盏花可显著降低肠缺血再灌注大鼠肠道黏膜屏障损伤,其机制可能与激活eNOS-NO通路有关,这与本文结果类似。
综上所述,阿片受体激动剂具有显著疗效,可显著降低肠缺血再灌注损伤大鼠NADPH氧化酶活性,并激活eNOS-NO通路。
