脑胶质瘤MRI平扫及强化特征分析
2022-12-23黄景新
曲 龙,黄景新
(广州市第一人民医院南沙医院 放射科,广东 511457)
脑胶质瘤属于颅内原发性肿瘤,在临床中较为常见,具有易反复发作、边界模糊等特征。由于大部分脑胶质瘤是多发,极易累及周边组织、器官等,引起脑组织缺氧、水肿等[1-2]。目前,临床对于脑胶质瘤主要采取手术、放化疗等方式治疗,不同级别的患者预后不同,高级别脑胶质瘤病灶生长速度较快,浸润性和侵袭性较强,预后普遍较差[3]。脑胶质瘤属于生长相对缓慢的肿瘤疾病,患者均会伴随不同程度的颅内压增高,因胶质瘤的生物学行为不同,相对于其他缓慢生长的良性肿瘤,该肿瘤可切除治疗,但是临床预后一般。有研究表明,在治疗前及早对脑胶质瘤患者分级作出准确诊断,可指导临床更有针对性地展开治疗工作,对于降低死亡率具有一定的积极意义[4]。MRI(核磁共振)具有较高的分辨率,可以多序列、多参数、多方位成像,获得清晰的神经血管图像,明确脑胶质瘤的病灶位置、边界、水肿程度等[5]。基于此,为探究脑胶质瘤诊断中MRI平扫及强化特征,本文对本院2018年9月至2021年6月收治的68例脑胶质瘤患者展开研究,报道如下。
1 资料与方法
1.1 一般资料
本次研究对象来源于本院2018年9月至2021年6月收治的68例脑胶质瘤患者 (医院伦理委员会已审批),男性30例、女性38例;年龄在27-72岁,平均(49.62±5.14)岁;病程在 4-20 个月,平均(12.62±2.84)个月;病灶直径在1.2-2.3cm,平均(1.82±0.64)cm;BMI(体质量指数)23-32kg/m2,平均(27.62±1.54)kg/m2。 纳入标准:①均经病理活检穿刺诊断为“脑胶质瘤”。②年龄>18周岁,男、女不限。③未接受过手术、放化疗等对症治疗。④沟通、视听能力均正常。⑤家属均已在知情同意书上签字。排除标准:①置入心脏起搏器、支架者。②哺乳期、妊娠期女性。③对本研究所用造影剂过敏者。④肾、肝功能衰竭者。⑤合并脑梗死等其他脑部疾病者。⑥存在既往脑部创伤史者。⑦合并心血管疾病者。⑧同期参与其他研究者。⑨合并狂躁症、焦虑症等疾病者。
1.2 方法
MRI检查方法:采用3.0T超导MRI检查仪(型号:西门子 VERIO 3.0T、西门子SKYRA 3.0T)检查。协助患者采取仰卧位,放置头部线圈 (型号:NV-16),从头顶部扫描直至颅顶部,横断位FSE-T1WI、FSE-T2WI、FSE-T2WI Flair轴位扫描、矢状位FSE-T2WI扫描,FSE-T2WI Flair,T1+增强, 弥散,MRA,MRS。 T1W:TE 是 8ms,TR 是 500ms,层间隔1mm,层厚 5mm,矩阵是 256×256,T2W、T2FLAIR:TE 是 95ms,TR 是 4500ms, 层厚 5.5mm;T1+C:TE是 2.59ms,TR 是 1700ms,层厚 1mm;DWI(扩散加权成像)扫描以多次激发SE-EPI为主,TE是93ms,TR是 6000ms,b值 (扩散敏感因子) 是 0、1000mm2。将所获得的图像传输至后台工作站,自动分析原始数据。
所有患者图像均由一名主治医生、一名高年资住院医师以双盲法阅片并作出诊断,对于存在异议的地方,再次讨论或者邀请主任医师参与讨论,确定最终诊断结果。
1.3 观察指标
对比低级别组、高级别组病灶周边水肿程度、ADC值 (表观弥散系数)、NAA/Cr(氢质子波谱)、Cho/Cr(胆碱/肌酸)、Cho/NAA(胆碱/N-乙酰天门冬氨酸),以上测量数据最终记录值是连续测量3次的平均值。
1.4 统计学方法
以SPSS26.0软件检验,正态分布计量资料(ADC 值、NAA/Cr、Cho/Cr、Cho/NAA)同组组内数据计算以配对样本t检验为主,不同组间数据计算以独立样本t检验为主,通过“±s”表示,计数资料(水肿程度)采用卡方检验及秩和检验,单元格期望频数<5,连续校正检验,以“[n/(%)]”表示,P<0.05 表示存在统计学差异。
2 结果
2.1 脑胶质瘤分级
68例患者经MRI检查:12例I级,占17.65%(12/68);18 例 II级,占 26.47%(18/68);21 例 III级,占 30.88%(21/68);17 例 IV 级,占 25.00%(17/68)。
2.2 低级别组、高级别组病灶周边水肿程度对比
低级别组无水肿率 (53.33%)、轻度水肿率(40.00%)高于高级别组(2.63%、34.21%),低级别组中度水肿率(6.67%)、重度水肿率(0)均低于高级别组(31.58%、31.58%),P<0.05,见表 1。

表1 低级别组、高级别组病灶周边水肿程度对比[n/(%)]
2.3 低级别组、高级别组ADC值对比
低级别组ADC值高于高级别组,P<0.05,见表2。
表2 低级别组、高级别组ADC值对比(±s)

表2 低级别组、高级别组ADC值对比(±s)
组别 ADC 值(×10-3mm2/s)低级别组(n=30) 1521.92±328.62高级别组(n=38) 1026.62±131.11 t 8.487 P 0.000
2.4 低级别组、高级别组NAA/Cr、Cho/Cr、Cho/NAA对比
低级别组Cho/Cr、Cho/NAA均低于高级别组,低级别组NAA/Cr高于高级别组,P<0.05,见表3。
表3 低级别组、高级别组NAA/Cr、Cho/Cr、Cho/NAA对比(±s)
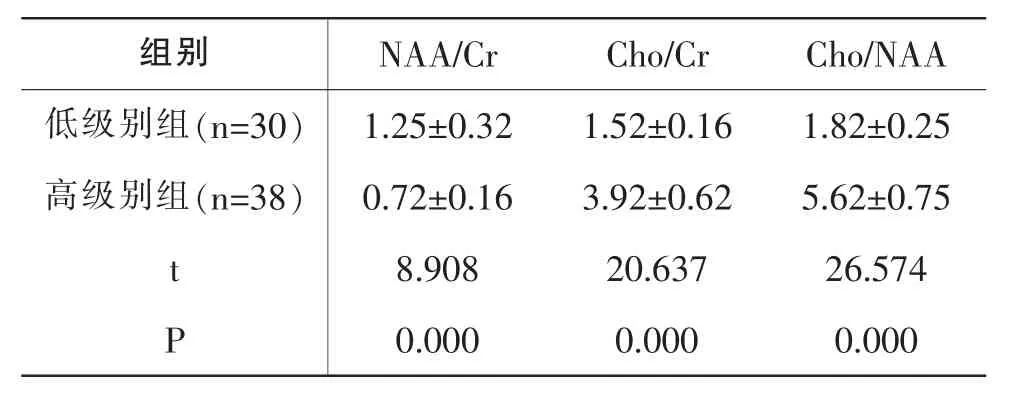
表3 低级别组、高级别组NAA/Cr、Cho/Cr、Cho/NAA对比(±s)
组别 N A A/C r C h o/C r C h o/N A A低级别组(n=3 0) 1.2 5±0.3 2 1.5 2±0.1 6 1.8 2±0.2 5高级别组(n=3 8) 0.7 2±0.1 6 3.9 2±0.6 2 5.6 2±0.7 5 t 8.9 0 8 2 0.6 3 7 2 6.5 7 4 P 0.0 0 0 0.0 0 0 0.0 0 0
2.5 平扫及强化扫描特征
68例患者经MRI检查,15例胶质母细胞瘤,占22.06%(15/68)。胶质母细胞瘤多见于儿童,将近50%以上的患者病灶直径大于7.5cm,瘤体内部存在明显出血、钙化、囊变、坏死等,钙化现象极为常见,在整个瘤体中均存在。MRI扫描,T2WI是高信号,T1WI是低信号,周围水肿明显,增强扫描后可见花环状特征。17例少突胶质细胞瘤,占25.00%(17/68)。MRI扫描后,T2WI是高信号,T1WI是低信号,可见明显囊变、钙化灶,瘤体周围存在轻中度水肿,增强扫描后可见斑点状强化或者线条状强化。13例混合性胶质瘤,占19.12%(13/68)。MRI扫描后,T2WI是高信号,T1WI是等低信号,增强扫描后病灶无明显强化。病灶周边水肿明显,增强处理后,实性成分强化明显,病变部位的囊性成分较多,囊壁光滑度良好。9例室管膜瘤,占13.24%(9/68)。MRI扫描后,T2WI是高信号,T1WI是低信号,增强扫描后强化不明显。瘤体无明显水肿,增强扫描后可见不规则环状强化。囊壁光滑、薄,可见明显环状强化。4例脉络丛乳头状瘤,占5.88%(4/68)。脉络丛乳头状瘤多见于成年人,需要与脑膜瘤相鉴别,脑膜瘤与脉络丛乳头状瘤最大的区别在于脑膜瘤的边缘光滑。脉络丛乳头状瘤MRI扫描可见T2WI以及T1WI是分叶状等信号,脑室系统扩大明显,增强扫描处理后,可见均匀性增强。
3 讨论
现如今,临床针对脑胶质瘤患者的治疗手段主要涉及手术、放疗化疗以及中药等。尽管治疗方式多样化,发病率与死亡率均较高,说明积极改善脑胶质瘤患者的临床预后与延长其生存时间是目前重点关注的问题。脑胶质瘤是由于脊髓、大脑中胶质细胞癌变所致,是先天家族遗传以及后天接触外界致癌因素所致[6]。脑胶质瘤多发生于40岁以上的中老年人群,流行病学调查显示,在全身肿瘤中脑胶质瘤占到了5%[7]。脑胶质瘤根据WHO(世界卫生组织)恶性程度分为四种等级,其中I-II级是低级别肿瘤,III-IV级是高级别肿瘤[8]。低级别的脑胶质瘤恶性程度相对较低,病灶侵袭、浸润程度较轻,经过对症治疗,患者生存率较高[9]。但高级别的脑胶质瘤恶性程度较高,疾病进展速度较快,尤其是IV级脑胶质瘤患者,即便是经过手术结合放化疗等对症治疗,生存期也不足16个月[10]。脑胶质瘤的临床症状与病灶影响的脑部功能以及肿瘤的占位效应有关,大部分脑胶质瘤患者均存在不同程度视物模糊、癫痫、头痛等症状。当病灶组织逐渐增大时,周围神经组织会受到侵犯,患者会出现言语功能失调、四肢无力、自理能力减退等,给社会、家庭带来了沉重负担。随着脑胶质瘤患者恶性程度的加重,治疗方式及患者预后均会受到影响。
临床在手术治疗前,应对脑胶质瘤患者病情作出准确诊断。常规X线、CT等影像学技术难以对脑胶质瘤患者病情作出定性、定位诊断,诊断难度较大,准确率较低,漏诊率、误诊率均较高,存在一定的局限性。MRI与X线、CT等影像学技术比较,分辨率较高,不需要重建即可获得多序列成像、三维断面成像,在多种肿瘤中具有较高的诊断价值。但MRI也存在一定不足,例如价格昂贵,部分患者、家庭难以接受,这也是MRI并未在基层医院推广开来的原因之一。
本研究显示,68例患者经MRI检查,15例为胶质母细胞瘤,占22.06%。17例为少突胶质细胞瘤,占25.00%。13例为混合性胶质瘤,占19.12%。9例为室管膜瘤,占13.24%。4例为脉络丛乳头状瘤,占5.88%。低级别组无水肿率(53.33%)、轻度水肿率(40.00%)高于高级别组(2.63%、34.21%),低级别组中度水肿率 (6.67%)、重度水肿率 (0)均低于高级别组(31.58%、31.58%),P<0.05。 表明低级别的脑胶质瘤患者病灶周边组织水肿较轻,以无水肿或者轻度水肿居多,而高级别的脑胶质瘤患者水肿程度较重,以中度水肿和重度水肿居多。另外,低级别组ADC值高于高级别组,P<0.05。表明低级别的脑胶质瘤ADC值相对较高。分析如下:MRI诊断中ADC值的大小主要反映细胞外间隙的大小。低级别脑胶质瘤由于病灶恶性程度较低,细胞外有较多的自由活动水分子,扩散速度较快,ADC值较高[12]。高级别脑胶质瘤由于大量的癌细胞堆积、浸润,导致细胞外水分子活动空间缩小,水分子活动受限,从而导致ADC值偏低。大量研究证实,恶性肿瘤细胞中ADC值均比良性肿瘤的低[13]。低级别脑胶质瘤血管内皮增殖不明显、没有有丝分裂,但病灶内部细胞之间的构成,却不像白质纤维髓鞘那样有高度的方向性。 在朱季子等(2019)[14]研究中,低级别组 ADC 值(1.23±0.26)×10-3mm2/s高于高级别组 (0.86±0.14)×10-3mm2/s,P<0.05,与本研究结果接近,证实了高级别脑胶质瘤患者通过MRI检查,ADC值更低,临床可将ADC值降低作为脑胶质瘤患者病情恶化、加重的标志。研究还显示,低级别组Cho/Cr、Cho/NAA均低于高级别组,低级别组NAA/Cr高于高级别组,P<0.05。出现差异的原因,可能是高级别的脑胶质瘤患者病灶组织侵袭、浸润能力更强,导致细胞膜转换速率更高。 在张格等(2020)[15]研究中,低级别组Cho/NAA(1.8±0.4)均低于高级别组(5.4±2.1),而低级别组 NAA/Cr(1.2±0.2)高于高级别组(0.7±0.3),P<0.05,与本研究结果接近,证实了本次研究结果的可靠性、准确性、代表性。
脑胶质瘤患者的星形细胞瘤、胶质母细胞瘤以及少枝胶质细胞瘤图像中,三种不同瘤体T1WI序列中图像呈现等信号或者低信号,且T2WI序列显示高信号,鉴于胶质瘤病理特征存在不一致性,因此对该项疾病进行鉴别诊断需要借助 MRI进行增强扫描[16-17]。星形细胞瘤强化方式主要分为三类,即为不均匀斑点、片状轻中度以及斑片状显著强化等。临床研究显示,脑胶质瘤强化程度和信号均匀程度与患者的病理分级存在密切联系。例如,肿瘤病理分化高的胶质瘤瘤体细胞繁殖速度相比其他细胞比较快,易出现坏死以及囊性异常等现象。本研究中发现的少突胶质瘤患者瘤体显示出现明显的囊性改变、钙化灶等情况,和少突胶质瘤膨胀性生长存在密切的相关性,因此使其钙化发生率较大[18]。钙化表现T1WI、T2WI图像中均显示是低信号,其次,在增强序列中偏良性瘤体明显增强,未见显著的强化现象,与此同时依据上述进行增强强化,若患者的肿瘤四周发生明显的水肿,T1WI呈现低信号,T2WI呈现高信号,方便鉴别水肿与瘤体。另外,胶质母细胞瘤作为星形细胞瘤中最为常见的恶性类型,瘤体的生长速度非常快,1年内的生存率<15%,恶性肿瘤行增强扫描中的图像呈现多种多样化,存在均匀一致性增强,呈现不均匀或者其他强化表现,加上胶质母细胞瘤MRI强化特征多呈现“花环状”强化,胼胝体常常受累,中线存在明显的结构偏移[19]。但需要注意的是,50%~80%的星形细胞瘤与少突胶质细胞瘤均会伴随不同程度的基因突变,但原发性胶质母细胞瘤出现突变的几率较小,需依据不同阶段脑胶质瘤MRI影像学特点区分强化情况,进而对不同脑胶质瘤进行有效鉴别与诊断[20]。
本研究存在一定不足,例如样本病例数较少、病例均来源于同一家医院,研究时限较短,对结果的代表性、一般性、有效性有所影响,因此仍需扩大样本例数、增加不同医院脑胶质瘤病例、延长研究时限,为评估MRI在脑胶质瘤诊断护理中的应用价值提供更多参考依据。
综上所述,MRI可以对脑胶质瘤患者病情作出准确诊断,明确分级程度,提供脑血流、ADC值等多种影像学参数,为临床医生制定治疗方案提供科学的参考依据。
