槲皮素对创伤后应激障碍大鼠行为变化和海马IL-6及BDNF表达的影响
2022-12-22王重钰倪桂莲陈嘉宜朱孙炜吴仲敏胡伟玲
王重钰,倪桂莲,翟 晖,陈 浩,陈嘉宜,朱孙炜,吴仲敏,胡伟玲
(1.台州学院 医学院,浙江 台州 318000;2.临海市第一人民医院 神经内科,浙江 临海 317000)
0 引言
创伤后应激障碍(Post-Traumatic Stress Disorder,PTSD)是生物个体在遭受意外突发的重大创伤性事件后,延迟发生且持续呈现的精神心理疾病,其核心症状表现为对创伤事件的闯入性再体验、对创伤相关线索的持续回避及对周边环境的过度警觉等,给个体造成极大的痛苦[1]。已有的研究显示:PTSD的发生与海马组织IL-6、BDNF含量的改变密切相关,高水平IL-6介导的神经毒性作用和脑源性神经营养因子(Brain-Derived Neurotrophic Factor,BDNF)的低水平表达导致海马神经元的再生抑制,可能是PTSD发生的重要机制之一[2]。然而,有关PTSD的发病机制至今尚不明确,在临床上缺乏根治药物。槲皮素(Quercetin,QUE)是一种黄酮醇类化合物,具有抗炎、抗氧化、免疫调节等作用,同时参与焦虑、抑郁样行为的调节[3-4],但至今鲜见有关QUE改善PTSD样行为的相关研究报道。本文在传统的连续单一应激(SPS)刺激造模基础上联合足底电刺激(S)方法制作PTSD大鼠模型,观察QUE对模型大鼠PTSD样行为的调节作用以及海马IL-6和BDNF表达的影响,为揭示中药防治PTSD的中枢机制以及寻求药物干预的精准靶点提供可借鉴的实验数据。
1 材料和方法
1.1 实验药物、试剂和仪器设备
QUE(货号:Q8010)由 Solarbio 公司提供;免抗大鼠 BDNF(货号:A1307)由 ABclonal公司提供;免疫印迹相关试剂以及ELISA试剂盒均由Elabscience公司提供;RIPA裂解液和BCA试剂盒由碧云天生物技术有限公司提供;旷场实验、高架十字迷宫实验设备由上海吉量软件科技有限公司提供。
1.2 实验动物及分组
健康成年SD大鼠,雄性,6周龄,SPF级,体重(180±30)g,由浙江维通利华实验动物技术有限公司提供,动物合格证编号为20210421Aazz0619999987,实验动物使用许可证号为SYXK(浙)2021-0013。大鼠每笼5只饲养(湿度:40%±60%,12 h黑暗/白昼交替循环,自由饮水进食),适应性饲养7 d后采用完全随机方法分成对照组、PTSD组、QUE组,每组30只。本实验经过台州学院动物伦理委员会批准。
1.3 大鼠PTSD模型构建及干预方法
采用连续单一应激和足底电击相结合方法构建PTSD大鼠模型,具体流程为:①束缚:将大鼠固定于定制的大鼠固定器内2 h。②强迫游泳:将大鼠放入圆形有机玻璃缸中,缸内盛水,水深40 cm,水温25℃,持续游泳20 min。③麻醉:将大鼠置于密闭且装有乙醚浸湿棉球的玻璃缸内,至大鼠失去知觉后取出。④电击:大鼠苏醒30 min后,把大鼠放于自制的电击箱内,适应196 s后给予足底电击,电击电流为0.8 mA,每次持续通电10 s,间歇10 s,共计15个循环周期。上述操作结束后将大鼠放回原鼠笼内饲养。
造模完成后,QUE组大鼠灌服QUE(50 mg/kg,溶于生理盐水);对照组和模型组大鼠灌服生理盐水,各组给药体积均为10 mL/kg,每日1次,分别在实验的第7 d和第14 d观察干预效果。
1.4 旷场实验
在造模后的第7和14 d分别进行旷场实验。旷场箱的底面有16个方格,其中位于底面中心的4个正方格为中央格,位于中央格四周的12个正方格为外周格。实验时将大鼠放在底面正中格中央,摄像头安放在中央格正中上方,自动记录大鼠在旷场箱5 min内的探索次数,探索次数=后肢直立次数+穿越中央格次数。
1.5 高架十字迷宫实验
高架十字迷宫由一个开放臂和一个闭合臂彼此十字交接相连而成,离地面约40 cm,二臂交接区为中心平台。实验开始时,将大鼠放于中心平台中央,头朝向闭臂区,观察5 min内大鼠进入开臂区和闭臂区的累计次数和时间,分析大鼠进入开臂区的次数和在开臂区的停留时间分别占进入开、闭臂区总次数和在开、闭臂区停留总时间的百分比。用焦虑指数衡量大鼠的焦虑程度,焦虑指数=1−(1/2)×(进入开臂区的次数/进入开、闭臂区的总次数)+(1/2)×(在开臂区的停留时间/在开、闭臂区停留的总时间)。
1.6 海马组织Nissl、HE染色
随机取每组5只大鼠,经水合氯醛腹腔麻醉后,开胸经左心室向主动脉内插管,快速灌注生理盐水150 mL,接着灌注多聚甲醛作脑组织内固定,固定结束后立即开颅取脑;选择海马区域作石蜡包埋,石蜡切片机连续切片,每张片厚5 μm,切片分2套,1套做Nissl染色,另1套做HE染色,光镜下观察海马神经元形态结构。
1.7 海马组织BDNF蛋白水平检测
行为学测试结束后,每组另取5只大鼠,深麻醉后,断头取新鲜海马组织,冰浴提取总蛋白,按BCA检测试剂盒要求测定蛋白浓度。取30 μg样品蛋白,常规完成电泳、转膜、封闭,加入BDNF一抗或GAPDH一抗,4℃孵育过夜,TBST洗膜,加入二抗室温孵育1 h,TBST洗膜,ECL显色剂曝光,以BDNF条带的灰度值与对应的GAPDH条带灰度值比值代表BDNF蛋白的相对表达量。
1.8 海马组织IL-6含量检测
取各组余下的5只大鼠,依上述方法提取新鲜海马组织,称重后将海马组织移入玻璃匀浆器中进行充分研磨,得到组织匀浆液,经离心后吸取上清液。后续的检测步骤按照IL-6 ELISA检测试剂盒流程要求进行IL-6含量测定。
1.9 海马组织IL-6含量和BDNF蛋白水平与行为学指标值之间的相关性分析
采用Pearson相关分析方法,分析各组大鼠海马组织IL-6、BDNF含量和大鼠探索次数以及焦虑指数之间的相关性,用相关系数(r)表示对应数值之间的相关程度。
1.10 统计学分析
采用SPSS 22.0统计软件分析,数值以均数±标准差(±s)表示。组间比较采用单因素方差(ANOVA)分析或重复测量方差分析,两组间比较采用t检验,以P<0.05为差异有统计学意义。采用Pearson相关性分析方法分析海马组织IL-6含量和BDNF蛋白水平与行为学指标值之间的相关性,以相关系数r值表示两个参数的相关性,r的绝对值越接近1表示两者相关性越强。
2 结果
2.1 QUE对大鼠PTSD样行为的调节作用
2.1.1 QUE对大鼠探索能力的影响
如图1所示,PTSD 7 d组和14 d组大鼠在旷场箱内的直立次数(图1A)、穿越中央格次数(图1B)和探索次数(图1C)均明显少于同时段Control组,差异有显著统计学意义(P<0.01);QUE组大鼠在旷场箱内的直立次数(图1A)和探索次数(图1C)明显多于PTSD组,差异有显著统计学意义(P<0.01);穿越中央格次数(图1B)略多于PTSD组,差异有统计学意义(P<0.05)。
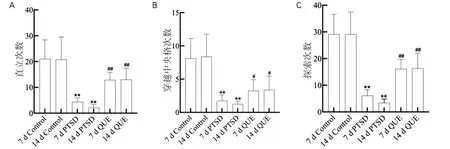
图1 QUE对PTSD大鼠大鼠探索能力的影响(n=15)
2.1.2 QUE对大鼠焦虑样行为的影响
如图2所示,PTSD 7 d组和14 d组大鼠在开臂内停留时间百分比(图2A)、进入开臂次数百分比(图 2B)均明显低于同时段 Control组(P<0.01),而焦虑指数(图 2C)明显高于同时段 Control组(P<0.01);和PTSD组相比,QUE组大鼠在开臂内停留时间百分比(图2A)、进入开臂次数百分比(图2B)均显著增加(P<0.01),焦虑指数(图 2C)则明显降低(P<0.01)。
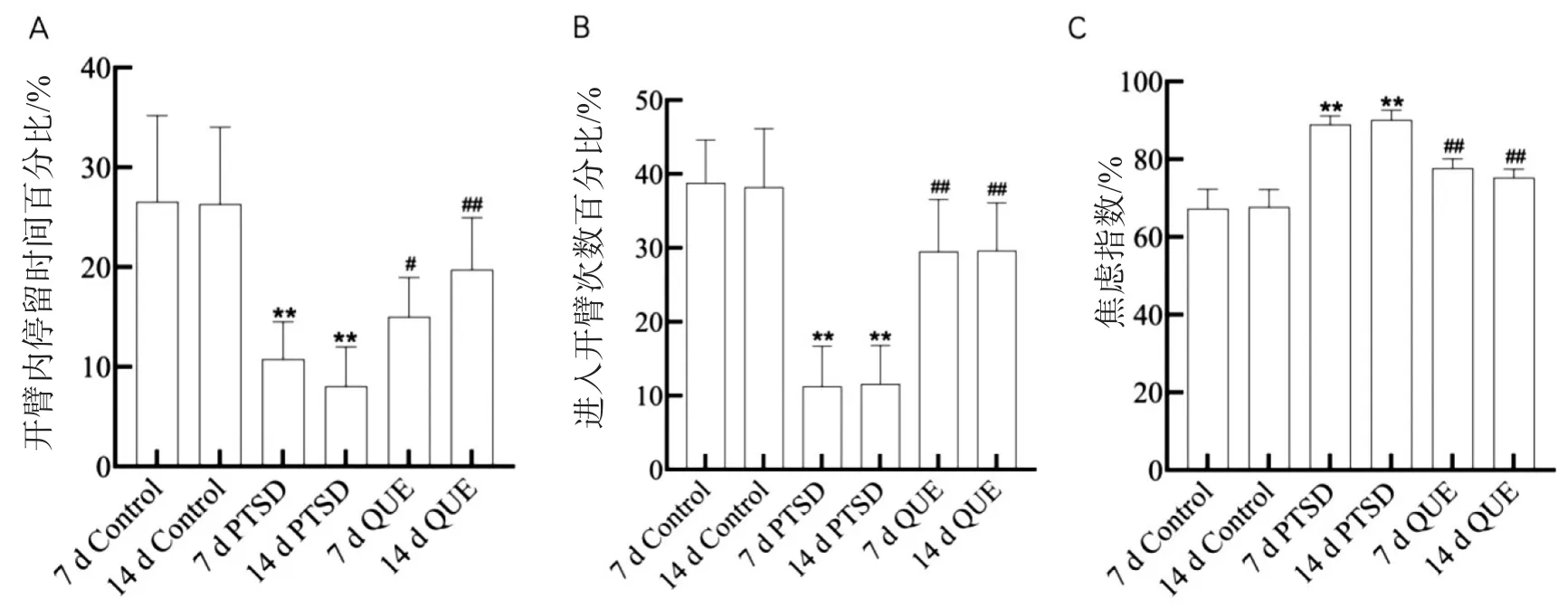
图2 QUE对PTSD大鼠焦虑样行为的影响(n=15)
2.2 QUE对海马组织结构的影响
如图3所示,海马组织HE染色(图3A)结果显示,Control组大鼠海马组织结构清楚,神经元轮廓清晰,排列规则,染色均匀,胞体饱满,尼氏小体丰富,核仁深染、清晰,核膜完整;PTSD组大鼠海马组织结构模糊,神经元数量减少,排列紊乱,细胞染色不均,外形不规则,核固缩现象明显;QUE组大鼠神经元数量较PTSD组增加,神经元排列趋向整齐,核固缩现象减少。Nissl结果(图3B)显示,PTSD组大鼠海马神经元胞浆内尼氏小体显著减少,出现空泡样结构,QUE组大鼠海马神经元胞浆内尼氏小体增多,空泡样结构减少。
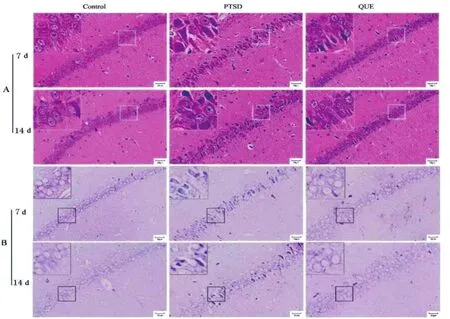
图3 大鼠海马神经元的结构和分布(标尺=50 μm,n=5)
2.3 QUE对海马组织IL-6含量的影响
如图4所示,ELISA检测结果显示,实验第7、14 d时PTSD组大鼠海马组织IL-6含量(pg/mL,均数±标准差,n=5)均较同时段Control组显著升高(P<0.01);QUE组IL-6含量均低于同时段 PTSD组(P<0.01),且 14 d组低于 7 d组(P<0.05)。
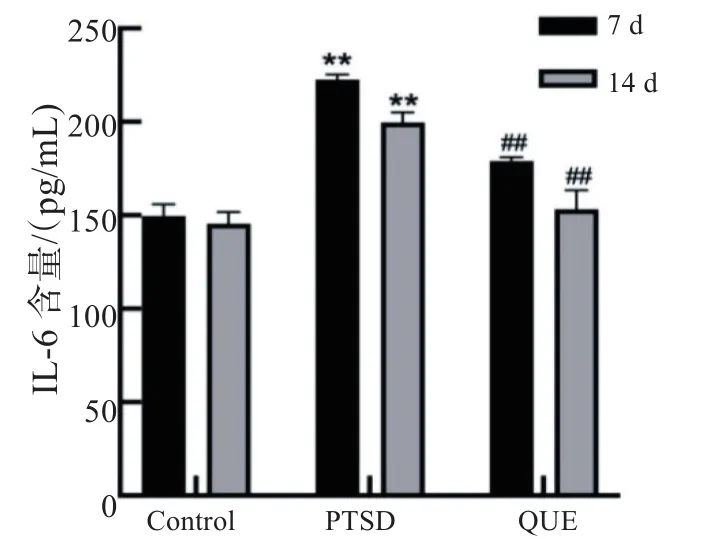
图4 各组大鼠海马组织IL-6含量
2.4 QUE对海马组织BDNF蛋白水平的影响
如图5所示,实验在第7、14 d时,PTSD组大鼠海马组织BDNF蛋白水平均低于同时段Control组(P<0.01);QUE组大鼠海马组织BDNF蛋白水平显著高于同时段PTSD组(P<0.01)。
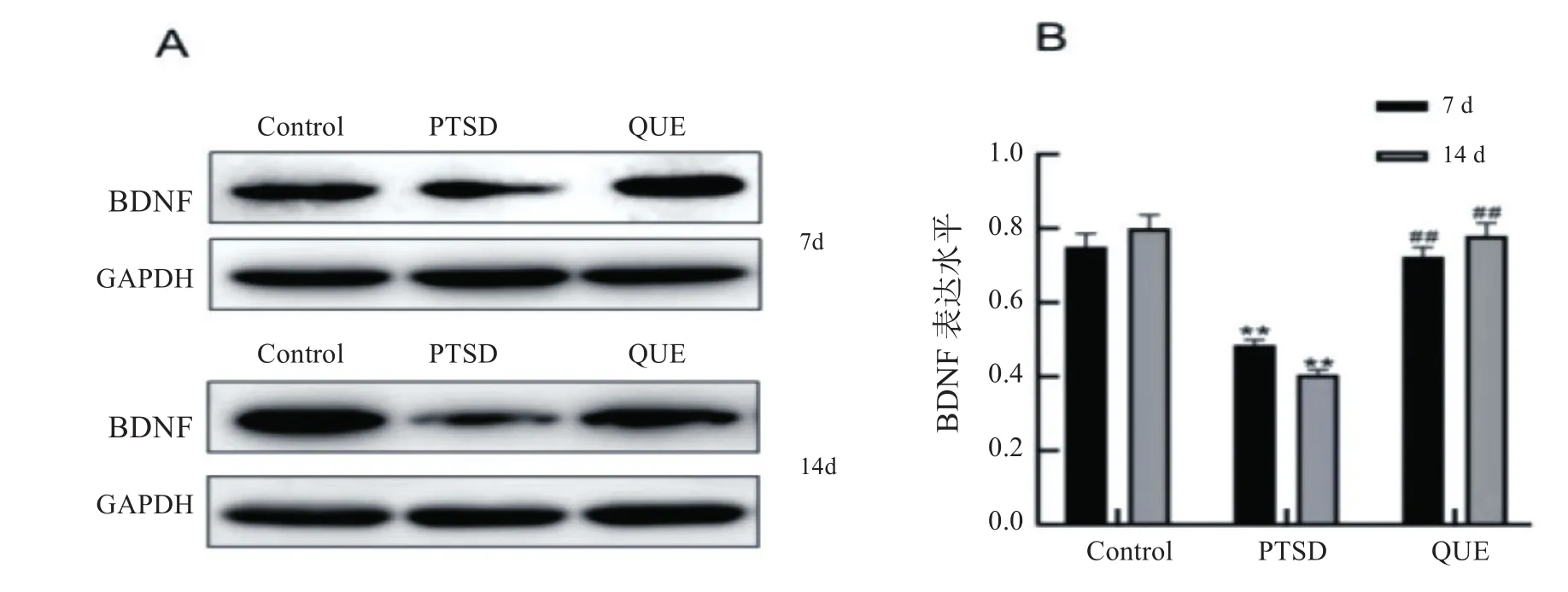
图5 大鼠海马组织BDNF蛋白表达水平(免疫印迹,均数±标准差,n=5)
2.5 海马组织IL-6含量和BDNF蛋白水平与行为学指标值之间存在显著相关
Pearson相关性分析如图6所示,海马组织IL-6含量与PTSD大鼠的探索次数之间(图6A)呈负相关(r=-0.72,P<0.01),与焦虑指数之间呈正相关(图 6B,r=0.72,P<0.01);BDNF 蛋白水平与探索次数之间呈正相关(图 6C,r=0.74,P<0.01),与焦虑指数之间呈负相关(图 6D,r=-0.80,P<0.01)。从图中可以看出,海马组织IL-6含量和BDNF蛋白水平与PTSD大鼠行为变化之间存在显著相关。
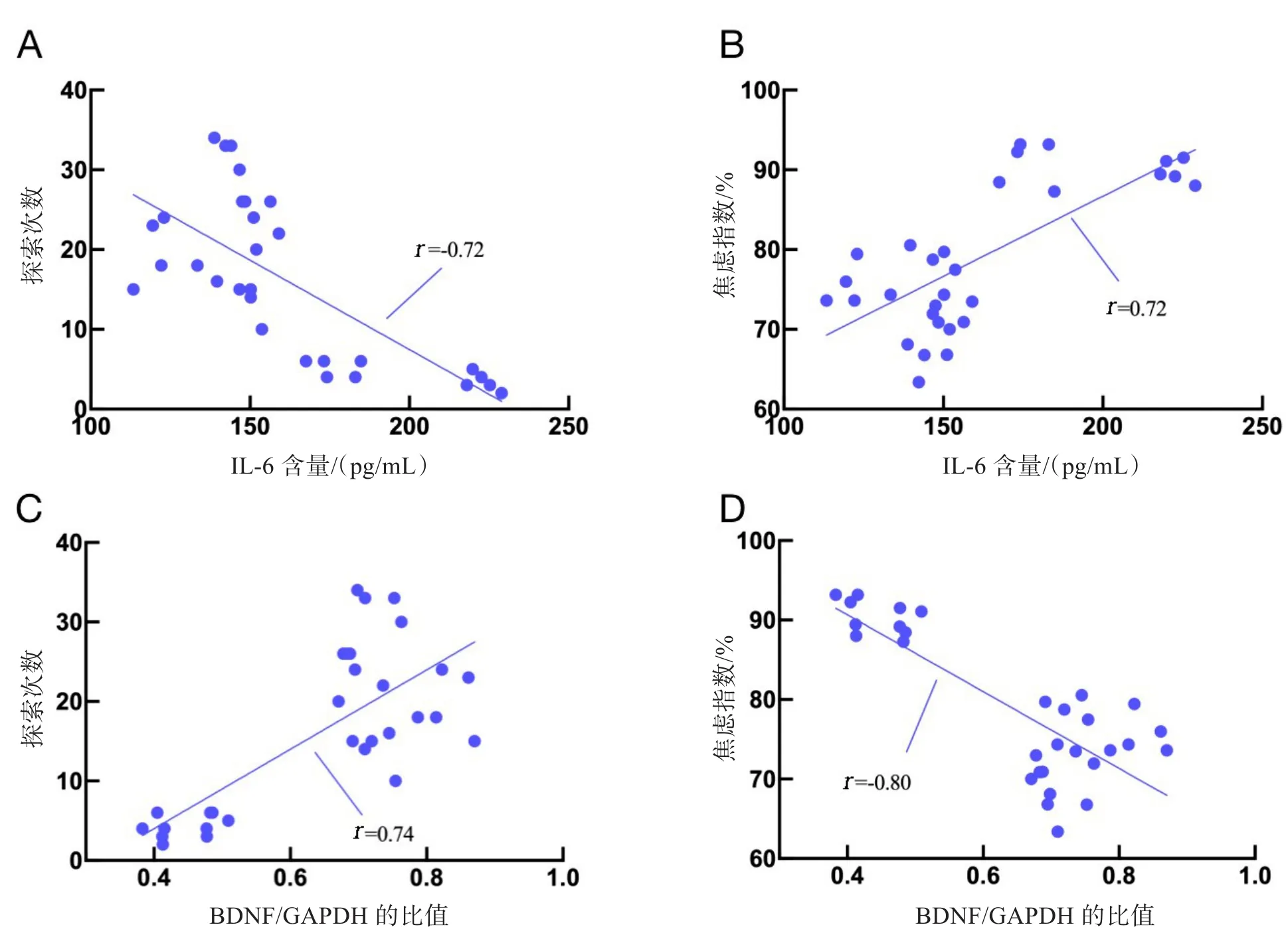
图6 海马组织IL-6、BDNF水平与大鼠探索次数和焦虑指数之间的相关性(n=15)
3 讨论
本实验中的PTSD大鼠模型采用连续单一应激(Single Prolonged Stress,SPS)刺激与足底电刺激(S)相结合的方法进行构建,在造模后第7、14 d分别采用旷场实验和高架十字迷宫实验检测大鼠PTSD样行为变化,验证造模效果,并通过给予槲皮素(QUE)连续灌胃干预,观察QUE对大鼠PTSD样行为的改善效应及其相关的海马机制。结果表明:QUE对大鼠PTSD样行为有明显调节作用,包括增强大鼠的探索能力,减轻大鼠焦虑样情绪等,提示QUE可能具有良好的抗PTSD潜能。
之前有研究认为,海马脑区组织结构紊乱和功能异常与PTSD病理进程有密切联系。海马属大脑边缘系统结构,与情绪、记忆以及应激反应紧密关联。大鼠经历创伤应激刺激后,海马神经元发生变性、细胞萎缩、细胞再生减少[5-6],导致与海马相关的空间记忆、应激、情感控制和对新奇事物的反应处理等过程的缺陷[7]。本文发现模型组大鼠海马组织结构模糊,神经元数量减少,排列紊乱,胞浆内出现空泡样结构,核固缩现象明显;与上述研究报道相一致。同时,在实验中还发现QUE组大鼠海马神经元数量较模型组增加,神经元排列趋向整齐,空泡样结构减少,核固缩现象减轻,说明QUE对PTSD大鼠海马神经元病变有明显改善作用。
近年来也有研究认为:神经炎症反应是引发抑郁症、焦虑症、精神分裂症、癫痫症以及阿尔茨海默病等多种神经精神疾病的重要诱因,针对神经炎症反应的靶向研究已成为当前神经精神疾病诊治领域的热点[8]。研究发现,在多种神经精神疾病中,中枢神经内多种炎症细胞因子如IL-6、IL-1β、TNF-α等分泌紊乱,可诱导模型动物出现以无助、运动探索能力下降、焦虑、睡眠障碍、记忆和学习障碍为特征的行为缺陷[9]。相关研究报道,经创伤应激诱导激发的PTSD大鼠,其海马小胶质细胞被激活,导致了模型大鼠焦虑样行为的出现,以小胶质细胞为靶点,使用米诺环素(小胶质细胞抑制剂)干预后,海马炎性细胞因子的产生减少,模型动物的焦虑样行为明显减轻。由此,可以认为抑制海马神经炎症反应可能是治疗PTSD的有效手段[10]。在本文实验中,SPS&S引发大鼠海马组织炎性细胞因子IL-6含量持续上升,而QUE连续灌胃干预7 d后海马组织内升高的IL-6水平明显下降,连续干预14 d后海马IL-6水平进一步下降,由此表明QUE的抗PTSD效应可能与其抑制海马神经炎症反应有关。而神经炎症反应和PTSD样行为之间有何关联?已有相关研究证据表明:神经炎症反应所释放的炎性细胞因子导致了BDNF信号传导障碍,这和创伤应激、抑郁、焦虑等多种神经精神症状的发生存在关联[11]。海马组织内过度炎症反应将导致BDNF信号通路的损伤,进而抑制BDNF的正常表达,最终导致海马神经元损伤和PTSD样症状的出现。本文的结果显示:模型大鼠海马组织内BDNF水平在造模后第7 d出现下降,至第14 d时含量进一步降低,而QUE持续干预7~14 d后这种下降趋势得到扭转。因此,可以得出模型大鼠经QUE连续干预后出现的海马组织BDNF水平升高可能是QUE抑制海马神经炎症反应的结果。在实验中还发现:海马组织内IL-6、BDNF的水平变化与大鼠探索能力、焦虑水平变化之间存在内在关联。海马IL-6水平的升高引发大鼠旷场箱内探索能力下降,开放臂内焦虑指数升高;而海马BDNF水平升高时则出现了反向的效果。但是,在PTSD模型动物中海马神经炎症反应和BDNF功能障碍之间到底存在怎样的因果联系,以及二者与PTSD样行为变化之间的内在联系仍需做更深入的实验研究。
