贵长猕猴桃蒂腐病病原菌分离鉴定及防治药剂毒力测定
2022-12-22芈婷婷瞿光凡王小岗孙雁征雷霁卿巴良杰
芈婷婷,瞿光凡,王小岗,孙雁征,雷霁卿,巴良杰,曹 森
(贵阳学院食品与制药工程学院,贵阳,550005)
猕猴桃Actinidiachinensis因含有大量维生素C、叶酸等营养成分,果实酸甜可口,深受广大消费者喜爱[1-4]。近年来,随着猕猴桃种植面积不断扩大,产量逐渐上升,但猕猴桃病害却不断加重,影响猕猴桃产业的高质量发展[5]。目前,大多数学者主要集中研究猕猴桃软腐病的病原菌分离鉴定及防治[6],而蒂腐病已逐渐出现在猕猴桃主产区,但关于猕猴桃蒂腐病的研究相关的报道还比较少。因此,分析猕猴桃蒂腐病病原菌,筛选有效的杀菌剂,对猕猴桃蒂腐病的防控具有重要意义。
化学杀菌剂是防治猕猴桃病害[7]的有效手段之一。裴艳刚等[8]研究发现,嘧霉胺、咯菌腈、腐霉利和异菌脲对猕猴桃灰霉病均有较好的防治效果;张凯东等[9]报道了17种杀菌剂对猕猴桃叶斑病病原菌的生长均有一定的抑制作用,其中50%咪鲜胺锰盐可湿性粉剂、50%苯甲丙环唑乳油、40%氟硅唑和50%氟啶胺悬浮剂具有强毒力作用;吴文能等[10]研究表明,75%肟菌酯戊唑醇、30%己唑醇、43%戊唑醇和10%苯醚甲环唑对贵长猕猴桃软腐病具有较好的控制效果。本研究基于贵长猕猴桃蒂腐病的病原菌分离,结合形态特征及ITS序列分析对其进行鉴定,并采用6种化学杀菌剂对病原菌进行室内毒力测试,以期为贵长猕猴桃蒂腐病的有效防控提供理论依据。
1 材料与方法
1.1 材料与试剂
贵长猕猴桃采摘于贵州省修文县猕猴桃试验基地;PDA培养基,上海博微生物科技有限公司生产;70%甲基硫菌灵,允发化工上海有限公司生产;43%戊唑醇,江苏辉丰生物农业股份有限公司生产;45%咪鲜胺,苏州富美实植物保护剂有限公司生产;50%多菌灵,四川稼得利科技开发有限公司生产;50%异菌脲,苏州富美实植物保护剂有限公司生产;10%苯醚甲环唑,先正达南通作物保护有限公司生产。
仪器与设备主要有:超净工作台,上海苏净实业有限公司生产;高压灭菌锅,上海三申医疗器械有限公司生产;光学显微镜,奥林巴斯公司生产;ChemiDoc免染型蛋白印迹成像系统,成都百乐科技有限公司生产。
1.2 试验方法
1.2.1 病原菌的分离纯化
采用组织分离法[11]对贵长猕猴桃蒂腐病病原菌进行分离。将自然发病的猕猴桃用75%乙醇浸泡30 s,无菌水冲洗2~3次后置于超净工作台中自然晾干,用灭菌解剖刀切取病健交界处组织接在PDA培养基上,于28 ℃恒温培养箱中培养,待菌落形成后挑取菌落边缘菌丝于新的PDA培养基中培养,经过3~5次划线分离,获得纯化菌株。
1.2.2 病原菌的致病性测定
依据科赫法则[12]对贵长猕猴桃蒂腐病病原菌进行致病性测定。挑选健康的贵长猕猴桃果实,用75%医用酒精擦拭果面进行消毒,在健康果实果蒂处打孔,采用针刺法将病原菌菌饼接种到伤口处,以无菌菌饼作为对照,于28 ℃恒温培养箱中培养,待果实发病后再次分离培养病原菌,并根据形态特征与原接种菌株进行比较,如果一致则确定为该病原菌。
1.2.3 病原菌形态学鉴定
对贵长猕猴桃蒂腐病病原菌形态学鉴定,挑取已纯化的病原菌的菌丝,接种到PDA培养基上,于28 ℃恒温培养箱中培养至接近培养皿壁,观察各致病菌株在PDA培养基上的菌落特征。挑取少量菌丝于载玻片上,利用光学显微镜观察菌丝形态、分生孢子特征等,进行病原菌初步鉴定。
1.2.4 病原菌分子生物学鉴定
在固体培养基上培养 3~5 d 后,参照植物基因组DNA提取试剂盒提取病原菌基因组DNA,刮去菌丝体,利用真菌基因组DNA快速抽提试剂盒(生工有限公司,贵阳)提取病原菌基因组。以提取的基因组DNA为模板,应用通用引物ITS1(5′—TCCGTAGGTGAACCTGCGG—3′)和ITS4(5′—TCCTCCGCTTATTGATATGC—3′)进行扩增。引物扩增体系为:2×Taq PCR Master Mix15 μL,DNA 1 μL,10 mmol/L上游引物1 μL与10 mmol/L下游引物1 μL,超纯水12 μL。PCR 循环条件为:95 ℃预变性5 min,95 ℃变性30 s,58 ℃ 退火30 s,72 ℃ 延伸30 s,共35个循环,72 ℃ 修复延伸5 min,4 ℃保存。PCR产物用1%琼脂糖进行凝胶电泳成像检测。利用 Master Mix进行 PCR 扩增。扩增产物经电泳检测后送样测序(生工有限公司,贵阳),序列结果与 NCBI 数据库中数据进行核酸BLAST比对,并选择同源性相近的物种结合MEGA 7软件以邻接法构建系统发育树[13],结合病原菌的形态特征对其进行鉴定。
1.3 抑菌药物筛选
本试验采用菌丝生长速率法[14-15]对供试药剂的体积质量先进行初步筛选,在进行预试验的基础上,确定各供试药剂的最低抑制体积质量(见表1),配制5个体积质量梯度的PDA培养基平板,以无菌水为对照(CK)。将蒂腐病菌株置于28 ℃恒温培养箱中培养,7 d后用灭菌打孔器取直径为5 mm的边缘菌丝块,分别接种到各含药培养基中央,重复3次,置于28 ℃恒温培养箱中培养7 d。采用十字交叉法测量菌落直径,取平均值计算出菌丝生长速率,以药剂质量密度对数为自变量,抑菌率对应的概率值为因变量,求出毒力方程。

表1 不同供试杀菌剂的体积质量
生长抑制率(%)=(对照菌落直径-处理菌落直径)/(对照菌落直径-0.5)×100,0.5为灭菌打孔器取的菌丝块的直径。
1.4 数据处理
利用 Excel 2010软件以体积质量对数为自变量(x)、概率值为因变量(y),求得回归方程y=ax+b,并计算出相关系数(r)与有效抑制质量密度(EC50值)。
2 结果与分析
2.1 自然发病症状
贵长猕猴桃蒂腐病症状如图1。果蒂处冒出白色绒毛状菌丝,其菌落在猕猴桃果蒂处呈圆形,较平坦,白色霉状物,并逐渐向外扩散,果蒂周围呈萎蔫状(图1A);果蒂处的果肉伴有软烂,腐烂部分果肉向外延伸至全果,腐烂果肉有少量水渍,果肉呈现暗绿色,有透明感(图1B),伴有酒精的气味。

A:感病猕猴桃的外观;B:感病猕猴桃的果肉
2.2 病原菌形态特征
本研究从自然腐烂的贵长猕猴桃果实中分离出2株病原菌,记作GC-1和GC-2(见图2)。GC-1的菌落起初生长状况良好,为白色绒毛状,在培养基中生长3 d后,从菌落中央冒出白色渐层(图2A),有向四周扩散的趋势。菌落呈圆形,较平坦,光滑有光泽,呈半透明,质地干燥易挑起,菌落边缘整齐,气生菌丝发达浓密,有棉絮状,隆起状态较为扁平(见图2B)。经显微镜观察的分生孢子单孢,表面光滑,为镰刀型或纺锤型,有较多的横隔(见图2C)。依据病菌形态特征,初步将其鉴定为木贼镰刀菌Fusariumequiseti。
GC-2菌株菌落较大,外观呈圆形或卵圆形,乳白色绒毛状,菌落表面光滑有光泽,不透明,菌落边缘呈锯齿形,不平整,菌丝致密,菌落质地湿润有黏稠感(图2D、E)。经显微镜观察分生孢子为卵圆形,分生孢子梗直立、细长,不分隔、无分支;分生孢子顶生成团,以下侧方连接于孢子梗,基部有小突起,无色,双胞,分隔处略缢缩,长圆至梨形(图2F)。初步鉴定为粉红螺旋聚孢霉Clonostachysrosea。
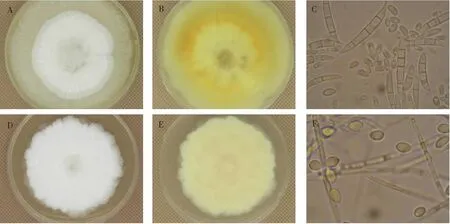
A、B分别为GC-1菌落的正、反面;C为GC-1的分生孢子;D、E分别为GC-2菌落的正、反面;F为GC-2的分生孢子
2.3 病原菌致病性测定
将分离纯化的两株病原菌回接到健康果实上,以接无菌菌饼为对照组,室温放置7 d后,其发病情况如图3所示。对照组(图3A、图3B)均无发病。接种菌株GC-1的猕猴桃果蒂处长出大量的白色绒毛状菌丝,其菌落在猕猴桃果蒂处呈圆形,较平坦,光滑有光泽,质地干燥易挑起,气生菌丝发达。猕猴桃果蒂周围果肉也伴有软烂,腐烂部分果肉向外延伸至全果,腐烂果肉呈少量水渍状,果肉呈现浅黄色,有透明感(见图3C、图3D),并伴有酒精的气味。接种菌株GC-2的猕猴桃果蒂处有大量的白色菌丝,菌丝致密黏稠,其周围果皮上生出均匀的一层灰白色霉状物(图3E),最终为灰霉,并于灰霉上生大量褐色分生孢子梗,或与菌丝体交织一起,形成不规则形扁平黑色小菌核,紧贴于果实上,呈灰色。果肉呈现深褐色,有水渍状软化腐烂现象(图3F)。对发病的病原菌重新分离再培养,其特性和菌丝形态与原先的病原菌一致。

A、B为对照;C、D为接种GC-1后的猕猴桃;E、F为接种GC-2后的猕猴桃
2.4 病原菌的分子鉴定
运用CTAB提取法提取以上两种真菌的DNA,以通用引物ITS1(5′—TCCGTAGGTGAACCTGCGG—3′)和 ITS4(5′—TCCTCCGCTTATTGATATGC—3′)进行 PCR 扩增,扩增产物用1%琼脂糖进行凝胶电泳成像检测,得到GC-1和GC-2 菌株的rDNA-ITS序列。电泳图谱显示两个菌株的rDNA-ITS 序列长度为500~700 bp(见图4)。将PCR产物寄送至贵阳生工公司测序,将菌株序列提交至BLAST网站进行同源性比较,下载同源性较高序列进行系统发育树的构建,如图5所示,发现GC-1、GC-2与木贼镰刀菌和粉红螺旋聚孢霉的同源性分别达99%和100%,并结合形态学及生长特性,确定GC-1、GC-2病原菌分别为木贼镰刀菌Fusariumequiseti和粉红螺旋聚孢霉Clonostachysrosea。

图4 GC-1、GC-2的电泳图谱

图5 猕猴桃蒂腐病病原菌GC-1、GC-2的系统发育树
2.5 6种杀菌剂对蒂腐病菌的抑制作用
试验结果看出,甲基硫菌灵对GC-1的抑菌效果最好,EC50值为8.200 7 mg/L;异菌脲和咪鲜胺对GC-1的抑菌效果较好,EC50值分别为19.643 1、23.245 4 mg/L;多菌灵和戊唑醇对GC-1的抑菌效果明显,EC50值分别为37.750 5、70.253 3 mg/L;苯醚甲环唑对GC-1的抑菌效果相对较差,EC50值为139.217 9 mg/L。从6种杀菌剂对GC-2的抑菌效果来看,多菌灵对GC-2的抑菌效果最好,EC50值为7.854 0 mg/L;咪鲜胺和苯醚甲环唑对GC-2的抑菌效果较好,EC50值分别为14.370 3、28.161 5 mg/L;甲基硫菌灵、异菌脲和戊唑醇对GC-2的抑菌效果相对较差,EC50值分别为100.795 3、126.379 7和135.900 8 mg/L(见表2、表3)。
表2 6种杀菌剂对猕猴桃蒂腐病菌GC-1的毒力测定

表3 6种杀菌剂对猕猴桃蒂腐病菌GC-2的毒力测定
3 结论与讨论
木贼镰刀菌Fusariumequiseti和粉红螺旋聚孢霉Clonostachysrosea是寄主范围较广的病原真菌,能够侵染果实和蔬菜,从而导致果蔬失去商品价值[16-17]。本文通过病原菌的形态学鉴定及分子生物学鉴定表明,引起贵长猕猴桃蒂腐病的病原菌为木贼镰刀菌和粉红螺旋聚孢霉。
化学药剂防治是有效控制果蔬病害的重要手段[18-20]。成世杰等[21]研究结果表明,甲基硫菌灵对苹果轮纹病菌的EC50值为0.700 8~0.814 5 mg/L,平均为(3.357 9±0.160 7)mg/L,说明田间苹果轮纹病菌对甲基硫菌灵较敏感。王会会等[22]研究结果显示,40%氟硅唑乳油、10%苯醚甲环唑水分散粒剂、50%多菌灵可湿性粉剂和12.5%烯唑醇乳油对火龙果溃疡病病原菌新暗色柱节孢的抑菌效果最好,EC50值分别为0.050 7、0.131 7、0.183 2和0.173 1 mg/L。李诚等[23]研究发现,75%肟菌酯·戊唑醇水分散粒剂、50%异菌脲悬浮剂、10%苯醚甲环唑水分散粒剂、70%甲基硫菌灵可湿性粉剂、60%吡唑醚菌酯·代森联水分散粒剂等5种杀菌剂对葡萄座腔菌和拟茎点霉菌均有较强的毒力,对葡萄座腔菌的EC50值依次为0.143 9、0.150 2、0.179 5、0.264 0和0.946 6 μg/mL,对拟茎点霉菌的EC50值依次为0.089 3、0.222 8、0.132 0、0.403 4和0.792 2 μg/mL。此外,翟慧者等[24]还发现,在抑菌试验中,抑菌作用最强的药剂是甲基硫菌灵(山西北方种业)和腐植酸·铜,抑菌带均为5.00 cm,其次为菌毒清、丙环唑和甲硫·萘乙酸。本文采用菌丝生长速率法测定了6种杀菌剂(70%甲基硫菌灵、43%戊唑醇、45%咪鲜胺、50%多菌灵、50%异菌脲和10%苯醚甲环唑)对贵长猕猴桃蒂腐病病原菌的室内毒力,结果表明,甲基硫菌灵对GC-1的抑菌效果最好,其次是异菌脲、咪鲜胺、多菌灵和戊唑醇,苯醚甲环唑抑菌效果最差;多菌灵对GC-2的抑菌效果最好,其次是咪鲜胺和苯醚甲环唑,甲基硫菌灵、异菌脲和戊唑醇的抑菌效果最差。这与前人报道甲基硫菌灵和多菌灵具有明显抑菌效果一致。但本研究只是在室内进行测定,仅验证了甲基硫菌灵和多菌灵在试验条件下分别对木贼镰刀菌和粉红螺旋聚孢霉有较强的抑菌作用,其田间防控效果有待进一步研究。
