黄曲霉毒素B1致肉鸡急性肝损伤模型的建立
2022-12-22张月莹姚强朱彦彬任欣慧王琳陈志宝张华
张月莹,姚强,朱彦彬,任欣慧,王琳,陈志宝,,5,张华
(1.盐城师范学院药学院,盐城 224007;2.黑龙江八一农垦大学生命科学技术学院;3.中国动物疾病预防控制中心;4.广东海洋大学滨海农业学院;5.国家耐盐碱水稻创新中心华南中心)
霉菌毒素对人类和动物的健康有害,因为它们经常存在食品和饲料中,并且有很大可能影响人类的生命健康,以及牲畜和家禽的生产力[1-2]。黄曲霉毒素(aflatoxins,AFs)由许多种真菌菌株产生,是一种被广泛研究的霉菌毒素[3-4]。AFs可以污染花生、玉米、小麦等饲料谷物。曾有文章报道,AFs在许多国家都引起过中毒事件,例如在英国的养殖厂就发生过火鸡食用AFs后大量死亡事件,在印度也曾有人因服用了AFs含量过高的毒玉米而导致死亡,并且在中国广东广西两省都出现过花生油AFs超标事件等。因此,AFs对动物和人类的健康都有着巨大的威胁,同时也给世界上众多国家均造成了严重的经济损失。在1993年世界卫生组织(WHO)的癌症研究机构将AFs列为Ⅰ类致癌物[5-6]。
黄曲霉毒素B1(aflatoxin B1,AFB1)由曲霉真菌产生,在AFs家族中具有极强的毒性和致癌性,具有耐高温,难溶于水,易溶于二甲基亚砜(DMSO)等有机溶剂的特性[7-8]。在目前的农业实践中,AFB1已经成为动物饲料中的一种自然污染物,是氰化物的10倍、砒霜的68倍,而且它对人类和动物的肝脏都具有毒性[9-12]。有人发现,AFB1可以增加肉鸡的易感性,容易受病原体感染,导致生产力下降,其代谢产生物可以累积在肉鸡的肝脏中,通过食物链的作用,导致人类的慢性或急性肝损伤,甚至肝癌[5]。AFB1可以通过诱导氧化应激、细胞凋亡和炎症导致动物或人类的肝损伤。
动物模型是疾病研究和药物开发的奠基石,选择合适的动物模型可以更好地帮助人们了解各种疾病的机理,并且也可以因此研究防治措施[13]。目前在肝损伤动物模型的制作中,人们通常选择哺乳动物(如小鼠、大鼠、家兔等)来作为实验动物,很少使用禽类;但在AFB1诱导的疾病过程中,禽类最为敏感[5]。由于禽类在食用AFB1污染的饲料后,大约有1/2经血液运至肝脏代谢解毒,由此肝脏就会严重受损。在人们的日常生活饮食中,鸡作为人类最喜爱的食物之一,它具有许多优点,例如饲养周期短,方便养殖等[14-15]。但在肉鸡饲养的过程中感染了一些疾病,人们通常不易察觉,若是不小心误食这些病鸡,也会因此感染该疾病,这样研究肉鸡疾病机理就变得十分有意义。该试验的主要目的是,通过探讨AFB1暴露的鸡肝组织形态学,抗氧化能力以及氧化损伤的影响,建立鸡急性肝损伤的模型,为后续研究家禽的肝脏损伤作用机制及治疗AFB1的药物研发奠定动物模型,也为今后养殖业的发展提供良好基础。
1 材料与方法
1.1 材料
1.1.1 实验动物
1日龄艾拔益加肉鸡(AA肉鸡)(哈尔滨益农禽业有限公司),养于黑龙江八一农垦大学动物科技学院动物房,饲料为普通适于0~20日龄肉仔鸡饲料(温岭市城东兴源饲料厂),每日自由采食、饮水,自然光照,定时通风换气,保持空气流通。
1.1.2 药物与试剂
AFB1标准品(纯度>98%)(Pribolab公司);AST、ALT、CAT和TBIL检测试剂盒(南京建成生物工程研究所);MDA含量检测试剂盒(Solarbio公司);RIPA强裂解液、BCA蛋白浓度测定试剂盒(增强型)、CuZn/Mn-SOD活性检测试剂盒和ALP检测试剂盒(碧云天生物技术有限公司);Nrf2,HO-1和β-actin抗体(美国Proteintech公司);过氧化物酶标记的羊抗鼠IgG(北京中杉金桥生物技术有限公司);过氧化物酶标记的羊抗兔IgG(美国Jackson ImmunoResearch公司)。
1.2 方法
1.2.1 试验动物的分组及处理
将40只健康的1日龄AA肉鸡先正常喂养3 d后,随机分为4组,每组10只。从第4 d开始每日使用不同剂量的AFB1(见表1)给雏鸡染毒,连续饲喂7 d。最后1次饲喂后,只禁食,正常饮水,24 h后心脏采血,断头处死雏鸡,将右侧肝叶用4%多聚甲醛溶液固定,于组织病理学观察,将剩下的肝脏组织保存在-80℃超低温冰箱中备用,根据后续试验检测内容不同,分别作不同处理。
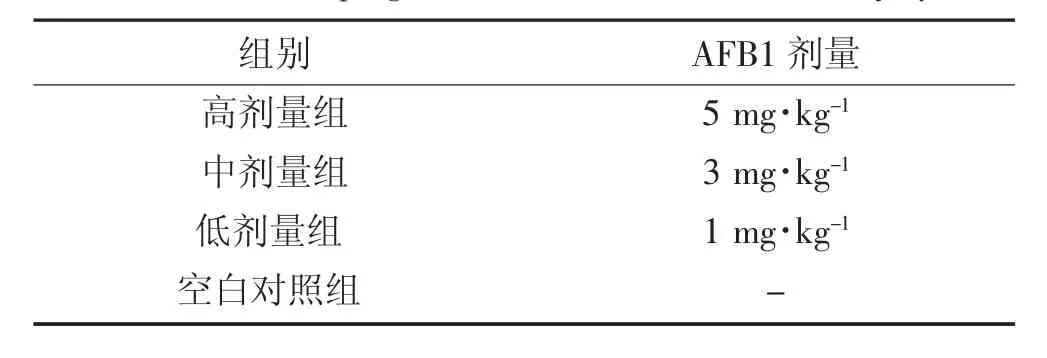
表1 AFB1诱导鸡肝损伤模型分组表Table 1 Grouping AFB1 induced chicken liver injury
1.2.2 肝组织病理学检测
将用4%的多聚甲醛浸泡且固定好的鸡肝脏拿出,通过梯度酒精脱水、二甲苯透明、浸蜡、石蜡包埋等处理后,然后使用旋转切片机开始石蜡修块和切片(厚度大约为5 μm),之后进行H&E染色,再经过切片梯度酒精脱水、二甲苯透明、中性树胶封片、镜检步骤后,随机挑选出10个视野在100倍显微镜下进行观察。
1.2.3 血清肝功能指标测定
心脏取血于离心管中,4℃,3 000 rpm离心15 min获得血清,按照试剂盒中的说明书所述方法分别检测血清中AST、ALT、TBIL和ALP水平。
1.2.4 肝组织抗氧化指标测定
从-80℃冰箱中取出鸡肝脏样品,在称量台上称取大约30 mg,之后加入4℃预冷的PBS,用研磨棒将组织研磨,研磨后吸出匀浆液。之后,将匀浆液在4℃条件下进行12 000 rpm离心,用移液枪吸取上清液即为待测样品,利用试剂盒测定SOD抑制率和CAT含量。
利用电子天平称取大约50 mg的鸡肝组织,随后加入4℃体积比为100 mg∶1 mL的MDA提取液,再用已经提前预冷好的研磨棒进行组织研磨,吸出匀浆液,之后4℃,10 000 rpm·min-1,离心10 min,用移液枪吸取上清液于1.5 mL的离心管中,该液体为待测样品,根据试剂盒说明书方法测定组织MDA含量。
1.2.5 蛋白质印迹分析
称取一定量的鸡肝组织后,将组织用含有蛋白酶抑制剂(PMSF)的RIPA裂解液在冰上处理30 min,随后在4℃,12 000 rpm离心10 min,得到的上清液即为所需蛋白。首先将蛋白浓度用BCA法检测并定量为3 μg·μL-1,上样10 μL。配置12%的分离胶和5%的浓缩胶跑电泳,随后利用湿转转膜法,80 V,45 min将胶上的蛋白转移到PVDF膜上,并用5%的脱脂奶粉在摇床上慢摇、封闭2 h。然后再4℃过夜孵育Nrf2、HO-1、β-actin抗体(按说明书比例进行稀释),之后用TBST清洗4次,每次10 min;再室温置摇床上慢摇孵育相对应的羊抗鼠(或兔)二抗(1∶10 000稀释)2 h,TBST清洗4次,每次10 min;将显色A、B液按1∶1比例配置ECL发光液进行显色,使用凝胶成像仪收集图像。用β-actin作为内参,对目的蛋白条带进行灰度分析,比较。
1.3 统计分析
上述所有实验均重复进行3次,以确保其准确性和重复性。试验所有图利用GraphPad Prism软件制作,免疫印迹图像用Image J软件定量分析,用SPSS 19.0软件对各组数据进行处理,采用t检验进行统计学分析。P<0.05代表具有统计学意义,**代表P<0.01,*代表P<0.05,所有数值表示均为平均值±相对标准偏差。
2 结果与分析
2.1 肝脏表观观察
对鸡肝组织进行表观观察,如图1所示。正常对照组(左图)肝组织呈现暗红色,表面平滑,而AFB1组(右图)肝脏质脆、肿大黄染,表面不平滑,有较多出血点。
2.2 肝组织病理切片观察
试验7 d的肝脏组织病理变化如图2所示。对照组肝组织正常,肝小叶结构完整、中央静脉、生发中心及肝细胞索清晰可见,无明显的病理组织学变化(图2A)。然而用不同浓度AFB1饲粮处理的肉鸡肝组织切片,肝细胞肿胀,脂肪变性明显;肝小叶结构不完整,肝细胞索杂乱,高剂量组尤为严重。这说明试验采用连续饲喂7 d肉鸡5 mg·kg-1AFB1日粮已经造成严重的肝脏损伤(图2 B,C,D)。
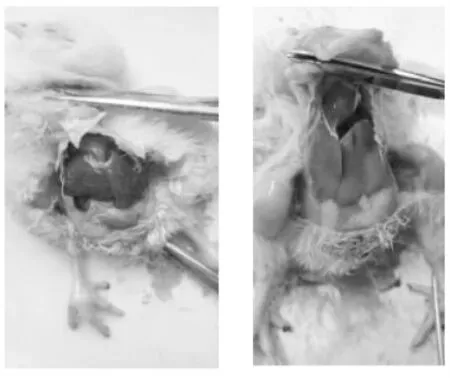
图1 肉鸡肝脏剖检图Fig.1 Liver section of broiler liver
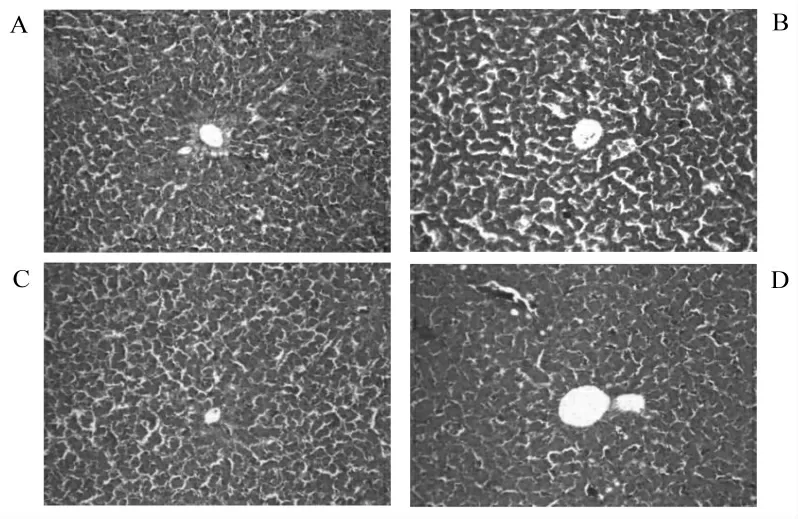
图2 肝组织病理切片(HE染色,100×)Fig.2 Liver histopathological sections(HE staining,100×)
2.3 AFB1对血清生化指标的影响
随着ALT、AST、ALP酶活性和TBIL水平升高,肝细胞膜通透性增加,表明了肝脏受到严重损伤[16];根据图3可知,AFB1各组的血清中ALT、AST酶活性,低剂量组与对照组比略升高,无明显差异,中剂量和高剂量组均比对照组显著升高,AFB1组的血清中TBIL含量都高于对照组,高剂量组升高的更为明显,ALP的表达也有升高趋势,这表明肝细胞受到损伤,这与肝组织H&E病理切片图结果吻合。

图3 各组肉鸡血清肝功能指标Fig.3 Serum liver function indicators of broiler chickens in each group
2.4 AFB1对肝脏抗氧化指标的影响
机体脂质过氧化的严重程度和抗氧化能力的高低可以依据肝脏MDA、SOD和CAT水平的表达高低所反映[17]。结果如图4所示,模型组中MDA含量显著上升,高剂量组达到最高;CAT和SOD活性也均明显下降,SOD活性降低更明显。这说明AFB1浓度的增加会减弱肝脏抗氧化能力。

图4 各组肉鸡肝脏抗氧化指标Fig.4 Liver antioxidant indicators of all broiler groups
2.5 AFB1对Nrf2/HO-1通路的影响
Nrf2是调节肝脏一系列解毒的重要转录因子[18-19]。血红素加氧酶-1(HO-1)作为其下游重要的基因之一。如下图5结果显示,与对照组比较,Nrf2和HO-1的蛋白表达水平随着AFB1的剂量增加而降低。
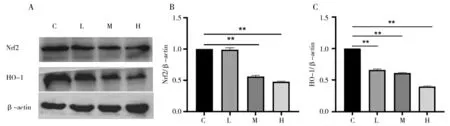
图5 各组肉鸡肝脏Nrf2/HO-1信号通路相关蛋白表达情况Fig.5 Expression of Nrf2/HO-1 signal pathway related proteins in the liver of broilers
3 讨论
肝脏是动物和人类机体内主要的代谢和解毒器官,在日常生活中人类感染细菌、病毒或者过量服用药物,在有毒的环境中长期生存等都会引发各种肝脏疾病[14]。肝脏作为与AFB1第一个接触的器官,是AFB1毒性的重要作用器官,AFB1会导致严重的肝损伤已被大量文献证明[18]。肝脏受到损害后,主要表现为肝小叶结构不正常,肝细胞索杂乱无序。该试验中AFB1组的肝脏病理切片图观察结果与上述描述的内容相切合,证明肝脏已受损害。
在临床上,肝脏是否损伤,主要由血清中的ALT和AST的变化判定。这两种酶主要是由肝细胞合成。若肝脏未受损,血清中这两种酶的活性极低。如果肝脏受到严重破害,引起肝细胞膜破损,则ALT和AST这两种酶会进入血液,使得血清中ALT和AST酶活性严重上调[19]。ALP也可以判断肝脏是否损伤,它在人和动物体内各组织器官中分布范围都很广范,尤其是肝脏这一器官。ALP可以直接参与生物体内的钙和磷的合成与分解,以及磷酸基团在各种物质间的转移等的生理过程的调控,临床上常作为诊断骨骼系统疾病和肝胆系统疾病的指标[20-22]。ALP升高一般出现在胆汁淤积等病症中。研究发现,连续灌胃小鼠21 d 300 μg·kg-1AFB1,可以导致小鼠肝脏损伤,血清中ALT、AST、ALP表达水平显著增加[23];0.125 mg·kg-1AFB1连续灌胃大鼠21 d,大鼠肝脏病理学发生明显改变;AFB1攻毒的雄性大鼠,肝细胞索紊乱,细胞发生明显的空泡变性,血液中ALT、AST、ALP水平显著升高[24],上述研究结果与试验结果一致,模型组ALT、AST酶活性升高,TBIL表达水平增高,其中高剂量组升高至对照组的2倍以上;较对照组比,ALP活性也有升高趋势,说明AFB1造成了肉鸡严重的肝脏结构及功能损伤。
AFB1诱导肝脏损伤,其毒性主要与氧化应激反应为特征[25],AFB1可以引发活性氧(reactive oxygenspecies,ROS)的产生。脂质过氧化、抗氧化酶活力的降低,以及机体氧化应激损伤都是由ROS的产生引起的[18]。MDA、SOD以及CAT同样能够反应机体内脂质过氧化的氧化程度和细胞遭受氧化损伤的程度[21-22]。体外研究发现,人的正常肝细胞系L-02、HL7702细胞经过AFB1诱导损伤后,细胞存活率显著降低,细胞内ROS活性明显增加,MDA表达水平也显著增加,而且SOD、CAT的活力极显著降低[24-26];经过AFB1处理的肉鸡原代肝细胞,也同样发现细胞内ROS水平随着AFB1浓度的升高而增加,而SOD活力与AFB1浓度成反比[18]。试验研究结果表明,与对照组比较,模型组MDA含量显著增高、SOD和CAT酶活性显著降低,与上述文献结果一致。
Nrf2是抗氧化应激的主要转录因子,它会刺激大多数抗氧化剂或解毒酶的基因编码,保护细胞免受损害,一旦机体无法抵御这种过激状态,细胞的保护作用转变为凋亡或坏死作用[27]。HO-1是一种限速血红素降解的酶,发生氧化应激时,氧化剂激活Nrf2核易位,并引发HO-1的上调,HO-1可以阻止游离血红素参与氧化反应,抑制细胞调亡等作用,从而抑制细胞氧化应激[28]。研究发现,当大鼠Nrf2基因被敲除后,大鼠对AFB1的敏感度会增加[29];AFB1刺激体外大鼠肝细胞后,显著降低Nrf2和HO-1的转录水平,同时也降低了则两种氧化因子的蛋白水平[30];在给大鼠灌胃AFB1后,大鼠的肝脏Nrf2、HO-1 mRNA表达下调,肝脏抗氧化酶SOD、CAT、GSH-Px的表达水平也显著下降[31]。试验结果同样表明AFB1模型组肉鸡肝脏组织中Nrf2、HO-1蛋白的表达量均显著下降,说明AFB1可以通过抑制Nrf2的活化和HO-1的表达来抑制动物机体内抗氧化酶的生成,并且在AFB1代谢过程中产生的ROS,动物自身也不能及时地清除,这破坏了体内氧化应激水平,造成了肝脏的结构和功能损伤。
近年来,关于建立AFB1致大鼠(或小鼠)的肝损伤模型的文章报道有很多,例如唐日益[32]连续灌胃大鼠40 d剂量为250 μg·(kg bw)-1的AFB1,造成了显著的肝脏病理损伤,成功制备了AFB1中毒大鼠模型;Li Huang[23]连续灌胃小鼠21 d剂量为300 μg·(kg bw)-1的AFB1,可以导致小鼠肝脏损;高颖等[33]人将小鼠经口灌服300 μg·kg-1的AFB1溶液8周,造成小鼠慢性中毒肝损伤,同时小鼠口服2 mg·kg-1的AFB1溶液1周,导致小鼠急性中毒肝损伤等。报道AFB1致鸡肝损伤的文章较少,而在临床上,鸡黄曲霉中毒病例很多,由此建立鸡AFB1中毒模型具有重大意义。有文章报道,例如卞正容[34]在正常饲粮里添加50 μg·kg-1AFB1连续喂养雏鸡28 d,造成鸡慢性中毒;王兴赫等[35]饲喂肉鸡5 mg·kg-1AFB1日粮28 d,发现鸡肝脏损伤严重;李瑞娟等[36]在饲料中添加AFB1 2.8 mg·kg-1,连续喂养7 d,诱发雏鸡肝损伤。然而AFB1引起雏鸡急性肝损伤的浓度和时间报道文献较少,通过查阅相关文献,选择3种AFB1浓度(1,3,5 mg·kg-1)进行试验,最终结果表明,连续饲喂雏鸡7 d 1,3,5 mg·kg-1AFB1日粮都可以造成鸡肝脏不同程度损伤,5 mg·kg-1AFB1导致鸡肝脏损伤更为严重,效果最明显。
4 结论
综上发现证明了连续饲喂7 d 5 mg·kg-1AFB1日粮可以建立肉鸡急性肝损伤模型,这为临床上治疗AFB1引发的鸡肝损伤以及寻找缓解AFB1致肝损伤的兽药奠定了基础,为开发新型保肝饲料添加剂提供实验依据。
