野生白肉灵芝固体培养特性、驯化栽培及活性成分分析*
2022-12-21牛开阳李娥贤李树红苏锡钧罗宗龙
牛开阳,李娥贤,何 俊,,李树红,苏锡钧,罗宗龙**
(1.大理大学 农学与生物科学学院,云南 大理 671003;2.云南省农业科学院 生物技术与种质资源研究所,云南 昆明 650223)
灵芝属(Ganoderma) 隶属于担子菌门(Basidiomycota) 伞菌纲 (Agaricomycetes) 多孔菌目(Polyporales) 灵芝科 (Ganodermataceae)[1]。灵芝属真菌在全球分布广泛,是一类重要的木腐真菌,具有维持森林生态系统物质循环和能量流动的作用[2-4]。此外,灵芝还是最早被利用,文化最悠久的食(药)用菌之一[5]。现代研究表明,灵芝含有多糖类、三萜类、甾醇类、微量元素、脂肪酸等多种生物活性物质;其中,灵芝多糖与三萜被认为是灵芝中主要的功能成分[6]。大量研究证实灵芝具有抗氧化、抗肿瘤、免疫调节、镇静安神、抗心肌缺血、调节血脂、抗病毒和改善睡眠等药理作用[7-10]。
20世纪50年代,中国科学院微生物研究所首次成功栽培灵芝,之后灵芝在我国逐步实现广泛栽培,并迅速发展成为以生产灵芝孢子粉为主的重要产业[11]。至今,灵芝在我国已有60多年的人工栽培历史,随着栽培技术的不断发展,规模越来越大,出现了栽培品种、技术、模式和原料的多样化[12]。截至2022年2月,获得审定的灵芝品种有26个,其中通过国家级审定的有4个,省级审定的有22个。随着人们生活水平的日益提高,对灵芝产品的需求不断提升,野生灵芝资源难以满足当前市场需求。对野生灵芝资源进行合理开发利用,既能保护野生资源,又有助于促进灵芝产业的健康可持续发展。目前,我国以赤芝(Ganaderma lingzhi)和紫芝(Ganoderma sinense)为主要原料生产的养生保健产品超过500种,药品有100多种,中药化妆产品12种[13-14]。
白肉灵芝(Ganoderma leucocontextum) 于2014年被广东省科学院微生物研究所科研人员采集并命名,随后在拉萨国家农业科技示范园区首次成功驯化栽培[15-16]。野生白肉灵芝主要广泛分布于中国西南高海拔地区阔叶林[17]。由于其菌肉洁白,多糖和萜类等活性成分含量较高,被视为高品质的灵芝品种,产品价格往往比普通灵芝高数倍[18]。目前对白肉灵芝种质资源的研究主要集中在西藏地区,而不同地区灵芝生长特性及子实体活性成分存在较大差异[19-24]。为明确云南省野生白肉灵芝资源特性,发掘栽培性状好、活性成分高的灵芝菌株,以采自云南省昆明市石林县的1株白肉灵芝为材料,开展多基因系统发育分析、菌丝固体培养特性研究及驯化栽培试验,并对子实体活性成分进行测定,旨在为云南野生灵芝的资源开发利用提供参考。
1 材料与方法
1.1 供试材料
供试样品子实体(编号HKAS 123767),于2019年由何俊采自云南省昆明市石林县(海拔为1 979.67 m),经组织分离和纯化获得纯菌株(编号为Lz-124)。子实体标本保存于中国科学院昆明植物研究所隐花植物标本馆(KUN-HKAS),菌株保藏于云南省农业科学院生物技术与种质资源研究所菌种库。
1.2 培养基
PDA培养基:马铃薯(去皮) 200 g、葡萄糖20 g、琼脂20 g,蒸馏水1 000 mL。
基础培养基:马铃薯(去皮) 200 g、葡萄糖20 g、蛋白胨2 g、磷酸二氢钾0.46 g、磷酸氢二钾1 g、硫酸镁0.5 g、琼脂20 g,蒸馏水1 000 mL。
原种培养料配方:小麦80%、阔叶树木屑10%、麦麸8%、石膏粉1%、白糖1%,含水量50%~55%;
栽培种(袋) 配方:阔叶树木屑79%、麦麸18%、石膏1%、白糖2%,含水量50%~55%。
1.3 试剂
KOH(10%)、HCl(1.0 mol·L-1)、NaOH(1.0 mol·L-1)、植物基因组DNA提取试剂盒,北京擎科新业生物技术有限公司。
1.4 形态学鉴定
对供试样品子实体和经组织分离后获得的菌株进行宏观和微观形态观察,并对各项特征进行详细描述和图版制作。
1.5 分子生物学分析
采用试剂盒提取灵芝子实体及菌丝体的DNA,针对样品的ITS、TEF1-α及RPB2三个序列片段,使用引物ITS4/ITS5、TEF1-983/TEF1-1567和RPB2-6f/fRPB2-7cR[25],以参考文献[26]记载的方法进行PCR扩增。经凝胶电泳检测后,将PCR原液送至北京擎科新业生物技术有限公司测序。测序结果通过BLAST在线对比,同时从GenBank中下载灵芝属其他样品序列构建数据库。在CIPRES Science Gateway上使用RAxML-HPC2 on XSEDE进行最大似然(ML) 系统发育树构建[27];系统发育树用FigTree version 1.4.0进行可视化分析,并使用PowerPoint 2019进行编辑。
1.6 固体培养特性试验
配制PDA培养基,混匀后于121℃、0.103 MPa条件下灭菌30 min,倒入90 mm培养皿中制成平板。将保藏的Lz-124菌株活化后转接至培养皿中,待菌丝长满培养皿后备用。
1.6.1 碳源单因子筛选试验
在基础培养基的基础上,不加入葡萄糖作为空白对照(CK1),分别加入麦芽糖、乳糖、蔗糖、可溶性淀粉替代葡萄糖作为供试培养基。采用直径为7 mm的打孔器进行打孔,将菌块接种至固体培养基中央,并置于22℃恒温培养箱中避光培养,每组试验设置5个重复。采用“十”字划线法,每隔24小时测量1次菌落直径,观察并记录菌丝形态及长势。数据结果采用SPSS 20.0软件的Duncan法比较差异显著性(P<0.05),使用Excel 2019制作菌丝生长速度柱形图。菌丝生长速率(V,mm·d-1)公式为:

式中:L表示菌落直径(mm);D表示培养天数(d)。
1.6.2 氮源单因子筛选试验
在基础培养基的基础上,不加入蛋白胨作为空白对照(CK2),分别用氯化铵、硫酸铵、酵母粉、尿素替代蛋白胨作为供试培养基,接种、培养、设置重复及数据处理等方法同1.6.1。
1.6.3 无机盐单因子筛选试验
在基础培养基的基础上,不加入硫酸镁作为空白对照(CK3),分别用三氯化铁、碳酸钙、七水合硫酸锌、氯化钠替代硫酸镁作为供试培养基。接种、培养、设置重复及数据处理等方法同1.6.1。
1.6.4 温度单因子筛选试验
将菌块接种至基础培养基中,分别置于20℃、22℃、24℃、26℃、28℃恒温培养箱内避光培养。接种、培养、设置重复及数据处理等方法同1.6.1。
1.6.5 pH单因子筛选试验
使用HCl(1 mol·L-1)和NaOH(1 mol·L-1)将基础培养基的pH分别调为5.0、5.5、6.0、6.5、7.0作为供试培养基,接种、培养、设置重复及数据处理等方法同1.6.1。
1.7 正交试验
从单因素试验中挑选出对菌丝生长速度影响较大的4个因素:碳源、氮源、无机盐和温度,从每个因素中选出较优的3个水平,采用L9(34)正交表进行4因素3水平正交试验。
1.8 驯化栽培试验
1.8.1 母种制备
将保藏的菌株Lz-124活化之后接种于直径为90 mm的PDA培养基中,并置于22℃恒温培养箱中避光培养备用。
1.8.2 原种制备
采用规格为8 cm×11 cm的玻璃瓶作为原种瓶,按1.2所述配方将培养料混合均匀,每瓶装料质量为0.25 kg。将装满培养料的原种瓶至于121℃、0.103 MPa条件下灭菌2 h。待瓶内培养料温度冷却至30℃以下时开始接种,按照1瓶母种接种10瓶原种的比例接种,并置于室温下培养备用。
1.8.3 栽培种制备
选用17 cm×35 cm×0.05 cm的聚乙烯袋作为栽培袋,按照1.2所述配方将培养料混合均匀后装袋,每袋培养料质量为1 kg。将装满培养料的栽培袋至于121℃、0.103 MPa条件下灭菌2 h,待袋内培养料温度冷却至30℃以下,按照1瓶原种接种10袋栽培袋的比例接种,并置于室温下培养。
1.9 出菇试验
菌丝长满栽培袋后继续进行20 d的后熟培养,之后将栽培袋转移至温室大棚内进行覆土。首先在灵芝菌棒上端棒肩处开小孔(直径为1 cm~3 cm),将开好孔的菌棒移入栽培槽内,开孔端向上,每个菌棒间隔10 cm,再在栽培槽上覆土(厚度为2 cm~5 cm)。在温度为22℃~28℃,土壤湿度为30%,空气湿度为80%~90%的条件下进行出菇管理。试验设置5个重复小区,每个小区面积为1 m×10 m,每个小区栽培100个菌棒。待白肉灵芝生长进入成熟期,从5个小区中各随机挑选20个菌棒采摘子实体,并记录每个菌棒所采摘灵芝的平均鲜质量、干质量、菌盖直径、菌柄长度、菌柄直径,并计算生物学效率(BE,%),计算公式为:
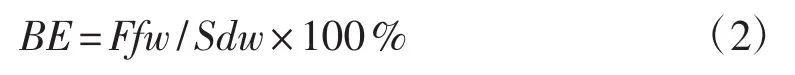
式中:Ffw为子实体鲜质量(g);Sdw为培养料干质量 (g)。
1.10 灵芝子实体活性成分测定
将收集到的灵芝子实体于60℃烘干,粉碎并过80目筛后进行活性成分测定。氨基酸测定参照国家标准《食品中氨基酸的测定》(GB 5009.124-2016)[28]的方法进行测定;矿质元素测定参照食品安全国家标准《食品中多元素的测定》(GB 5009.268-2016)[29]的方法进行测定;粗蛋白含量测定参照食品安全国家标准《食品中蛋白质的测定》(GB 5009.5-2016)[30]的方法进行测定;脂肪含量测定参照国家标准《食品中脂肪的测定》(GB 5009.6-2016)[31]的方法进行测定;多糖、三萜含量测定参照《中国药典》[32]的方法进行测定;灵芝酸测定参照《灵芝产品中灵芝酸含量的测定高效液相色谱法》(NY/T 2278—2012)[33]的方法进行测定。
2 结果与分析
2.1 形态学鉴定结果
根据样品子实体及菌株的形态学特征,将其鉴定为白肉灵芝(Ganoderma leucocontextum)[15],野生白肉灵芝的形态特征见图1。

图1 野生白肉灵芝 (HKAS 123767)形态图Fig.1 Morphology of wild Ganoderma leucocontextum(HKAS 123767)
如图1所示,白肉灵芝生长于滇青冈(Cyclobalanopsis glaucoides) 腐木的基部。担子果一年生,有柄,呈木栓质或木质。菌盖匙形、半圆形至圆形,长轴为3 cm~10 cm,短轴为3.5 cm~7.0 cm,厚可达1.2 cm;菌盖有漆状光泽,呈红褐色至深棕褐色。菌肉白色,有同心环纹,质地较软,在成熟的担子果中无黑色壳质线。菌柄侧生或背侧生,呈扁平状或近圆柱形,表面光滑,有强烈漆状光泽,红褐色。皮层细胞棍棒状,顶端略粗于底部,亮黄色,厚壁至亚实心,顶端或侧面偶有分枝或突起,在成熟的担子果中皮层细胞通常有中度至强烈的淀粉质反应。担孢子卵圆形,大小为 (8.0~11.0) μm × (5.5~7.5)μm,脐状突起不明显,黄褐色,有淀粉质反应,双层壁,外壁平滑,内壁表面有中度粗糙的点状纹饰,未见担子和拟担子。
2.2 多基因分子系统发育分析结果
用于进行系统发育分析的灵芝属样品信息详见表1。
如表1所示,Lz-124为试验菌株采集号,本研究中共获得ITS、TEF-α和RPB2三个片段。从GenBank中选择了16个物种的序列(30条ITS序列,20条TEF-α序列和16条RPB2序列),选用Tomophagus colossus作为系统发育树的外群。基于ITS、TEF1-α、RPB2序列构建最大似然 (Maximum Likelihood,ML) 分析灵芝属系统发育树,详见图2。
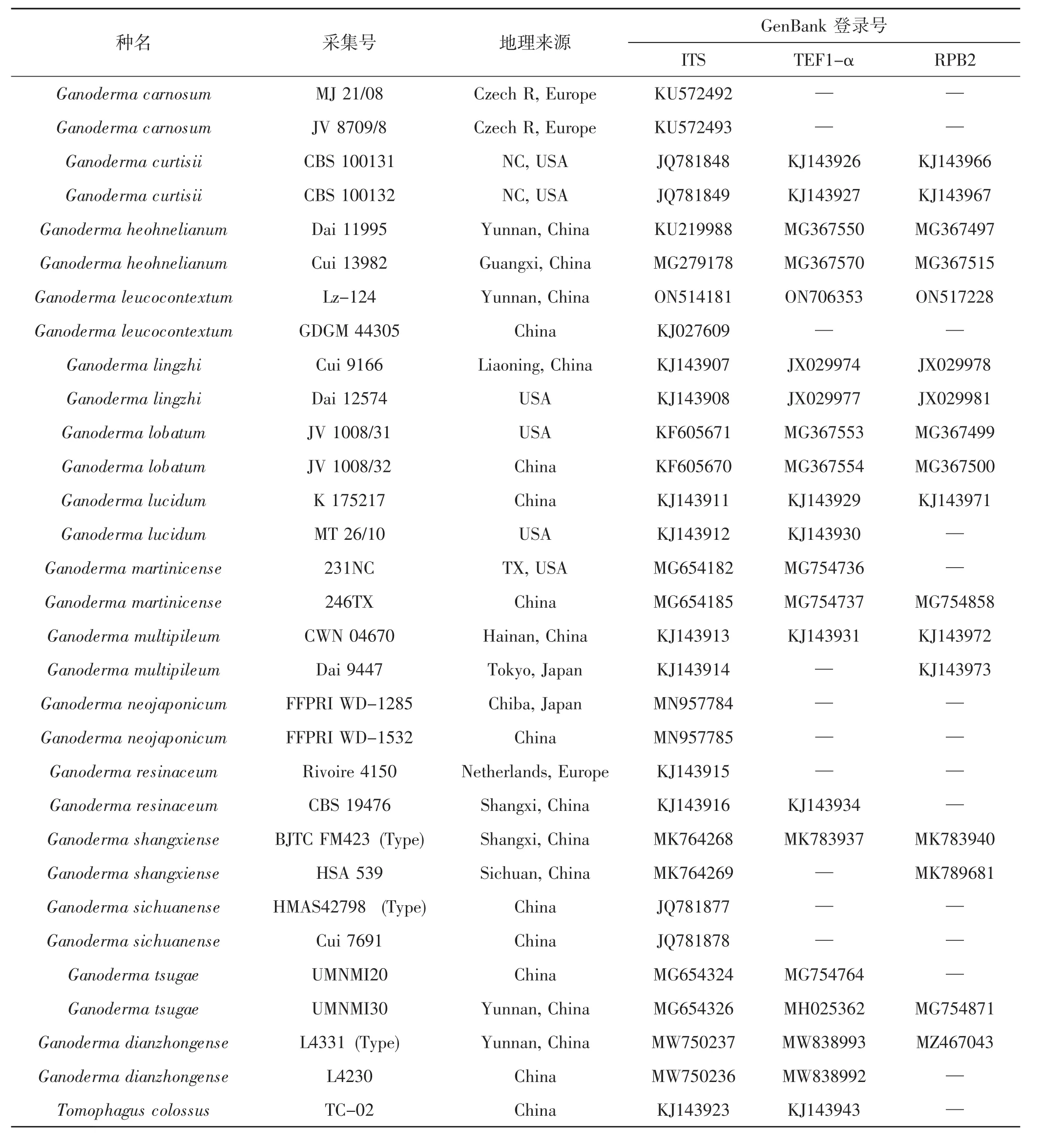
表1 研究采用的物种、标本、地理来源和GenBank登录号Tab.1 Species,specimens,geographical origin and GenBank accession numbers used in the study
如图2所示,试验菌株Lz-124在系统发育中与已报道的白肉灵芝聚为一支[15],支持率为80%。同时结合形态学特征,确定试验中所采集的野生灵芝为白肉灵芝。

图2 基于ITS、TEF1-α、RPB2序列最大似然(ML)分析灵芝属系统发育树Fig.2 Phylogenetic tree of Ganoderma based on Maximum likelihood(ML)analysis of combined ITS、TEF1-α and RPB2 sequence
2.3 单因素试验结果
2.3.1 碳源对菌丝生长速度的影响
不同碳源对菌丝生长速度及形态的影响结果见图3。
由图3可知,葡萄糖作为碳源时菌丝最为洁白和浓密,生长速度最快为(7.28±0.17) mm·d-1,与麦芽糖、蔗糖和CK1不存在显著性差异。乳糖作为碳源时菌丝生长速度最慢,为(4.18±0.37) mm·d-1与可溶性淀粉不存在显著性差异,且菌丝生长较其他碳源条件更洁白和浓密。
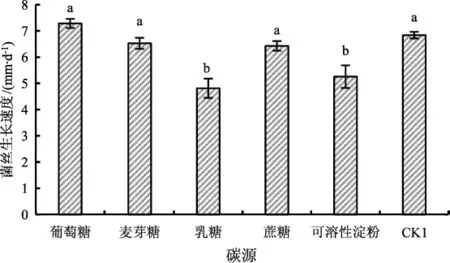
注:不同小写字母表示差异显著(P<0.05)。Note:Different lowercase letters indicate significant differences(P<0.05).
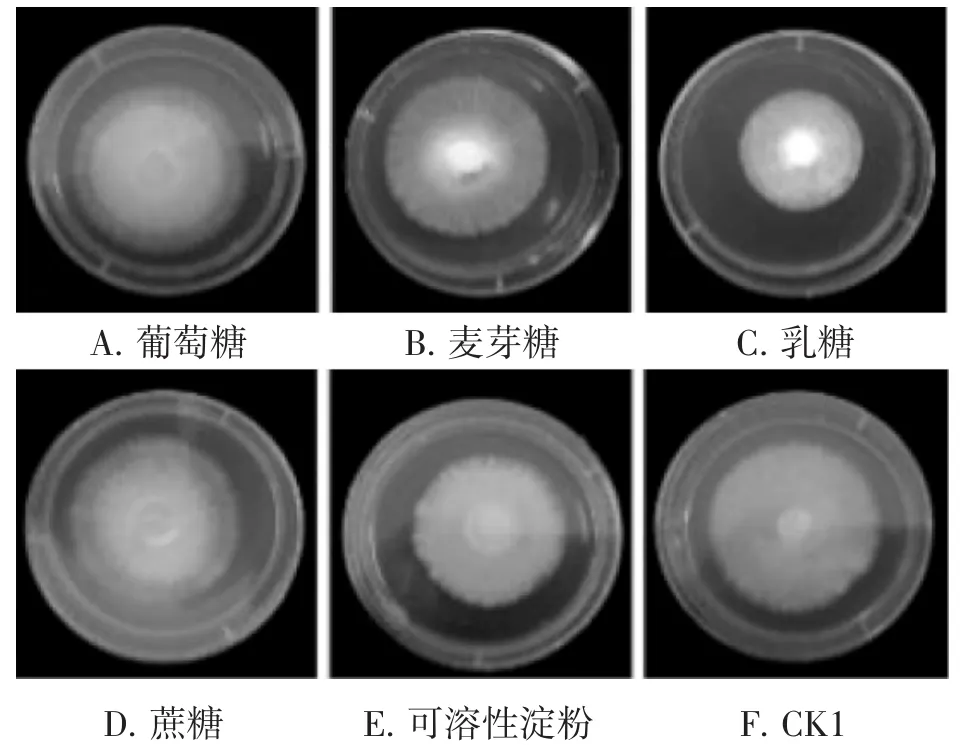
图3 不同碳源条件下菌丝生长速度及形态图Fig.3 Growth rate and morphology of mycelia under different carbon source conditions
2.3.2 氮源对菌丝生长速度的影响
不同氮源对菌丝生长速度及形态的影响结果见图4。
由图4可知,酵母粉作为氮源时菌丝最为洁白和浓密,生长速度最快,为(7.77±0.49) mm·d-1,与氯化铵、蛋白胨和CK2相比没有显著性差异。尿素作为氮源时菌丝生长速度最慢,为(1.60±0.40)mm·d-1,与其他氮源条件存在显著性差异。

注:不同小写字母表示差异显著(P<0.05)。Note:Different lowercase letters indicate significant differences(P<0.05).
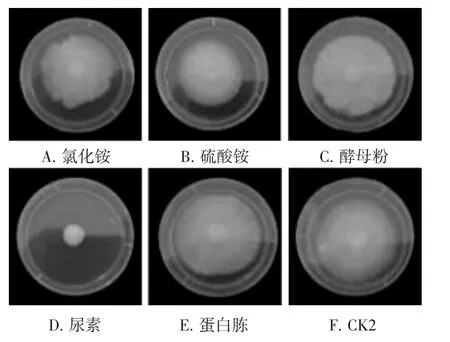
图4 不同氮源条件下菌丝生长速度及形态图Fig.4 Growth rate and morphology of mycelia under different nitrogen source conditions
2.3.3 无机盐对菌丝生长速度的影响
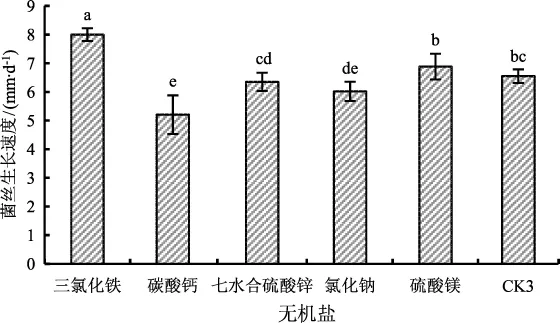
不同无机盐对菌丝生长的影响结果见图5。
由图5可知,三氯化铁作为无机盐时菌丝较为洁白,但浓密程度略低于其余条件,生长速度最快为(8.00±0.22) mm·d-1,与其余无机盐存在显著性差异。碳酸钙为无机盐时菌丝生长速度最慢,为(5.21±0.67) mm·d-1,与氯化钠作为无机盐不存在显著性差异,碳酸钙和氯化钠作为无机盐时,菌丝最为浓密,但生长速度较慢。
注:不同小写字母表示差异显著(P<0.05)。Note:Different lowercase letters indicate significant differences(P<0.05).
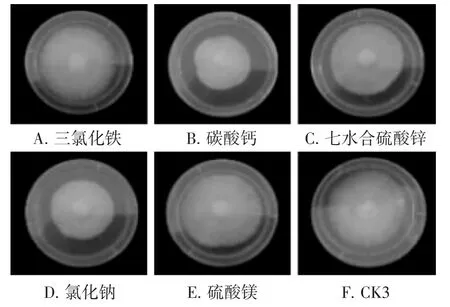
图5 不同无机盐条件下菌丝生长速度及形态图Fig.5 Growth rate and morphology of mycelia under different inorganic salt conditions
2.3.4 温度对菌丝生长速度的影响
不同温度对菌丝生长速度及形态的影响结果见图6。
由图6可知,温度为26℃时,白肉灵芝菌株Lz-124的菌丝最为洁白且浓密;生长速度最快为(7.28±0.21) mm·d-1,与温度为24℃时不存在显著性差异。当温度为28℃时,菌丝生长速度最慢,为(4.17±0.22) mm·d-1,与其余温度条件存在显著性差异。

注:不同小写字母表示差异显著(P<0.05)。Note:Different lowercase letters indicate significant differences(P<0.05).

图6 不同温度条件下菌丝生长速度及形态图Fig.6 Growth rate and morphology of mycelia at different temperatures
2.3.5 pH对菌丝生长速度的影响
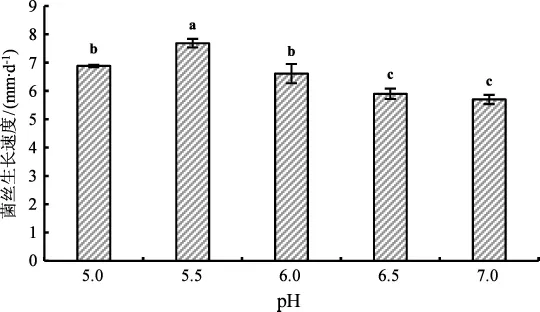
不同pH条件对菌丝生长速度及形态的影响结果见图7。
由图7可知,白肉灵芝菌株Lz-124在pH 5.5条件下培养时菌丝浓密程度略低于其余pH条件,但菌丝生长速度最快,为(7.68±0.15) mm·d-1,与其余pH条件存在显著性差异。pH为7.0时菌丝最为洁白且浓密,但生长速度最慢,为(5.70±0.16) mm·d-1,与pH为6.5时相比不存在显著性差异。
注:不同小写字母表示差异显著(P<0.05)。Note:Different lowercase letters indicate significant differences(P<0.05).

图7 不同pH条件下菌丝生长速度及形态图Fig.7 GrowthrateandmorphologyofmyceliaunderdifferentpHconditions
2.4 正交试验结果
结合以上单因素试验结果,从中挑选出较优的4个因素,从每个因素中选出较优的3个水平,采用L9(34)正交表进行4因素3水平正交试验,共计9组。4因素3水平表见表2。白肉灵芝菌丝生长的正交试验结果见表3。

表2 正交试验4因素3水平表Tab.2 The orthogonal test table of 4 factors and 3 levels
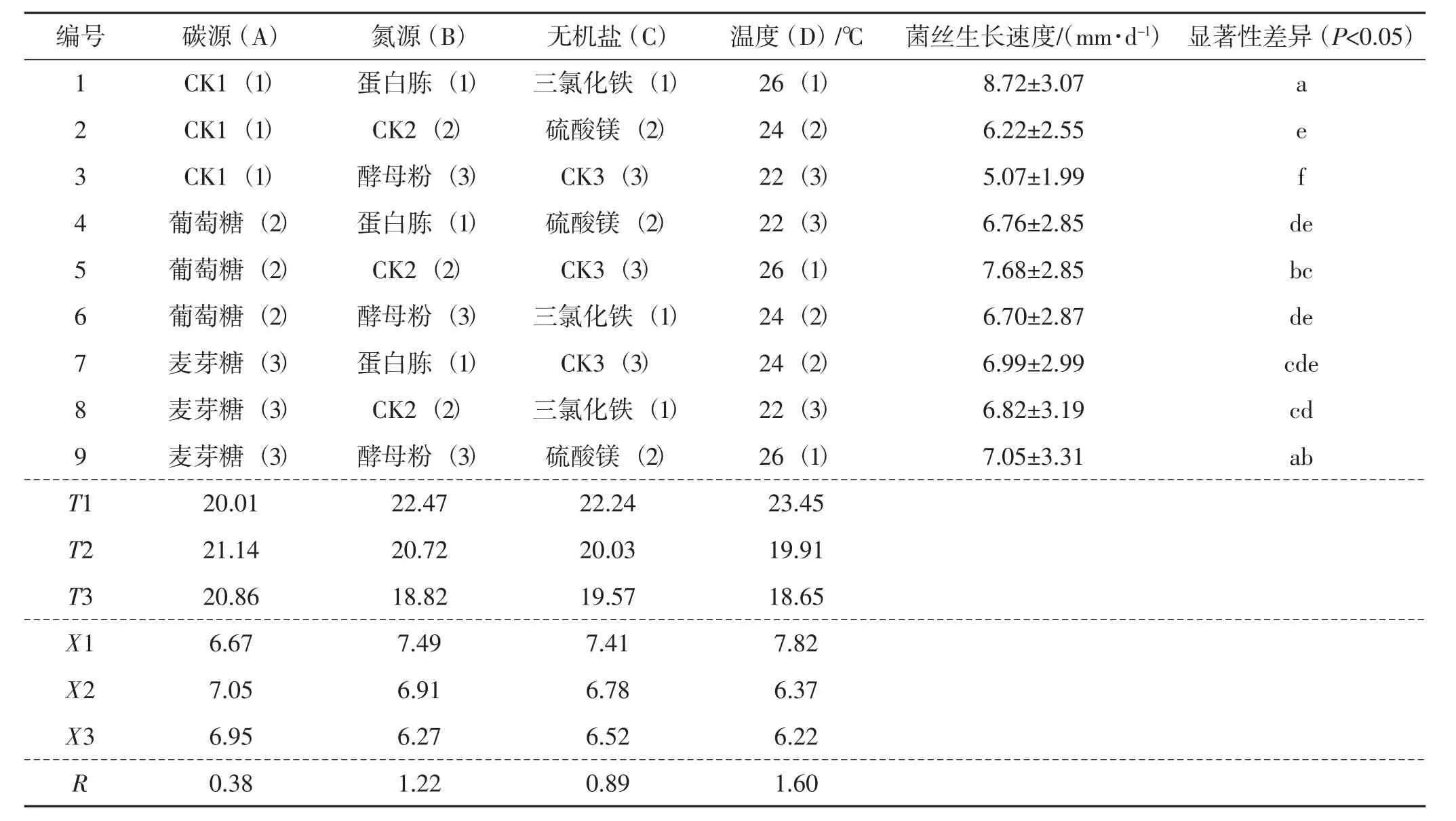
表3 白肉灵芝菌丝生长的正交试验结果的直观分析Tab.3 The results of direct-viewing analysis of mycelial growth of Ganoderma leucocontextum
如表3的正交分析结果可见,温度对菌丝生长速度的极差最大,R为1.60,其次是氮源、无机盐和碳源。结合X与R分析得出最佳配方为A2B1C1D1。
对正交试验结果进行方差分析,结果详见表4。

表4 白肉灵芝菌丝生长的正交试验结果方差分析Tab.4 The results of F-test of myelial growth of Ganoderma leucocontextum
如表4所示,温度的F值最大,其次是无机盐、氮源和碳源。因此4因素显著性差异由大到小依次是温度>无机盐>氮源>碳源。
2.5 驯化栽培试验结果
试验中白肉灵芝驯化栽培平均现蕾时间为25 d,分化时间为82 d,成熟期为116 d。
测量白肉灵芝子实体的农艺性状并计算生物学效率,结果详见表5。
由表5可知,云南白肉灵芝驯化栽培的子实体单朵鲜质量平均为(61.60±5.80) g,干质量平均为(24.80±5.50) g;菌盖直径平均为 (13.04±1.30) cm;菌柄长度平均为(7.06±1.63) cm,菌柄直径平均为(2.75±0.50) cm;平均生物学效率为(10.26±0.97)%。
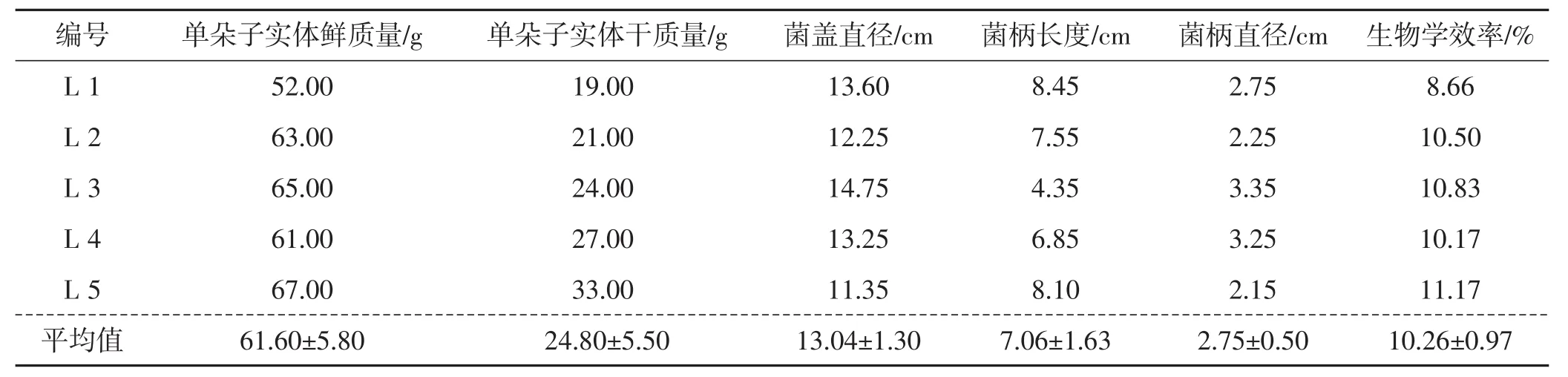
表5 白肉灵芝农艺性状和生物学效率Tab.5 Agronomic traits and biological efficiency of Ganoderma leucocontextum
记录白肉灵芝生长中的形态详见图8。

图8 白肉灵芝发育过程中不同形态Fig.8 Different forms of Ganoderma leucocontextum during development
由图8可知,驯化栽培的白肉灵芝菌盖呈现不规则扇形,表面具有光泽,菌盖中部颜色呈深棕褐色向外颜色逐渐变浅,菌盖边缘呈黄乳白色,表面具有同心沟纹,菌柄为单支或多分支。
2.6 活性成分测定结果
白肉灵芝活性成分含量测定结果详见表6。
如表6所示,在白肉灵芝子实体中共检测出18种氨基酸,总氨基酸含量为17.24%,必需氨基酸含量为6.81%,组氨酸含量最高为2.81%;蛋白质含量为17.20%;硒含量为0.06 mg·kg-1;脂肪含量为2.40%;灵芝多糖含量为1.51%,三萜含量为3.21%,灵芝酸含量为 11.20 mg·100-1g-1。

表6 白肉灵芝活性成分Tab.6 Active ingredient of Ganoderma leucocontextum
3 讨论
基于ITS、TEF1-α和RPB2序列,采用最大似然法对供试样品进行系统发育分析,结合形态学特征,将样品鉴定为白肉灵芝Ganoderma leucocotextum。
通过开展碳源、氮源、无机盐、温度、pH单因素试验,得出最适条件为无碳源、氮源为酵母粉、无机盐为三氯化铁、温度为26℃,pH为5.5。该结果与其他灵芝最适固体培养条件相比存在一定的差异,详见表7。
如表7所示,在碳源方面,葡萄糖、麦芽糖、蔗糖和CK1作为碳源时,菌丝生长速度没有显著性差异,表明白肉灵芝对碳源的吸收较为广泛,最适碳源有待进一步探索。报道的白肉灵芝、有柄灵芝(Ganoderma gibbosum)、赤芝、树舌灵芝(Ganoderma applanatum)和灵芝在乳糖作为碳源的情况下生长速度均最慢,与本研究中结果一致[34-38]。整体来看,不同灵芝品种菌丝固体培养对于复合碳源的吸收优于单一碳源。在氮源方面,白肉灵芝最适氮源为酵母粉,与树舌灵芝和韦伯灵芝试验结果相一致,综合比较发现不同灵芝品种对有机氮的吸收均优于无机氮[37,40]。在无机盐方面,三氯化铁条件下菌丝生长最好。在温度方面,固体培养最适温度为26℃,与莫伟鹏等[34]研究的白肉灵芝最适温度相近。很多栽培灵芝属于高温型食(药)用菌,最适生长发育温度为25℃~30℃;而白肉灵芝最适生长发育温度为22℃~26℃,明显低于普通灵芝品种,属于中低温型物种[35-40]。在pH方面,最适pH为5.5,与莫伟鹏等[34]研究的白肉灵芝最适pH为3.0有差异,大多数灵芝最适pH为6.0~7.0之间,可见白肉灵芝较其他灵芝更适宜在酸性条件生长。

表7 白肉灵芝与其他灵芝属真菌菌丝培养特性对比Tab.7 Comparison of mycelial culture characteristics between Ganoderma leucocontextum and other Ganoderma spp.
结合正交试验结果,发现不同单因素对菌丝生长速度影响由大到小依次是温度>无机盐>氮源>碳源;最佳培养组合为葡萄糖、蛋白胨、三氯化铁、26℃。四川灵芝(Ganoderma sichuanense) 不同单因素影响排序为碳源>氮源>pH>无机盐[41],与本研究存在较大差异,表明不同单因素对不同灵芝物种菌丝生长的影响存在差异。
为进一步明确云南白肉灵芝的农艺性状,开展了驯化栽培试验。采用袋料覆土栽培成功驯化白肉灵芝,白肉灵芝单朵干质量为(24.80±5.50) g。姚春馨等[42]研究的“云白灵芝2号”平均产量为干品38 g/袋,单朵干质量略高于本研究中结果。胡惠萍等[43]研究的西藏白肉灵芝单朵干质量为(12.40±1.13) g,单朵干质量略低于本研究白肉灵芝。目前广泛栽培的赤芝[44]单朵平均干质量为25.91 g,紫芝[45]单朵鲜质量为(237.50±10.33)g,云南白肉灵芝子实体质量优于赤芝,但与紫芝子实体质量相比存在一定差距。目前,针对白肉灵芝农艺性状的研究大多仅包括出菇产量及周期,但其余农艺性状的相关研究较少,有待进一步深入分析。
对驯化栽培的白肉灵芝子实体进行活性成分检测。白肉灵芝含有7种人体必需氨基酸,同时还含有蛋白质、多糖、脂肪、三萜、微量元素、灵芝酸等物质。与不同灵芝活性成分对比情况详见表8。
如表8所示,试验中的白肉灵芝总氨基酸、蛋白质、脂肪、多糖、三萜均优于紫芝和赤芝[46-47]。与潘俊等[48]研究的白肉灵芝进行对比,本研究白肉灵芝总氨基酸、总三萜含量显著较高,其余活性成分差异较小。

表8 白肉灵芝与其他灵芝属真菌子实体活性成分对比Tab.8 Comparison of active components of fruiting bodies of Ganoderma leucocontextum and other Ganoderma spp.
综合上述结果表明,云南白肉灵芝生物学效率高,含有大量的活性物质,因此云南白肉灵芝具有巨大的市场潜力和开发价值。
