基于响应面的蛹虫草菌质固体发酵工艺条件优化*
2022-12-21黄美霞魏林婕吴水生
熊 薇,黄美霞,魏林婕,吴水生
(福建中医药大学 药学院,福建 福州 350122)
蛹虫草(Cordyceps militaris Link)又名北冬虫夏草、北虫草,属真菌界(Fungi)子囊菌门(Ascomycota) 子囊菌纲(Ascomycetes) 肉座菌目(Hypocreales) 麦角菌科 (Clavicipitaceae) 虫草属 (Cordyceps)模式种[1]。蛹虫草具有与冬虫夏草相似的活性成分,包括虫草多糖、虫草酸、虫草素、氨基酸、超氧化物歧化酶SOD(superoxide dismutase) 等,而且相比于冬虫夏草,蛹虫草价格更亲民,因此被用作冬虫夏草的替代品进行开发利用[2]。近年来,关于蛹虫草子实体产量优化和活性成分含量优化方面的研究已获得一些成果,但这些研究的重点都聚焦于子实体[3]。菌质是指包含菌丝和培养基质的复合固体发酵产物。有报道指出,固体发酵的蛹虫草残基中也含有虫草多糖、虫草素、SOD、多肽等有效成分[4]。因此试验直接以菌质为研究对象,对其发酵条件进行优化,以期缩短发酵周期,提高有效成分含量,有效节约成本。
虫草素最早于1951年由德国科学家Cunningham等[5]从蛹虫草菌丝体液体发酵培养基中分离得到,又称3’-脱氧核苷 (3-deoxyadenosine),具有抗炎、抗肿瘤、免疫调节、抗焦虑、降血糖、降血脂等药理作用[6]。虫草素在蛹虫草中的含量甚至高于冬虫夏草[7],因此试验以虫草素含量为评价指标,对菌质发酵时间和培养条件进行优化,为后期发酵菌质的开发利用奠定基础。
1 材料与方法
1.1 材料与试剂
蛹虫草菌株MF43,由福建农林大学傅俊生课题组惠赠。
小麦和土豆均为市购;虫草素(批号N1017AS,质量分数≥98%),大连美仑生物技术有限公司;腺苷(批号N24D11W135689,质量分数≥99%)、蔗糖(批号A25GS146834,质量分数≥98%)、麦芽糖(批号A02GS143905,质量分数≥95%)、黄豆粉(批号S24F12H139852,粉质粗细为80目~120目)、可溶性淀粉(批号A16GS145576)、维生素B1(批号D16N11S131243,质量分数≥98%),上海源叶生物科技有限公司;酵母粉(批号2846115-02)、蛋白胨(批号2896804),OXOID公司;发酵用蚕蛹粉(水溶性,批号430H031),北京索莱宝科技有限公司;无水葡萄糖(批号20141008)、磷酸二氢钾(批号20200915)、无水硫酸镁(批号20140122),国药集团化学试剂有限公司;甲醇(批号I1140207111,质量分数≤100%),默克股份两合公司。
1.2 仪器
TDL-40B离心机,上海安亭科学仪器厂;全自动超声波清洗机,湖北鼎泰恒胜科技设备有限公司;LC-20AT高效液相色谱仪,日本岛津;DHG-9240电热恒温鼓风干燥箱,上海精宏实验设备有限公司;HPX-300BSH-III恒温恒湿箱,上海新苗医疗器械制造有限公司;MGC-300H人工气候箱,上海一恒科学仪器有限公司;ClassⅡType A2型生物安全柜,北京东联哈尔仪器制造有限公司;ZHWY-2112B全温型大容量恒温振荡器,上海智城分析仪器制造有限公司。
1.3 菌悬液制备
从PDA斜面培养基中挑出0.5 cm×0.5 cm大小的母种菌块,接种到PDA平板培养基上,培养至菌丝长满培养皿备用。取0.5 cm×0.5 cm大小的菌块接种到PD培养基中,在23℃、140 r·min-1条件下培养4 d~7 d,制成液体菌种。取5 mL液体菌种,加入30 mL无菌水混匀,制成菌悬液。
1.4 固体发酵培养基质制备
称取15 g小麦置于240 mL培养罐中(以下试验均采用该规格培养罐),用蒸馏水浸泡1 h后滤去水分。按1.0∶1.2的比例加入营养液(每升营养液的配方为:葡萄糖20 g、蛋白胨10 g、KH2PO41 g、MgSO40.5 g、VB 10.5 g),用聚丙烯透气盖封口,121℃灭菌30 min。在培养罐中接入3 mL菌悬液;在温度为18℃、相对湿度为60%、黑暗条件下培养至菌丝长满培养基;转移到光照培养箱中,在温度为20℃、相对湿度为80%~90%、光照时间为10 h~12 h条件下培养至第15天取出干燥。
1.5 虫草素含量测定
1.5.1 样品制备
取发酵15 d的菌质,60℃烘干,粉碎。准确称取粉末1.0 g,加20 mL超纯水进行超声提取。提取时间为45 min,提取温度为45℃。抽滤后,取滤液1 mL加入甲醇定容至5 mL,静置,过0.22微孔滤膜后得到待测液。
1.5.2 标准品制备
精密称取虫草素1 mg置于10 mL容量瓶中,加80%甲醇溶解并定容,制成标准品贮备液。
1.5.3 高效液相色谱(HPLC)方法学建立
色谱条件:色谱柱型号为Welch Ultimate XBC18柱(4.6×150 mm,粒径为5 μm);流动相为V(甲醇) ∶V (水) =16∶84,流速为 1 mL·min-1,检测波长为260 nm,进样量为5 μL,温度为30℃。取标准品贮备液,稀释虫草素质量浓度分别为2 μg·mL-1、4 μg·mL-1、6 μg·mL-1、8 μg·mL-1、10 μg·mL-1、12 μg·mL-1、14 μg·mL-1、16 μg·mL-1、18 μg·mL-1、20 μg·mL-1,按上述色谱条件进行测定,记录峰面积。以虫草素标准品质量浓度为横坐标,以色谱峰面积为纵坐标,绘制得到标准曲线。
1.5.4 HPLC方法学验证
1) 精密度试验:取对照品 4 μg·mL-1、8 μg·mL-1和16 μg·mL-13个质量浓度溶液,按上述色谱条件每个质量浓度溶液连续测定3次,记录峰面积。
2)重复性试验:供试品溶液各取6份,按上述色谱条件每份连续测定3次,计算含量。
3) 稳定性试验:同一批样品取3份,制备溶液,分别于0、2 h、4 h、6 h、12 h、24 h、48 h进样,测定虫草素峰面积。
1.6 单因素试验筛选
1.6.1 碳源单因素试验
以1.4中的营养液为基础,其他成分不变,分别用蔗糖、麦芽糖、可溶性淀粉替换葡萄糖作为碳源进行发酵培养,以虫草素含量为检测标准,筛选最适碳源。
1.6.2 氮源单因素试验
以1.4中的营养液为基础,其他成分不变,分别用蚕蛹粉、酵母粉、黄豆粉替换蛋白胨作为氮源进行发酵培养,以虫草素含量为检测标准,以确定最适氮源。
1.6.3 料液比单因素试验
使用1.4中的发酵培养基和营养液,设置不同料液比 (1.0∶1.0、1.0∶1.1、1.0∶1.2、1.0∶1.3、1.0∶1.4)进行培养,以虫草素含量为检测标准,选择最适料液比。
1.6.4 小麦装料量单因素试验
使用1.4中的发酵培养基和营养液,将小麦装料量设置为9 g、12 g、15 g、18 g和21 g进行培养,以虫草素含量为检测标准,确定最合适的小麦装料量。
1.6.5 接种量单因素试验
使用1.4中的发酵培养基和营养液,将菌悬液接种量设置为1 mL、2 mL、3 mL、4 mL、5 mL进行培养,以虫草素含量为检测标准,以确定最合适的接种量。
1.6.6 培养时间单因素试验
使用1.4中的发酵培养基和营养液,培养时间分别为 0、5 d、9 d、11 d、13 d、15 d、17 d、19 d、21 d、23 d、25 d、27 d、29 d、31 d、33 d、35 d、37 d、39 d、41 d、43 d、45 d、47 d、49 d时取样,以虫草素含量为检测标准,以明确虫草素含量最高的时间。
1.6.7 腺苷质量浓度单因素试验
使用1.4中的发酵培养基和营养液,在营养液中加入质量浓度分别为 6 g·L-1、12 g·L-1、24 g·L-1、48 g·L-1、96 g·L-1的腺苷,以虫草素含量为检测标准,以确定最合适的腺苷质量浓度。
1.7 响应面优化
在单因素筛选结果的基础上,进行3因素3水平响应面法优化。以上每个试验重复3次。
根据单因素试验结果,设置碳源为可溶性淀粉、氮源为黄豆粉、小麦装料量为15g、培养时间为17d为固定条件,选择料液比、接种量、腺苷质量浓度3个因素进行响应面优化试验,试验因素及水平设计见表1。

表1 响应面试验因素水平表Tab.1 Response surface experiment factor level table
1.8 数据分析
采用SPSS 26软件进行数据差异显著性分析。差异显著水平为P<0.05。
2 结果与分析
2.1 标准品图谱与样品图谱
以虫草素标准品及样品浓度为横坐标,以对应色谱峰面积为纵坐标,绘制得到曲线详见图1。
如图1所示,供试品溶液色谱图中虫草素的保留时间与标准品溶液色谱图一致,说明样品中含有虫草素这一成分。

图1 标准品(A) 与样品(B) HPLC分析Fig.1 HPLC analysis of standard (A)and sample (B)
2.2 方法学考察
2.2.1 线性关系考察
利用HPLC在1.5.3色谱条件下对不同浓度标准品溶液进行测定,以峰面积(Y)对各质量浓度(X)进行线性回归,得虫草素标准液线性回归方程为:
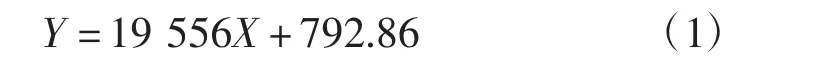
该回归方程的相关系数R2为0.999。
结果表明,虫草素的质量浓度在2 μg·mL-1~20 μg·mL-1范围内线性关系良好。
2.2.2 精密度试验结果
对标准品进行精密度试验,测得虫草素峰面积的相对标准偏差RSD(relative standard deviation) 为0.54%,表明仪器精密度良好,符合试验要求。
2.2.3 重复性试验结果
对样品进行重复性试验,测得蛹虫草菌质中虫草素峰面积的RSD为0.85%,表明方法的重复性良好,符合试验要求。
2.2.4 稳定性试验结果
对样品进行稳定性试验,测得蛹虫草菌质中虫草素峰面积的RSD为1.60%,表明供试品溶液中虫草素在48 h内稳定。
2.3 单因素试验结果
2.3.1 碳源筛选
使用不同碳源进行发酵培养,以葡萄糖组为对照,分析不同碳源对菌质中虫草素含量的影响,详见图2。
根据图2结果可知,不同碳源对菌质虫草素含量影响显著(P<0.05)。其中碳源为可溶性淀粉时,菌质中虫草素含量最高,达0.98 mg·g-1。因此选择可溶性淀粉作为后续试验的碳源。
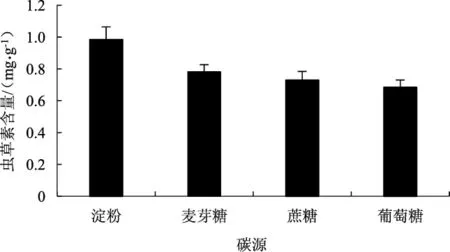
图2 碳源对菌质虫草素含量的影响Fig.2 Effect of carbon source on the content of fungal substance
2.3.2 氮源筛选
以蛋白胨组为对照,分析不同氮源对菌质中虫草素含量的影响情况,详见图3。

图3 氮源对菌质虫草素含量的影响Fig.3 Effects of nitrogen sources on the content of fungal substance
根据图3结果可知,不同氮源对菌质虫草素含量影响显著(P<0.05)。当氮源为黄豆粉时,菌质中虫草素含量最高,达1 mg·g-1;当氮源为酵母粉时,菌质中虫草素含量最低。因此选择黄豆粉作为后续试验的氮源。
2.3.3 料液比筛选
以料液比为1.0∶1.2组为对照,不同料液比对菌质中虫草素含量的影响情况,详见图4。

图4 料液比对菌质虫草素含量的影响Fig.4 Effect of solid-liquid ratio on the content of fungal substance
根据图4结果可知,不同料液比对菌质虫草素含量也具有一定影响(P<0.05),可作为响应面考察因素。当料液比为1.0∶1.2时,菌质虫草素含量最高,达0.68 mg·g-1,因此选择料液比1.0∶1.2进行后续试验。
2.3.4 小麦装料量筛选
以小麦装料量为15 g组为对照,不同小麦装料量对菌质虫草素含量的影响情况,详见图5。
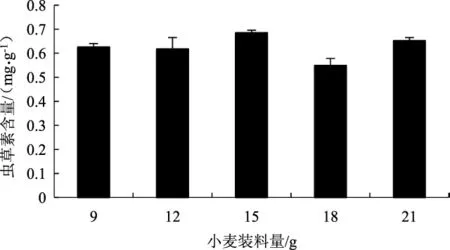
图5 小麦装料量对菌质虫草素含量的影响Fig.5 Effect of wheat charge amount on the content of fungal substance
根据图5结果可知,不同小麦装料量对菌质虫草素含量有影响(P<0.05)。当小麦装料量为15 g时,菌质中虫草素含量最高,达0.68 mg·g-1;当小麦装料量为18 g时,菌质虫草素含量有所降低;当小麦装料量增加到21 g时含量又有所提高,然而并未超过15 g时的虫草素含量。因此,从经济适用角度考虑,以小麦装料量为15 g进行后续试验较为合理。
2.3.5 接种量筛选
以接入3 mL菌悬液组为对照,不同菌悬液接种量对菌质虫草素含量的影响情况,详见图6。
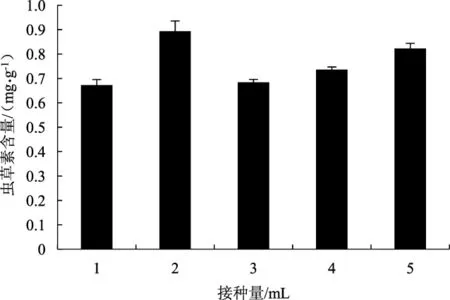
图6 接种量对菌质虫草素含量的影响Fig.6 The effect of inoculum amount on the content of fungal substance
根据图6结果可知,菌悬液接种量对菌质中虫草素含量影响显著(P<0.05)。当接种量为2 mL时,菌质虫草素含量最高,达0.89 mg·g-1;当接种量为3 mL时,菌质虫草素含量降低;而后虫草素含量随接种量的增加而增加,但均未超过2 mL时的含量。因此,从经济适用角度考虑,选择接种量为2 mL进行后续试验较为合理。由于接种量在1 mL~3 mL时差异显著,因此可将此因素选作响应面考察因素。
2.3.6 培养时间筛选
不同培养时间对菌质中虫草素含量的影响情况详见图7。
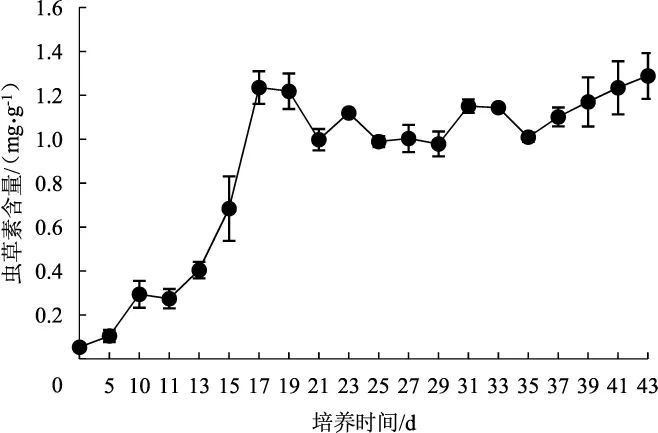
图7 培养时间对菌质虫草素含量的影响Fig.7 The effect of culture time on the content of fungal substance
根据图7结果可知,培养时间对菌质中虫草素含量影响显著(P<0.05),虫草素含量先随培养时间的增加而增加,到临界点后数值维持相对稳定的状态。0~5 d时,是菌丝长满培养基的阶段,生长较缓慢,因此虫草素积累也较缓慢;10 d左右菌丝长满,且由黑暗培养转为光照培养,培养基中虫草素的含量随着培养时间延长快速积累;在17 d时达到峰值,而后增长缓慢。这一现象与Wen[8]和胡龙[9]的报道相似,说明培养基中虫草素累积到一定量后,延长培养时间对其含量影响不大。
2.3.7 腺苷质量浓度筛选
添加不同质量浓度的腺苷对菌质中虫草素含量的影响情况详见表8。
根据图8结果可知,腺苷对菌质中虫草素含量影响显著(P<0.05),可作为响应面考察因素。腺苷是虫草素的前体化合物,添加腺苷有助于虫草素的积累。当腺苷质量浓度达到48 g·L-1时,菌质中虫草素积累最多,达到4.06 mg·g-1;与不添加腺苷的相比,虫草素含量增加了4.97倍。

图8 腺苷质量浓度对菌质虫草素含量的影响Fig.8 Effects of adenosine mass concentration on substance content in mycoplasma
2.4 响应面试验结果
根据试验设计方案,选取料液比、接种量、腺苷质量浓度作为自变量,以虫草素含量作为响应面值设计响应面试验,结果见表2。
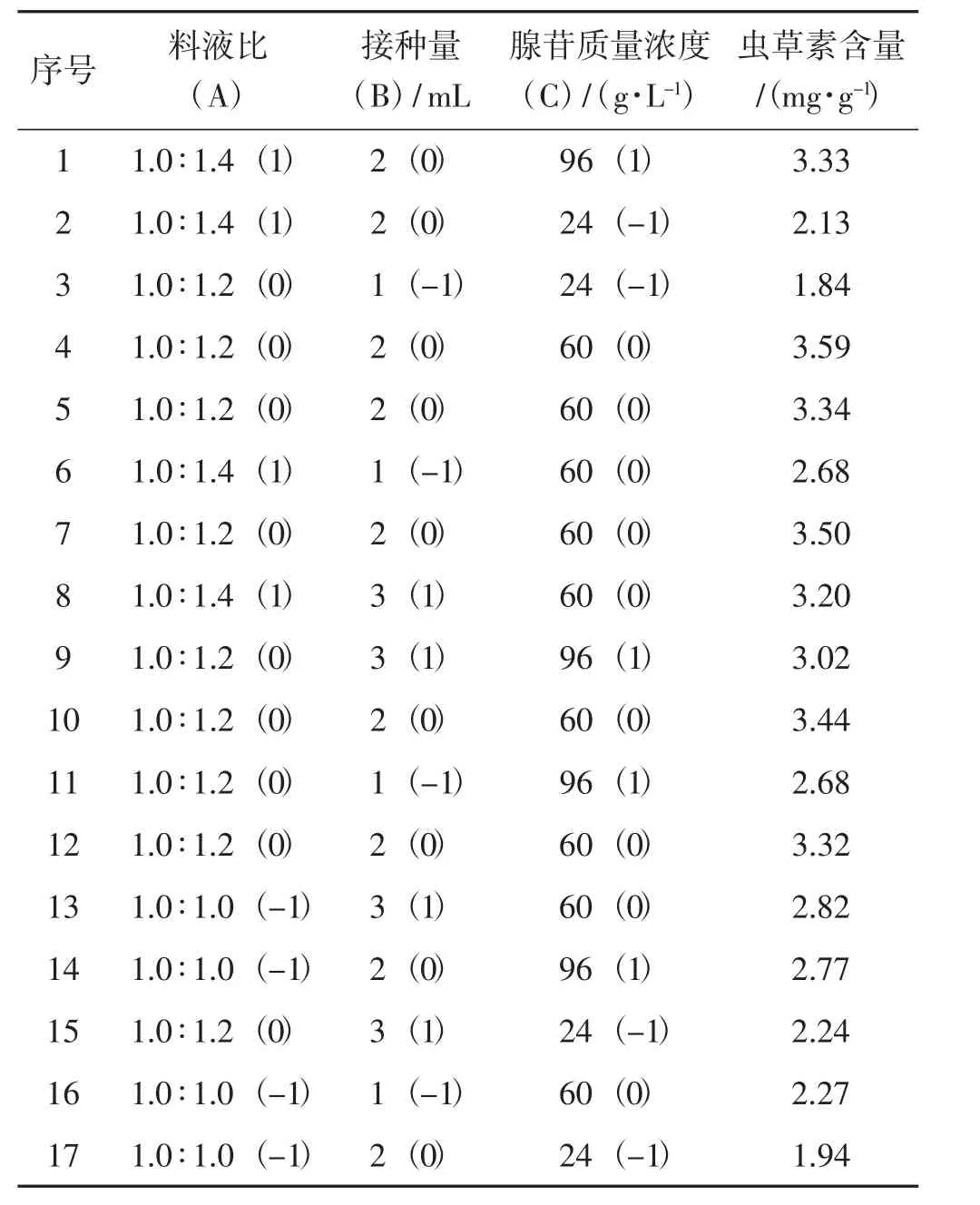
表2 响应面试验结果Tab.2 Results of response surface experiment
根据表2响应面试验结果,采用Design-Expert 10.0.7对数据进行回归分析,得到蛹虫草菌质虫草素含量(Y) 与料液比(A)、接种量(B)、腺苷浓度(C)的二次项多元回归方程为:

该回归方程相关系数R2为0.983 9。
对上述方程进行方差分析,结果见表3。
从表3结果可知,该回归模型极显著(P<0.0001),失拟项不显著(P>0.05),说明该模型成立。相关系数R2为0.983 9,说明模型拟合程度较好。R2Adj为0.963 2,R2Pre为0.879 9,二者差值小于0.2,说明试验误差小,方法可靠。模型中变量A、B、C、A2、B2、C2的P值均小于0.01,各因素对虫草素含量的影响依次为C>B>A。

表3 试验结果方差分析Tab.3 Analysis of variance of experimental results
2.4.1 响应面图形分析
依据拟合的响应曲面形状,研究不同料液比、接种量、腺苷质量浓度对虫草素含量的影响。分别将料液比、接种量、腺苷质量浓度以0水平固定在模型中,从而获得另外2个因素的交互影响结果。二次回归方程的响应面及其等高线见图9~图11。
由图9~图 11可知,料液比 (A) 与接种量(B)、料液比(A) 与腺苷质量浓度(C)、接种量(B)与腺苷质量浓度(C) 之间均对虫草素含量变化有一定交互作用,但作用不显著。

图9 料液比与接种量交互作用的等高线与响应面Fig.9 Contour line and response surface of interaction between solid-liquid ratio and inoculum amount
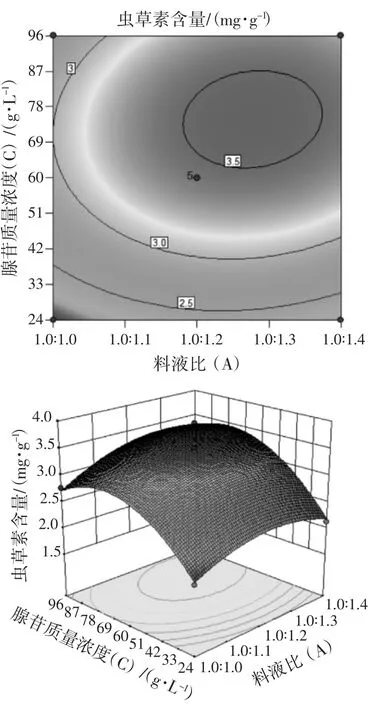
图10 料液比与腺苷质量浓度交互作用的等高线与响应面Fig.10 Contours and response surfaces of the interaction of solid-liquid ratio and adenosines mass concentration
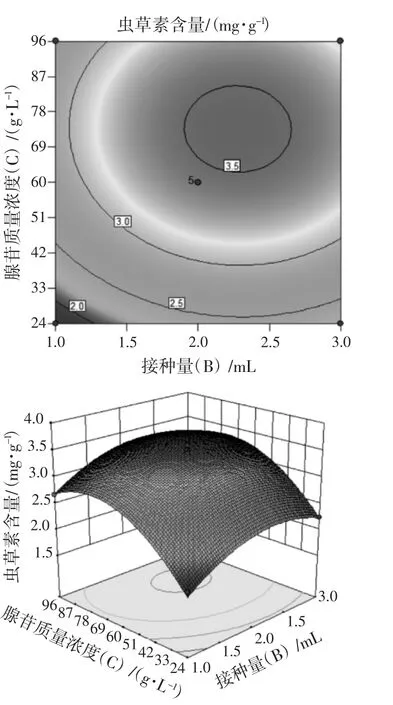
图11 接种量与腺苷质量浓度交互作用的等高线与响应面Fig.11 Contours and response surfaces of the interaction between inoculum amount and adenosine mass concentration
2.4.2 最佳条件的预测及验证试验
通过Design-Expert 10.0.7软件,预测虫草素含量最高的发酵工艺条件为:料液比为1.000∶1.295、接种量为2.257 mL、腺苷质量浓度为75.534 g·L-1,此时虫草素含量为3.596 mg·g-1。结合实际操作情况,将最佳发酵工艺修正为:料液比为1.0∶1.3、接种量为2 mL、腺苷质量浓度为76 g·L-1,在此条件下重复5次,得到虫草素含量平均为3.718 mg·g-1,与预测值相对误差小于5%。表明该方程与实际情况拟合良好,相应优化模型真实可行,与优化前相比,虫草素含量提高了4.47倍,具有指导生产的实用价值。
3 结论与讨论
在传统工序中,虫草素的主要来源是野生蛹虫草子实体,然而野生蛹虫草资源有限,因此多项研究对人工栽培蛹虫草进行了尝试。通过优化栽培基质和培养条件,提高子实体中虫草素含量,该方法虽然能够有效提高虫草素含量,但发酵时间较长。近年来有学者对菌质进行了检测,发现菌质中也含有虫草素。因此可以直接对菌质发酵条件进行优化,以缩短培养周期。
试验对发酵菌质的碳源、氮源、料液比、接种量、小麦装料量、培养时间、腺苷添加的质量浓度进行了单因素分析。结果发现,碳源为可溶性淀粉时,虫草素含量较高。这是由于淀粉是大分子碳源,菌丝体不易吸收,因此生长缓慢,给次级代谢产物虫草素的合成提供了足够的时间。当氮源为黄豆粉时,虫草素含量较高。这一现象提示植物蛋白也可作为氮源,促进菌丝体生长,且效果更佳。料液比、接种量、小麦装料量的结果揭示了菌丝的生长需要水分、一定的菌种量和基本营养物,但并不是越多越好。因为过多的水分和培养料会影响基质整体的透气性,从而影响菌丝体生长。接种后0~5 d,菌丝处于有丝分裂阶段,此时虫草素的积累较缓慢,处于较低水平;菌丝长满基质后,虫草素的积累量迅速增加,持续一段时间后处于相对稳定的水平。为缩短培养周期,在虫草素积累达到峰值时即可停止发酵。腺苷是合成虫草素的前体化合物,适量的增加腺苷有助于虫草素的合成。但试验中由于添加腺苷的质量浓度跨越较大,检测时发现存在大量腺苷质量未转化的现象,损耗较大。因此实际应用时需斟酌腺苷添加量。
将单因素筛选的结果用响应面法进行优化,发现料液比、接种量和腺苷质量浓度三者对虫草素含量的影响均显著,然而交互作用影响均不显著。这可能是由于腺苷质量浓度梯度过大,导致其对虫草素含量的影响与另外两个因素不在一个水平上。因此在后续试验中,可对该因素进行调整,确保增加虫草素积累的同时减少腺苷的损耗。
