组织激肽释放酶12对胰腺癌细胞增殖、迁移和侵袭的影响
2022-12-21胡丕波刘蒙蒙陈炯
胡丕波 刘蒙蒙 陈炯
1湖州市中心医院普外科,湖州 313000;2湖州市中心医院病理科,湖州 313000;3中国科学技术大学附属第一医院(安徽省立医院)普外科,合肥 230001
胰腺癌起病隐匿,进展迅速,被确诊后往往处于晚期阶段[1]。手术根治性切除仍然是目前胰腺癌最优先采用的治疗方式,但只有10%~20%的患者有根治性手术的机会,且5年生存率也仅为15%~25%[2],因此寻找胰腺癌的生物标志物来提高其早期诊断率尤为重要。组织激肽释放酶(kallikrein related peptidase, KLKs)属于蛋白水解酶的丝氨酸蛋白酶家族,共有15个成员(KLK1~KLK15),在多种肿瘤的发展进程中起作用,被认为是潜在的肿瘤标志物[3]。KLK12作为KLKs成员之一,在人体的多种肿瘤中异常表达,且与肿瘤的进展有关[4-5],但关于其在胰腺癌中的表达及作用少有报道。本研究检测KLKL12在胰腺癌组织及胰腺癌细胞株中的表达,探讨其作用机制及临床意义。
材料与方法
一、临床标本和胰腺癌细胞株
收集2014年2月至2018年10月间中国科学技术大学附属第一医院胆胰外科行根治性手术切除且病理确诊的95例胰腺癌患者的癌组织和匹配的癌旁正常胰腺组织(距离手术切缘>3 cm)。其中男性58例,女性37例,年龄43~78(60±11)岁,≤60岁者36例,>60岁者 59 例;肿瘤位于胰头部51例,胰体尾部44例;肿瘤高分化54例,中、低分化41例;参照第八版AJCC分期标准,Ⅰ+Ⅱ期73例,Ⅲ+Ⅳ期22例;神经浸润 50 例,淋巴结转移70例。所有患者术前均未接受放疗、化疗及免疫治疗。
正常胰腺腺泡细胞株HPDE6-C7和胰腺癌细胞株SW1990、PANC1购自中国科学院上海生命科学院细胞库。常规复苏、培养及传代。
二、方法
1.KLK12蛋白表达检测:取石蜡包埋的胰腺癌组织及相应的癌旁组织,常规脱蜡及抗原修复后,采用EnVision 法检测组织的KLK12蛋白表达。兔抗人KLK12一抗购自R&D system公司,工作浓度1∶200;山羊抗兔IgG二抗购自武汉三鹰生物公司,工作浓度1∶5 000;显色底物DAB购自北京中杉金桥公司。采用半定量法评分,阳性细胞数占总细胞数的0~10%计0分,11%~50%计2分,>50%计3分;细胞胞质未着色计0分,呈淡黄色计1分,黄色计2分,棕黄色计3分。两项分数乘积≤3分为低表达,>3分为高表达[6]。所有切片均由两名经验丰富的病理科医师独立评分,再共同协商一致。
分别收集对数生长期HPDE6-C7、SW1990和PANC1细胞,离心后加细胞裂解液置冰上充分裂解,离心取上清,加上样缓冲液,采用蛋白质免疫印迹法检测细胞KLK12蛋白表达,以β-actin为内参对照。抗KLK12一抗购自R&D system公司,工作浓度1∶500;辣根过氧化物酶标记的IgG购自武汉三鹰生物公司,工作浓度1∶10 000。ECL(美国Thermo公司)发光,X片曝光、显影、定影,Image J软件扫描条带的灰度值,以目的条带与内参条带的灰度值比表示目的蛋白表达量。
2.KLK12 mRNA表达检测:分别提取3株胰腺癌细胞总RNA,使用RNA逆转录试剂盒(美国Thermo公司)将其逆转录为cDNA,然后以cDNA作为模板进行扩增反应,采用荧光定量PCR法检测KLK12 mRNA的表达。KLK12正向引物序列为5′-GCCTCAACCTCTCCATCGTC-3′,反向引物序列为5′-CTTGAAGGACTCCCCCACAC-3′。以β-actin为内参,其正向引物序列为5′-GGGAAATCGTGCGTGACATTAAGG-3′,反向引物序列为5′-CAGGAAGGAAGGCTGGAAGAGTG-3′。95℃ 3 min,95℃ 10 s、60℃ 30 s,70℃ 30 s,共40个循环。由PCR仪自带软件获取Ct值,通过公式2-ΔΔCt计算mRNA相对表达量。
3.KLK12基因表达抑制及过表达的胰腺癌细胞株构建:携带靶向KLK12基因的siRNA质粒(siRNA-KLK12)及KLK12过表达质粒(KLK12-OE)由武汉淼灵生物公司制备。采用脂质体转染法将质粒转染到对数生长期的胰腺癌细胞,以未转染的胰腺癌细胞作为空白对照组(NC),以转染携带相应阴性对照质粒siRNA-NC、OE-NC的胰腺癌细胞作为阴性对照组。过表达载体质粒选用pCMV-3×FLAG,LipofectamineTM2000试剂盒购自赛默飞公司,按说明书操作。引物序列(5′-3′):siRNA-KLK12上游为AAACAGUGACAGCCACGUATT,下游为UACGUGGCUGUCACUGUUUGG;siRNA-NC上游为UUCUCCGAACGUGUCACGUTT,下游为ACGUGACAAGAATT;KLK12-OE上游为TGGCAGACAAAGAGACAAGAC,下游为GTTGAACGCTGCTGGTTACG;OE-NC上游为GCAAATGGGCGGTAGGCGTG,下游为TCGTTGGGCGGTCAGC。
4.细胞增殖实验:收集转染24~48 h的上述各组细胞,培养液重悬,调整细胞密度为2×104/ml,96孔板每孔加入100 μl细胞悬液,常规培养12、24、36、48、60、72 h,每组设置3个复孔。培养到时间点后每孔加入10 μl CCK8,继续培养4 h,上酶标仪测450 nm处的吸光值(A450值)。CCK8试剂盒购自上海贝博公司,按说明书操作。
5.细胞侵袭、迁移实验:分别收集并重悬转染后的各组细胞(5×105/ml))。Transwell小室上层加入200 μl细胞悬液,下层加入培养基,常规培养48 h,取出小室隔膜,用棉棒轻轻擦去隔膜上表面未穿膜细胞,甲醛固定隔膜20 min,结晶紫染色15 min,清洗后烘干,置显微镜下随机选择5个视野,计算穿膜细胞数,取均值。隔膜铺基质胶的小室做侵袭实验,隔膜未铺基质胶的小室做迁移实验,每个实验重复3次,取均值。
三、统计学处理
结 果
一、胰腺癌组织KLK12蛋白阳性表达率及其与临床病理特征的关系
KLK12蛋白主要定位于胞质,呈现棕黄色颗粒。95例胰腺癌组织中67例阳性,阳性率为70.5%;匹配的癌旁组织中28例阳性,阳性率为29.5%,胰腺癌组织KLK12阳性率显著高于癌旁组织,差异有统计学意义(χ2=23.01,P<0.001)。
胰腺癌组织KLK12的蛋白表达与肿瘤分化程度低(P=0.007)、TNM分期晚(P=0.001)和淋巴结转移(P=0.018)呈显著相关,而与年龄、性别、肿瘤位置、神经浸润等无相关性(表1)。

表1 胰腺癌组织KLK12表达与临床病理参数的相关性(例)
二、HPDE6-C7、SW1990、PANC1细胞KLKL12蛋白及mRNA表达量
HPDE6-C7、SW1990及PANC1细胞KLK12蛋白表达量分别为0.21±0.01、0.34±0.01、0.28±0.01(图1),KLKL12 mRNA表达量分别为1.41±0.20、3.31±0.10、2.91±0.09,SW1990及PANC1细胞的表达量均显著高于HPDE6-C7细胞,差异均有统计学意义(P值均<0.01)。故后续实验只采用SW1990、PANC1细胞。
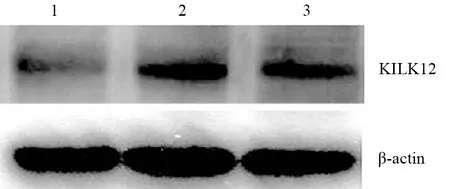
图1 HPDE6-C7(1)、SW1990(2)、PANC1(3)细胞的KLKL12蛋白表达
三、转染后SW1990、PANC1细胞KLKL12蛋白表达量的变化
SW1990细胞的NC组、siRNA-NC组、siRNA-KLK12组KLK12蛋白的表达量分别为1.00±0.02、0.98±0.04、0.51±0.04,PANC1细胞3组KLK12蛋白表达量分别为0.65±0.03、0.62±0.04、0.38±0.03。siRNA-KLK12组细胞KLK12蛋白表达量均显著低于NC组和siRNA-NC组(P值均<0.05,图2),表明抑制KLK12表达的细胞株构建成功。

图2 SW1990(2A)、PANC1(2B)的空白对照组(1)、siRNA-NC组(2)、siRNA-KLK12组(3)细胞的KLK12蛋白表达 图3 SW1990(3A)、PANC1(3B)的空白对照组(1)、OE-NC组(2)、KLK12-OE组(3)细胞的KLK12蛋白表达
SW1990细胞的NC组、OE-NC组、KLK12-OE组KLK12蛋白表达量分别为0.81±0.01、0.84±0.02、1.08±0.02,PANC1细胞3组KLK12蛋白表达量分别为0.75±0.02、0.81±0.02、1.11±0.03,KLK12-OE组细胞KLK12蛋白表达量均显著高于NC组和OE-NC组(P值均<0.05,图3),表明KLK12过表达细胞株构建成功。
四、转染后SW1990、PANC1细胞增殖能力的变化
培养72 h,SW1990、PANC1细胞的siRNA-KLK12组A450值分别为0.94±0.02、0.96±0.03,NC组分别为1.12±0.03、1.15±0.03,siRNA-NC组分别为1.16±0.05、1.21±0.03,siRNA-KLK12组A450值均小于NC组和siRNA-NC组(P值均<0.05,图4),表明抑制KLK12表达能有效抑制胰腺癌细胞的增殖能力。

图4 SW1990(4A)、PANC1(4B)的空白对照组、siRNA-NC组、siRNA-KLK12组细胞的生长曲线 图5 SW1990(5A)、PANC1(5B)的空白对照组、OE-NC组、KLK12-OE组细胞的生长曲线
培养72 h,SW1990、PANC1细胞的KLK12-OE组A450值分别为1.32±0.03、1.26±0.04,NC组分别为1.06±0.02、1.05±0.03,OE-NC组分别为1.11±0.03、1.08±0.03,KLK12-OE组A450值均显著大于NC组和OE-NC组(P值均<0.01,图5),表明KLK12过表达能明显增强胰腺癌细胞的增殖能力。
五、转染后SW1990、PANC1细胞的侵袭、迁移能力变化
SW1990、PANC1的siRNA-KLK12组的穿膜细胞数分别为(373.7±14.8)、(556.3±13.6)个/高倍视野,NC组分别为(741.7±11.6)、(668.3±16.5)个,siRNA-NC组分别为(726.0±11.8)、(646.0±15.1)个/高倍视野(图6);siRNA-KLK12组的迁移细胞数分别为696.0±13.1、449.0±16.5个/高倍视野,NC组分别为854.3±21.5、610.3±11.9个/高倍视野;siRNA-NC组分别为841.3±15.4、595.7±8.6个/高倍视野(图7)。siRNA-KLK12组穿膜细胞数和迁移细胞数均较NC组和siRNA-NC组显著减少(P值均<0.05),表明抑制KLK12表达可明显降低细胞的侵袭和迁移能力。
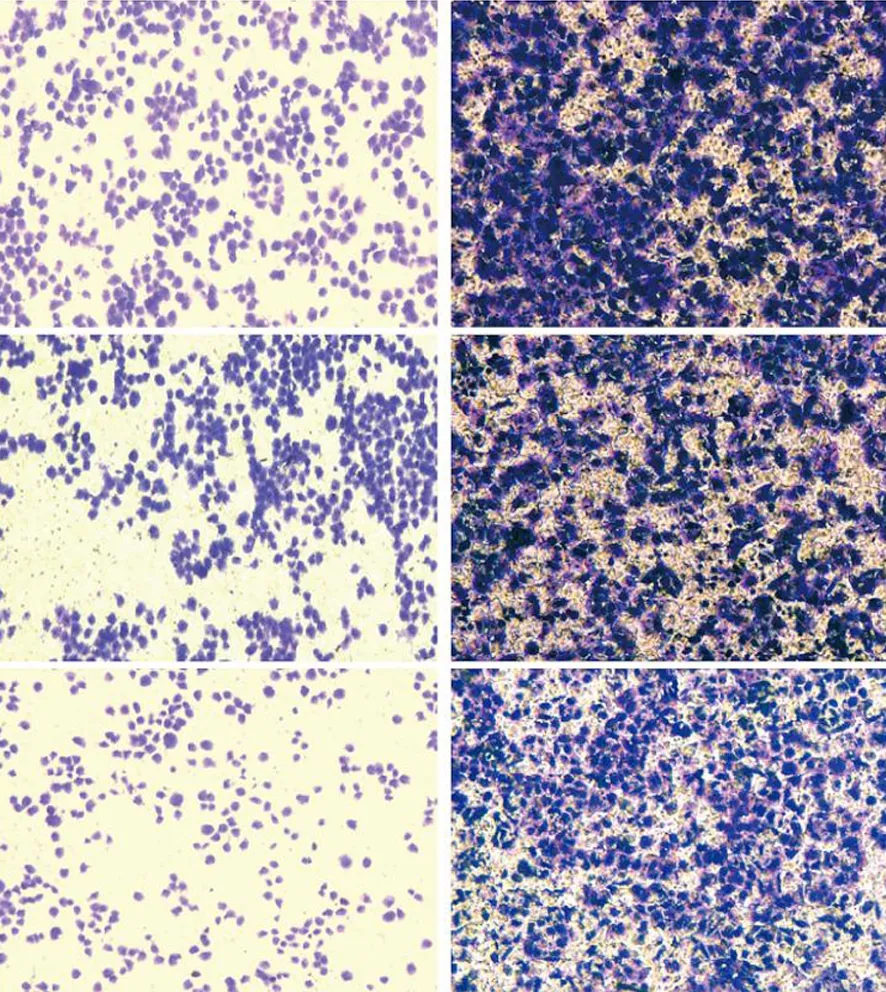
图6 SW1990(左)、PANC1(右)的空白对照组(上)、siRNA-NC组(中)、siRNA-KLK12组(下)穿膜细胞(结晶紫染色 ×200)

图7 SW1990(左)、PANC1(右)的空白对照组(上)、siRNA-NC组(中)、siRNA-KLK12组(下)的迁移细胞(结晶紫染色 ×200)
SW1990、PANC1的KLK12-OE组的穿膜细胞数分别为556.3±22.2、571.0±17.4个/高倍视野;NC组分别为393.0±15.5、354.3±14.9个/高倍视野,OE-NC组分别为402.7±10.5、426.7±23.3个/高倍视野(图8);KLK12-OE组迁移细胞数分别为639.3±16.5、740.3±13.0个/高倍视野,NC组分别为451.3±11.6、468.0±8.7个/高倍视野,OE-NC组分别为433.0±11.8、442.7±10.3个/高倍视野(图9)。KLK12-OE组穿膜细胞数和迁移细胞数均较NC组和OE-NC组显著增加(P值均<0.05),表明KLK12过表达可明显增强细胞的侵袭和迁移能力。

图8 SW1990(左)、PANC1(右)的空白对照组(上)、OE-NC组(中)、KLK12-OE组(下)的穿膜细胞(结晶紫染色 ×200)
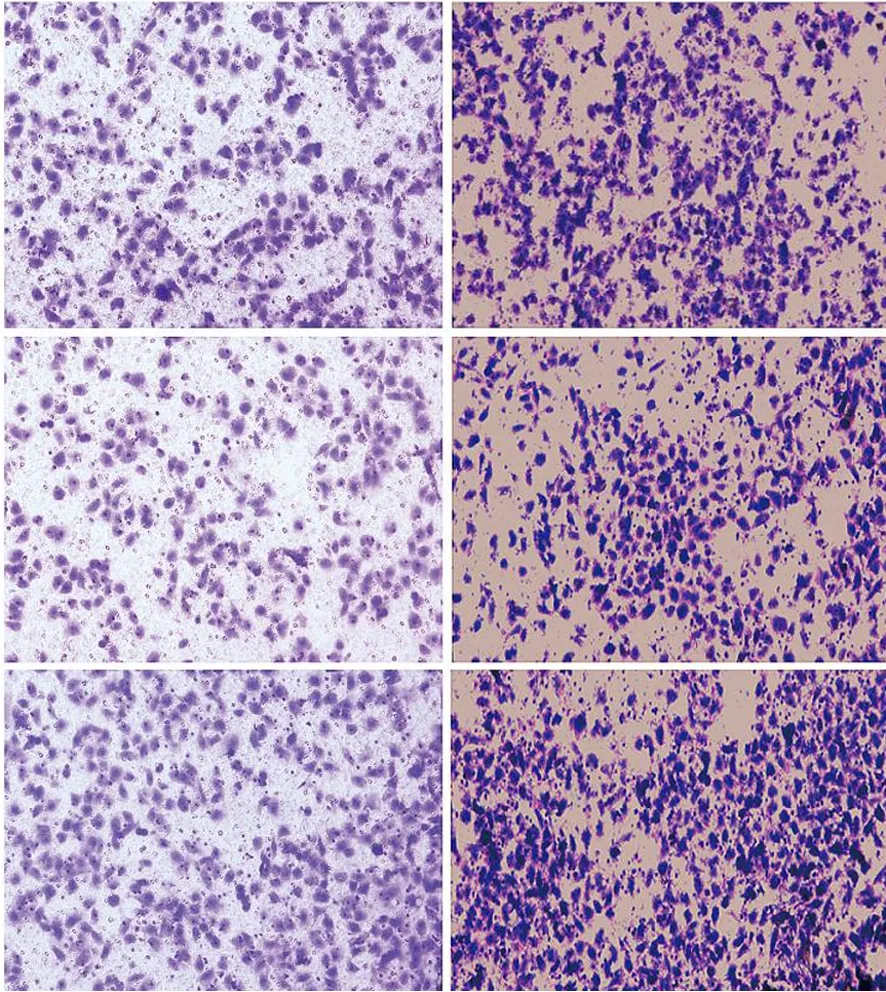
图9 SW1990(左)、PANC1(右)的空白对照组(上)、OE-NC组(中)、KLK12-OE组(下)的迁移细胞(结晶紫染色 ×200)
讨 论
KLK家族在细胞增殖、分化、凋亡、血管生成以及消化系统酶活化等多种生理过程中起作用。KLK以组织特异性的方式表达,并分别受类固醇激素和丝氨酸蛋白酶抑制剂等转录和转录后机制调控[7]。KLK3又称前列腺特异性抗原(prostate-specific antigen,PSA),目前已被临床常规用于前列腺癌的筛查[8]。KLK6可以通过切割纤维蛋白原、胶原蛋白和层黏连蛋白参与肿瘤的血管生成和转移[9]。而本课题组所研究的KLK12也已经被发现与多种肿瘤的发生和发展有关。Li等[10]研究发现KLK12在结肠癌中呈高表达,进一步利用基因沉默技术敲低结肠癌HT-29细胞中KLK12的表达后发现,肿瘤细胞的活力及侵袭力明显下降,且这一效应可能是借助AMPK/mTOR信号通路来实现的。同样在结肠癌中,Xia等[11]采用新型的硒纳米颗粒技术下调了结肠癌细胞中KLK12的表达,通过体内及体外实验发现肿瘤细胞的生长被显著抑制。Li等[12]发现KLK12在AGS胃癌细胞中的表达强于GES-1胃正常细胞,利用siRNA转染技术后发现AGS细胞的增殖及迁移能力显著被抑制,并使其细胞周期停滞在G0/G1期。Gong等[13]通过实时荧光定量PCR检测116例三阴性乳腺癌组织中KLK12 mRNA的表达,其中54例(47%)阳性表达,并通过随访及生存分析发现KLK12mRNA的阳性表达与患者不良预后显著相关。
本研究结果显示KLK12蛋白和mRNA在胰腺癌细胞株SW1990、PANC1的表达均明显高于正常胰腺细胞株HPDE6-C7,下调KLK12表达后,胰腺癌细胞增殖、侵袭以及迁移能力明显下降,而上调其表达后上述能力又明显增强。胰腺癌组织KLK12蛋白阳性表达率明显高于癌旁正常组织,且KLK12高表达与肿瘤分化程度、TNM分期以及淋巴结转移存在正相关,提示KLK12促进胰腺癌的发生与发展。
综上所述,KLK12可以促进胰腺癌细胞增殖、侵袭和迁移等恶性生物学行为,提示其可能成为新的潜在的生物学标志物。关于KLK12在胰腺癌中的作用机制以及其是否会成为新的治疗靶点仍需要更多研究进一步深入。
利益冲突所有作者声明无利益冲突
作者贡献声明胡丕波:研究操作、数据整理、论文撰写;刘蒙蒙:数据整理、统计分析;陈炯:研究设计、研究指导、论文修改
