铜氧化物对四环素的吸附性能研究
2022-12-21肖晴赵玉宝廖云
肖晴,赵玉宝,廖云
(南华大学 化学化工学院,湖南 衡阳 421000)
四环素广泛应用于农业、医药等领域[1-2],土壤和水域中的四环素难降解[3-4],严重影响自然环境安全和生物生命健康[5-6],迫切需要高效、无污染的去除四环素类抗生素处理技术[7-8]。无机材料中的铜氧化物来源丰富、成本低廉、易于调变结构与形貌,生物相容性好[9],使其在电池、传感器和光催化领域具有良好的应用价值[10-11]。
本文采用湿化学法制备了球形氧化亚铜(Cu2O),进而控制条件使氧化亚铜逐渐氧化成氧化铜,对比研究此系列样品吸附四环素的性能,在此基础上进一步研究了Cu2O吸附四环素的动力学和热力学行为。
1 实验部分
1.1 试剂与仪器
氯化铜(CuCl2·H2O)、柠檬酸(CA)、氢氧化钠、抗坏血酸(VC)、过氧化氢(30%)、无水乙醇、四环素(TC)均为分析纯;重蒸水,自制。
PCX-50C型Discover多通道光催化反应系统;IRB-510型高低温恒温反应浴;101-2AB型电热恒温鼓风干燥箱;IKA型恒温磁力加热搅拌器;EL104型电子分析天平;DF-101S型集热式恒温加热磁力搅拌器;GT10-1型高速台式离心机;Zeiss sigma 500型场发射扫描电子显微镜;Escalab 250Xi型X光电子能谱仪;3H-2000型全自动氮吸附比表面积测试仪;X’Pert Powder型X射线粉末衍射仪;VDsorb-91i型全自动程序升温化学仪;TU-1901型双光束紫外可见分光计。
1.2 铜氧化物的制备
1.2.1 Cu2O的制备 于三口烧瓶中,以480 mL水充分溶解5.44 g CuCl2·H2O与1.2 g柠檬酸,在 60 ℃ 下加入16 g NaOH,持续搅拌反应30 min。缓慢加入33.8 g VC,反应3 h,形成砖红色沉淀,冷却至室温。用水和无水乙醇充分清洗、离心,分离出固体,60 ℃干燥24 h,得到Cu2O。
1.2.2 Cu2O的氧化 在100 mL浓度为0.5 mol/L的NaOH溶液中,加入0.3 g Cu2O,缓慢加入xmL的H2O2,反应1 h。沉淀用水和无水乙醇充分清洗,离心,分离出固体,60 ℃干燥24 h,得样品,记为Cu2O-x。
1.3 吸附四环素
在pH = 5、四环素浓度为 40 mg/L、温度为 30 ℃ 条件下,将50 mL四环素溶液和10 mg吸附剂放入石英材质容器中,持续磁力搅拌下,定时取样并通过0.22 μm滤膜,得到3 mL清液,利用紫外分光光度计在357 nm波长处测其吸光度,用以分析吸附后残留的四环素浓度。实验均平行进行3次,以平均值计算四环素的吸附量(Qt,mg/g)。
(1)
其中,C0和Ct(mg/L)分别代表四环素的初始浓度和吸附进行到t时刻的浓度,V(mL)和m(mg)代表溶液的体积和吸附材料的质量。
2 结果与讨论
2.1 结构表征
2.1.1 XRD 图1是铜氧化物的XRD图。
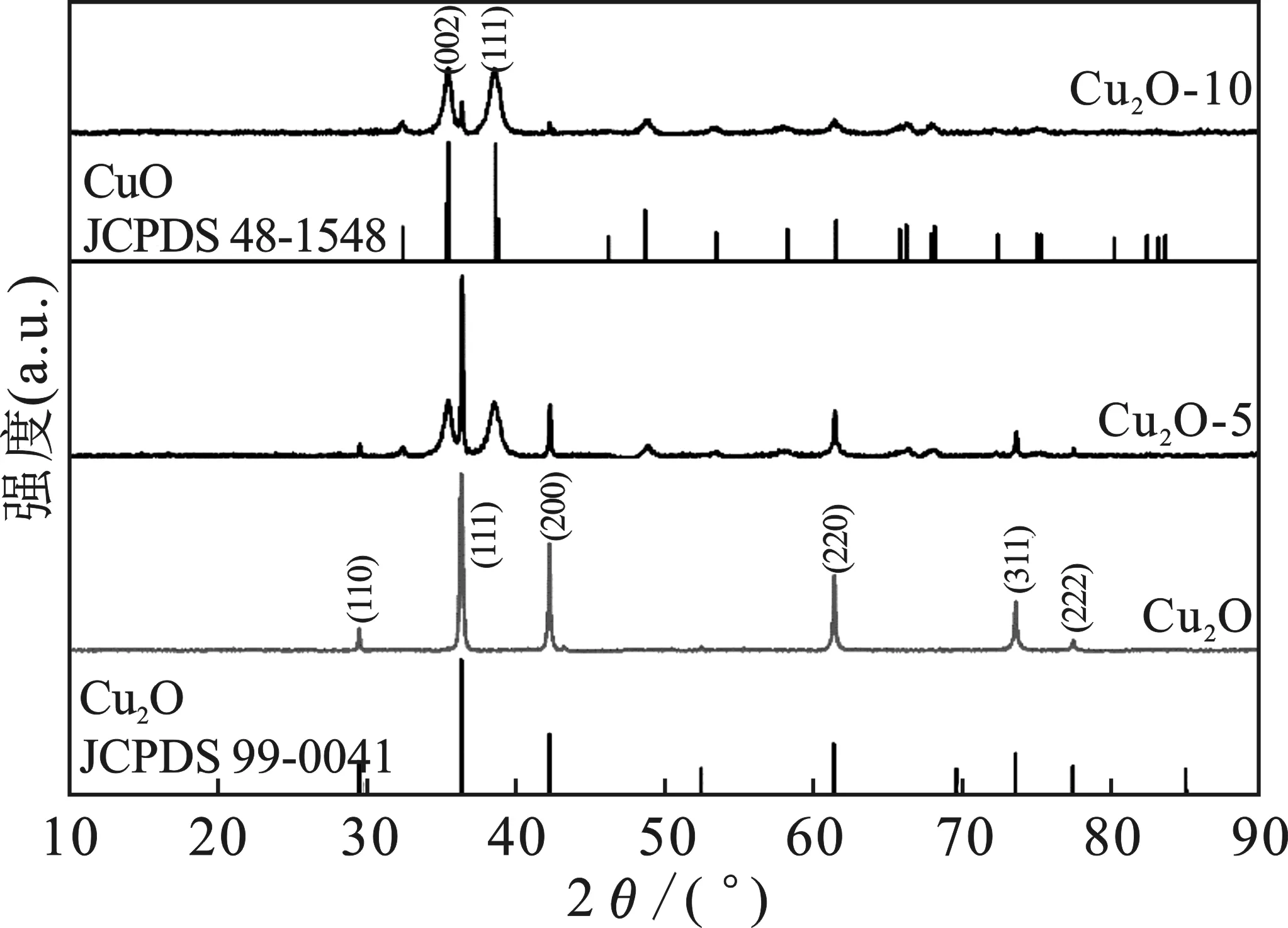
图1 铜氧化物的XRD图Fig.1 XRD patterns of copper oxides
由图1可知,Cu2O样品在36.4,42.3°等处出现相应Cu2O的(111)、(200)等晶面较强的衍射峰,这与Cu2O的标准卡片(JCPDS 99-0041)一致,表明制得了纯相的Cu2O。随H2O2用量的增加,相应于Cu2O的衍射峰逐渐减弱,同时在35.5,38.7°等处出现相应于CuO的(002)、(111)等晶面宽化的衍射峰,这些宽化弥散的衍射峰均可归属于CuO(JCPDS 48-1548)。采用Scherrer关系式的XRD峰线展宽分析结果表明,所形成的CuO晶粒尺寸约10 nm(表1)。
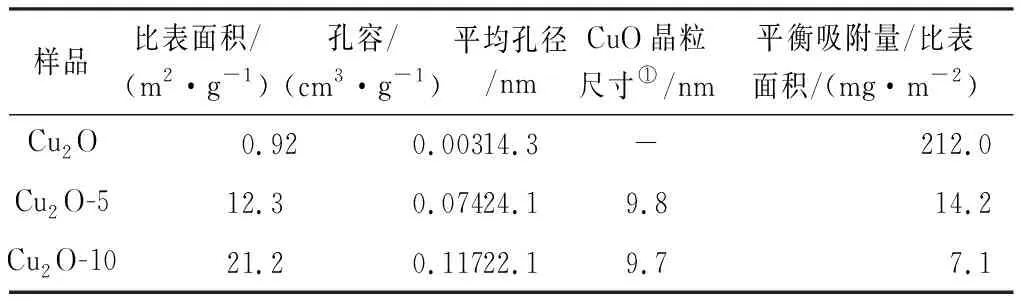
表1 铜氧化物的物性参数Table 1 Physical parameters of copper oxides
为了解样品中Cu2O的氧化程度,以位于38.7°相应于CuO (111)晶面和42.3°相应于Cu2O的(200)晶面的衍射峰积分强度之比I38.7/I42.3,作为铜氧化物中CuO与Cu2O相对含量的指标。分峰拟合分析结果显示,采用5 mL H2O2制得的Cu2O-5的衍射峰强比I38.7/I42.3=6.6,显著低于采用 10 mL H2O2制得的Cu2O-10的衍射峰强比I38.7/I42.3=55.5。这一结果表明,H2O2促进了Cu2O的氧化:随着H2O2的加入,样品中CuO的含量持续增加,Cu2O的含量逐渐减少。
2.1.2 XPS 图2是样品Cu2O、Cu2O-10的XPS图。Cu 2p的XPS图见图2a。

图2 Cu2O、Cu2O-10的XPS图Fig.2 XPS map of Cu2O,Cu2O-10a.Cu 2p的XPS图; b.Cu(LMM)的XPS图
由图2可知,Cu2O中有 932.44 eV 和 952.24 eV 两个峰,这与Cu2O的电子图谱一致,Cu2O-10中则存在四个Cu 2p峰,其中933.52 eV和953.41 eV处的结合能归属于Cu2+的 Cu 2p3/2和 Cu 2p1/2,Cu+和Cu2+能够明显地被区分[12]。Cu(LMM)的XPS图见图2b,916.5 eV 和 917.44 eV 处的动能分别归属于Cu2O和CuO[13]。
以上结果表明,Cu2O经H2O2氧化后的Cu2O-10样品表面全部氧化成CuO。
2.1.3 SEM 图3是铜氧化物的SEM图。

图3 铜氧化物的SEM图
由图3可知,纯Cu2O呈现较为均匀、近于球形的结构(图3a、3d),其尺度为0.5~3 μm,表面较为规整;随着H2O2用量的增加,Cu2O的边缘逐渐形成薄片状结构,样品Cu2O-10中,已难以看到Cu2O原本较为光滑的表面,大量的片状物剥落、聚集(图3b、3c、3e、3f)。结合此前的XRD分析,这些片状物应是呈Cu2+高氧化态的CuO。由表1可知,Cu2O-10具有更大的比表面积、平均孔径和孔容,这是因为这些片状物聚集可形成丰富的孔,从而使Cu2O-x较纯Cu2O比表面积与孔体积显著增大。
2.2 氧化程度
图4是相同质量铜氧化物样品的H2-TPR图。
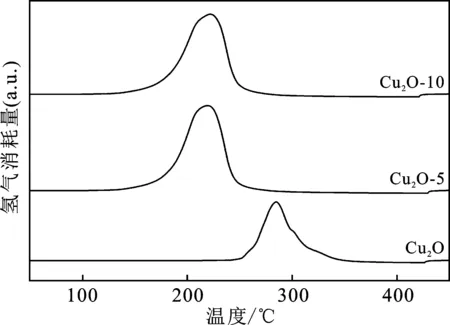
图4 铜氧化物的TPR图Fig.4 TPR patterns of copper oxides
由图4可知,微米尺度纯Cu2O还原速率极大的峰温在285 ℃,而Cu2O-5、Cu2O-10的相应峰温分别是223 ℃和220 ℃,即Cu2O氧化后形成纳米尺度薄片状CuO,可在较微米Cu2O约低60 ℃的温度下被H2还原,这与理论上Cu2O比CuO更易被还原相悖,此前相关文献报道,高分散态CuO比分解硝酸铜所得大尺度CuO的还原温度低200 ℃[14],因此Cu2O-10在更低温度下被还原的原因可能是高比表面积的CuO纳米片表面活性显著提高。
理论上,CuO完全还原的耗氢量应为Cu2O的2倍。对铜氧化物样品H2-TPR还原耗氢峰面积进行积分分析发现,Cu2O-5和Cu2O-10的H2消耗量分别是纯Cu2O的1.8倍和1.9倍。这一结果表明,本文条件下H2O2可以将90%左右的微米尺度Cu2O氧化为CuO,样品Cu2O-10较Cu2O-5被氧化的程度更高。
2.3 吸附动力学
图5给出了铜氧化物吸附四环素随时间变化的实验结果。
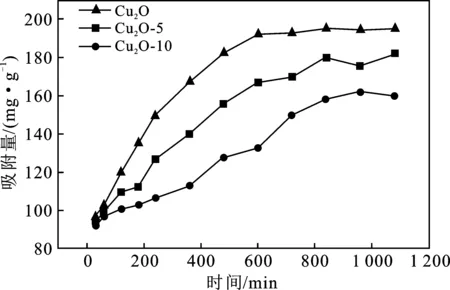
图5 铜氧化物吸附四环素的时间-吸附量图Fig.5 Time-adsorbed amount diagrams of tetracyclineadsorption by copper oxides
由图5可知,随着时间的增加,三种铜氧化物的吸附量都在逐渐增加,Cu2O吸附10 h后达到吸附平衡。使用H2O2将一价铜的微米Cu2O氧化为90%为二价铜的CuO纳米片,尽管比表面积增加 10~20 倍(表1),其吸附量反而减小。由表1单位面积的平衡吸附量可知,纯Cu2O的吸附容量高出其被氧化90%的样品1个数量级之多,表明Cu+对四环素吸附效果比Cu2+更好,铜氧化物对四环素的吸附过程中主要是一价铜离子起作用。
为探究吸附机理,对有高吸附性能的纯Cu2O采用准一级和准二级动力学吸附模型对其吸附四环素的实验数据进行拟合,结果见图6。
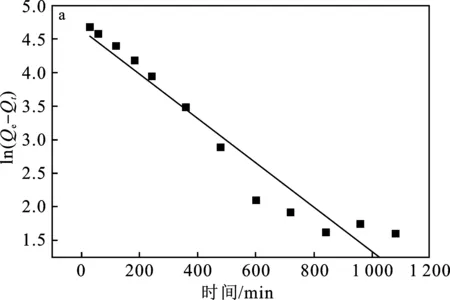
图6 Cu2O吸附四环素的动力学模型Fig.6 Kinetic model of tetracycline adsorption on Cu2Oa.准一级动力学模型;b.准二级动力学模型
由图6可知,准二级模型的相关系数(R2=0.999)高于准一级模型的相关系数(R2=0.944),纯Cu2O吸附四环素的过程遵守准二级动力学模型,即Cu2O吸附四环素的过程为化学吸附:吸附速率与表面活性中心的数量成正比[15]。
2.4 吸附等温线
为进一步研究纯Cu2O吸附四环素的热力学特征,调节四环素的起始浓度40~180 mg/L,在20~40 ℃范围内测定了等温吸附平衡数据:20 ℃时Cu2O对四环素的吸附容量为307.6 mg/g,30 ℃时为431 mg/g,40 ℃时高达730 mg/g。采用Freundlich和Langmuir吸附模型对系列等温吸附平衡数据进行拟合,结果见图7,所得参数列于表2。

图7 Cu2O吸附四环素的吸附等温线Fig.7 Adsorption isotherm of tetracycline adsorption on Cu2Oa.Freundlich吸附等温线;b.Langmuir吸附等温线
由图7可知,随着温度升高,吸附量增加,Langmuir模型的相关系数高于Freundlich的相关系数,Cu2O吸附四环素的过程符合基于化学吸附的Langmuir单层模型[16]。

表2 Cu2O吸附四环素的等温吸附模型拟合参数Table 2 Fitting parameters of isotherm adsorption model of tetracycline adsorption on Cu2O
2.5 热力学分析
假定20~40 ℃间吸附过程的焓变、熵变不随温度改变,基于范特霍夫等压方程(3),对不同吸附温度的吸附平衡数据进行热力学分析,结果见图8,所得热力学参数列于表3。
(2)
(3)
ΔG=ΔH-TΔS
(4)
其中,ΔH、ΔG、ΔS分别表示焓变、吉布斯自由能变和熵变,KD、R、T分别表示平衡吸附系数、气体常数和开尔文温度。
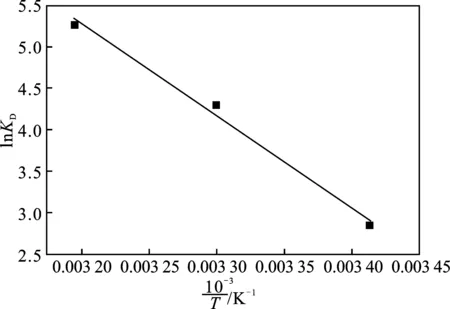
图8 Cu2O吸附四环素的热力学图线Fig.8 Thermodynamic diagram of tetracyclineadsorption on Cu2O

表3 Cu2O吸附四环素的热力学参数Table 3 Thermodynamic parameters of tetracycline adsorption on Cu2O
由表3可知,ΔH>0、ΔS>0、ΔG<0,表明Cu2O吸附四环素为吸热、增熵自发过程,温度越高,吸附越有利。
2.6 Cu2O的重复使用性
为评价Cu2O吸附四环素的可重复使用性,对吸附实验后的Cu2O作水和乙醇清洗、超声脱附 30 min 处理,进行吸附-解吸循环实验5次,结果见图9。

图9 Cu2O对四环素吸附的重复使用实验结果Fig.9 Reuse experimental results of tetracyclineadsorption on Cu2O
由图9可知,5次循环后,四环素吸附量仍可达到170 mg/g,去除率达86.1%,这说明Cu2O具有良好的稳定性与循环再生性。
3 结论
(1)采用湿化学法制备球状氧化亚铜,通过加入双氧水使其逐步氧化为CuO。系列铜氧化物吸附四环素的实验表明,吸附活性中心主要源于一价铜离子。
(2)Cu2O对四环素的吸附更符合基于化学吸附的准二级动力学模型,吸附等温线符合Langmuir单层吸附模型,吸附过程为自发吸热增熵过程。
(3)经5次循环后,Cu2O对四环素的去除率仍保持在86% 以上,氧化亚铜可以用作去除四环素类抗生素的高效吸附剂。
