卵巢高级别浆液性癌中PD-L2的表达及其临床意义
2022-12-21缪小兵朱兴华张邢松贾美群
缪小兵,朱兴华,张邢松,沈 蓉,贾美群
卵巢上皮性癌是女性病死率最高的恶性肿瘤,发病隐匿,早期不易发现,约75%的患者就诊时已为晚期,晚期患者的5年生存率低于40%[1]。卵巢高级别浆液性癌(high-grade serous ovarian carcinoma, HGSOC)是卵巢上皮性癌中最常见的病理类型[2]。目前,肿瘤细胞减灭术联合以铂类为基础的化疗以及PARP抑制剂,是晚期HGSOC的标准治疗模式,但多数患者仍会出现复发、耐药,最终死亡[3]。近年,免疫治疗的快速发展为晚期HGSOC患者带来了新的希望。PD-1是细胞表面受体,主要位于T细胞表面。PD-1与PD-L1或PD-L2结合,可抑制T细胞的功能,促使肿瘤发生免疫逃逸[4]。研究发现,肿瘤免疫微环境的复杂性和多样性,可影响免疫检查点抑制剂的疗效。在多种肿瘤中,肿瘤相关巨噬细胞(tumor-associated macrophages, TAM)是产生免疫抑制性肿瘤微环境的关键细胞。TAM可直接或间接调节肿瘤免疫微环境中PD-1、PD-L1/PD-L2的表达。TAM分为M1型和M2型,M1型主要发挥抗肿瘤功能,M2型则通过产生免疫抑制因子促进肿瘤进展[5-6]。目前,PD-1、PD-L1在HGSOC中的表达及作用已有较多报道,但关于PD-L2的研究甚少。本文着重探讨PD-L2在HGSOC中的表达及其临床意义,旨在为HGSOC的诊疗提供参考。
1 材料与方法
1.1 临床资料收集2008年1月~2019年12月我院接受初次肿瘤细胞减灭术的HGSOC石蜡标本61例。患者年龄39~78岁,中位年龄55岁,患者术前均未行放、化疗或其他特殊治疗,术后行紫杉醇+铂类(卡铂或顺铂)化疗。61例HGSOC中,术前血清CA125≤35 U/mL 5例,>35 U/mL 55例,1例患者术前血清CA125水平不详。肿瘤累及单侧卵巢26例,双侧卵巢35例;肿瘤最大径<10 cm 39例,≥10 cm 22例。病理分期按照FIGO(2014)的标准:I~Ⅱ期14例,Ⅲ~Ⅳ期47例。手术满意度:肿瘤细胞减灭术后无残余病灶(R0)15例,有残余病灶(NR0)46例。腹水量:≤500 mL 41例,>500 mL 20例。一线含铂化疗:铂敏感(复发时间≥6个月)49例,铂耐药(复发时间<6个月或化疗期间肿瘤进展/稳定)12例。对所有病例进行随访,截至时间2021年8月16日,中位随访时间32个月(2~125个月)。
1.2 免疫组化标本均常规取材,经10%中性福尔马林固定,石蜡包埋,4 μm厚连续切片,行免疫组化EnVision法染色。兔PD-L2单克隆抗体(D7U8C,稀释度1 ∶200)购自Cell Signaling Technology公司;小鼠CD68(Pan-巨噬细胞标志物)单克隆抗体(KP1,稀释度1 ∶3 000)购自Abcam公司;兔CD163(M2型巨噬细胞标志物)单克隆抗体(D6U1J,稀释度1 ∶200)购自Cell Signaling Technology公司。具体操作步骤严格按试剂盒说明书进行,用已知阳性组织作为阳性对照,以PBS代替一抗作为阴性对照。
1.3 结果判读参考Okadome等[7]的标准,肿瘤细胞(tumor cell, TC)PD-L2根据阳性细胞染色强度和阳性细胞比例进行综合评分。(1)按阳性细胞着色强度进行评分:无着色为0分,黄色为1分,棕黄色为2分,棕色为3分;(2)按阳性细胞百分比进行评分:阳性细胞<10%为0分,10%~29%为1分,30%~49%为2分,≥50%为3分;两项评分相乘:≥3分为TC PD-L2阳性,<3分为TC PD-L2阴性。肿瘤浸润性免疫细胞(tumor-infiltrating immune cell, TIIC)PD-L2按阳性细胞百分比判读:≥5%为TIIC PD-L2阳性,<5%为TIIC PD-L2阴性[8]。选取4个高倍视野对CD68、CD163阳性染色细胞进行计数,并求其平均值。利用耶鲁大学开发的X-tile软件,计算CD68、CD163强、弱阳性的最佳截断值(cut-off值)。据X-tile软件计算,将阳性细胞数>78个/HPF判读为CD68强阳性,≤78个/HPF判读为CD68弱阳性;将阳性细胞数>80个/HPF判读为CD163强阳性,≤80个/HPF判读为CD163弱阳性。
1.4 统计学分析采用SPSS 23.0软件、GraphPad Prism软件进行统计学分析。应用Pearson χ2、Fisher精确概率法分析TC、TIIC中PD-L2表达与HGSOC临床病理特征的关系。采用非配对t检验或Mann-WhitneyU检验比较CD68、CD163阳性细胞数在TC、TIIC PD-L2阳性、阴性组间的差异。利用Kaplan-Meier法绘制生存曲线,生存曲线的比较采用Log-rank检验。单因素和多因素预后分析,采用Cox风险比例回归模型,将单因素分析有统计学意义的变量纳入多因素Cox回归分析。以P<0.05为差异有统计学意义。
2 结果
2.1 HGSOC中PD-L2的表达及其与临床病理特征的关系TC以及TIIC PD-L2阳性染色定位于细胞膜/细胞质(图1)。61例HGSOC中TC PD-L2阳性17例,阳性率27.9%;TIIC PD-L2阳性37例,阳性率60.7%。TC PD-L2表达与一线含铂化疗反应性相关,其在铂耐药患者中的阳性率(58.3%,7/12)高于铂敏感患者中的阳性率(20.4%,10/49)(P=0.026),但TC PD-L2表达与患者年龄、术前血清CA125水平、肿瘤最大径、累及侧别、病理分期、手术满意度及腹水量均无关(P均>0.05)。TIIC PD-L2表达与患者年龄、术前血清CA125水平、肿瘤最大径、累及侧别、病理分期、手术满意度、腹水量及一线含铂化疗反应性均无关(P均>0.05,表1)。

表1 HGSOC中PD-L2表达与临床病理特征的关系
aPearson χ2检验;bFisher精确概率检验;c1例患者术前血清CA125水平不详
2.2 HGSOC中CD68、CD163的表达及其与PD-L2的关系CD68、CD163免疫组化阳性染色定位于细胞质(图2、3)。本组对CD68、CD163阳性染色细胞进行计数发现,CD68在TC PD-L2阴性组中的表达高于TC PD-L2阳性组(P<0.000 1,图4A)。与此相反,CD163在TC PD-L2阳性组中的表达高于TC PD-L2阴性组(P=0.001 1,图4B)。CD68、CD163在TIIC PD-L2阴性组与阳性组中的表达差异均无统计学意义(P均>0.05,图4C、D)。

①A①B②③
2.3 HGSOC中PD-L2表达与预后的关系61例获得随访HGSOC患者中,死亡22例(22/61,36.1%),进展35例(35/61,57.4%)。Kaplan-Meier生存分析显示:TC PD-L2阳性患者的总生存期(overall survival, OS)和无进展生存期(progression-free survival, PFS)比阴性患者低(P均<0.05),但TIIC PD-L2表达与OS和PFS均无关(P均>0.05,图5)。因术前血清CA125 ≤35 U/mL以及铂耐药患者例数较少,故术前血清CA125水平、一线含铂化疗反应性不纳入Cox单因素及多因素分析。Cox单因素分析显示:TC PD-L2(P=0.039)、CD68(P=0.014)、CD163(P=0.024)表达与OS相关。TC PD-L2(P=0.007)、CD68(P=0.033)、CD163(P=0.016)表达也与PFS相关。Cox多因素分析显示:TC PD-L2表达是影响OS和PFS的相关因素,但不是独立的预后因素(P均>0.05,表2)。进一步分析发现:TC PD-L2阳性、CD68弱阳性以及TC PD-L2阳性、CD163强阳性患者的预后更差(P均<0.05,图6)。
3 讨论
免疫逃逸是TC的重要特征,由多种因素介导,包括细胞表面抑制性配体(如PD-L1)。PD-L1通过与T细胞上的PD-1受体相互作用以诱导T细胞耗竭。PD-L2是PD-1受体的第二个配体,同样可抑制T细胞功能[9-10]。PD-L1在造血细胞(T细胞、NK细胞、树突状细胞、巨噬细胞、B细胞和骨髓来源的肥大细胞)、非造血细胞(血管和淋巴管内皮细胞、上皮细胞、角质形成细胞、间充质干细胞、胎盘合体滋养细胞)以及TC上广泛表达。PD-L2与PD-L1不完全相同,其主要表达于造血细胞,包括树突状细胞、巨噬细胞、骨髓来源的肥大细胞、B细胞、Th2细胞和活化的T细胞,PD-L2也可表达于TC。尽管PD-L1和PD-L2都可作为PD-1的配体,但它们有各自独特的其它结合伴侣。如PD-L1可与B7-1(CD80)结合,而PD-L2可与反义导向分子RGMb结合。PD-L1的结合伴侣B7-1主要由造血细胞和抗原呈递细胞表达,而PD-L2的结合伴侣RGMb主要表达于巨噬细胞[11]。
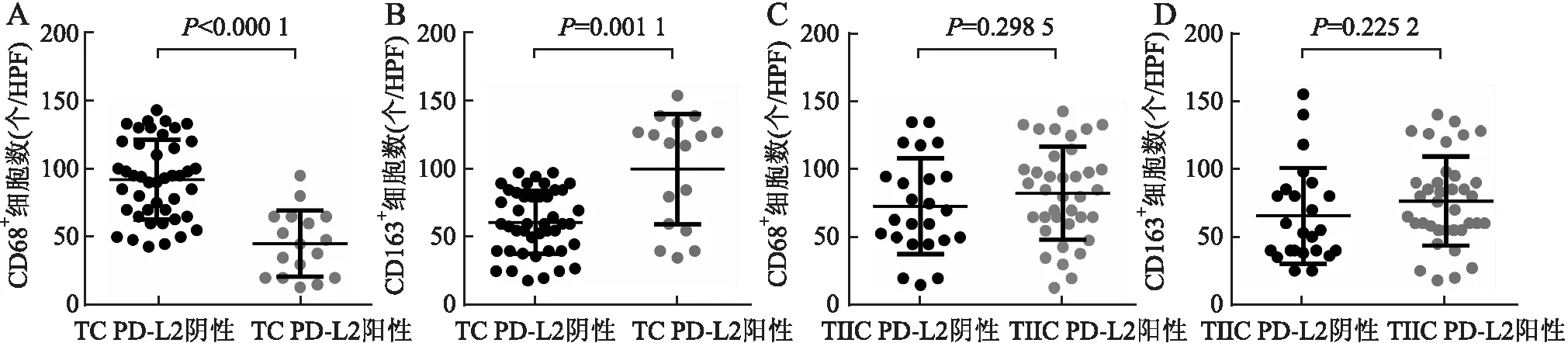
图4 HGSOC中PD-L2表达与CD68、CD163表达的关系:A.TC PD-L2阴性组和阳性组中CD68阳性细胞数;B.TC PD-L2阴性组和阳性组中CD163阳性细胞数;C.TIIC PD-L2阴性组和阳性组中CD68阳性细胞数;D.TIIC PD-L2阴性组和阳性组中CD163阳性细胞数
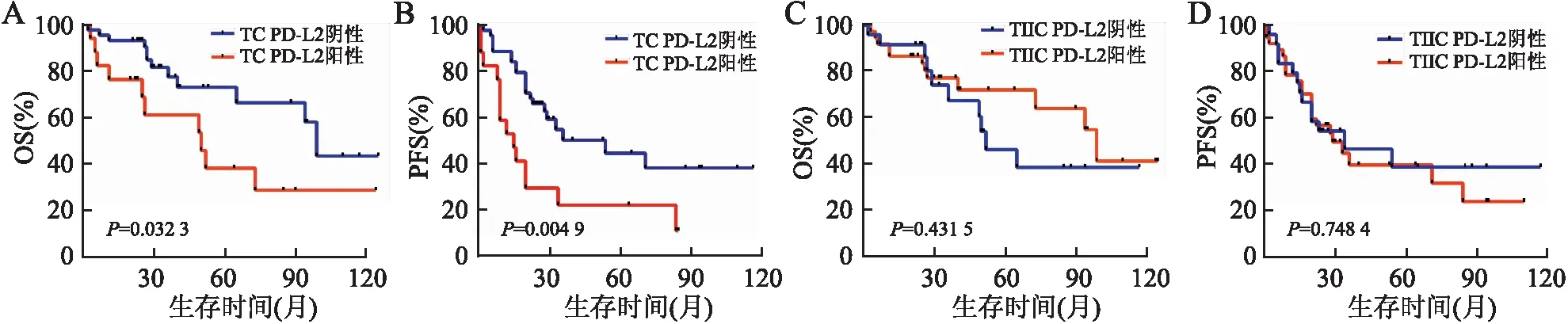
图5 HGSOC中PD-L2表达的Kaplan-Meier生存曲线:A.TC PD-L2表达与HGSOC患者OS的关系;B.TC PD-L2表达与HGSOC患者PFS的关系;C.TIIC PD-L2表达与HGSOC患者OS的关系;D.TIIC PD-L2表达与HGSOC患者PFS的关系
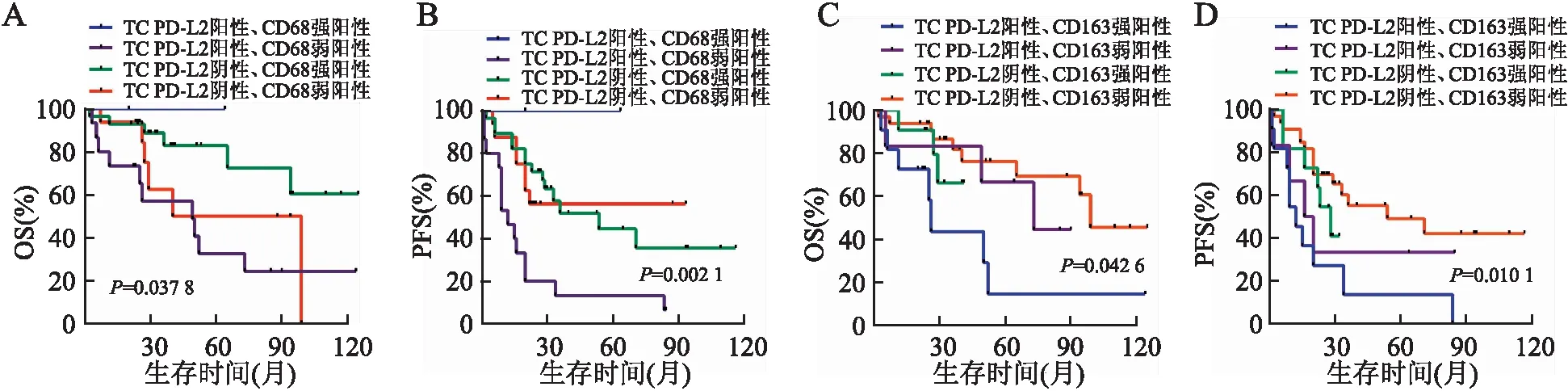
图6 HGSOC中TC PD-L2和CD68/CD163联合检测的Kaplan-Meier生存曲线:A.TC PD-L2与CD68不同表达组与HGSOC患者OS的关系;B.TC PD-L2与CD68不同表达组与HGSOC患者PFS的关系;C.TC PD-L2与CD163不同表达组与HGSOC患者OS的关系;D.TC PD-L2与CD163不同表达组与HGSOC患者PFS的关系
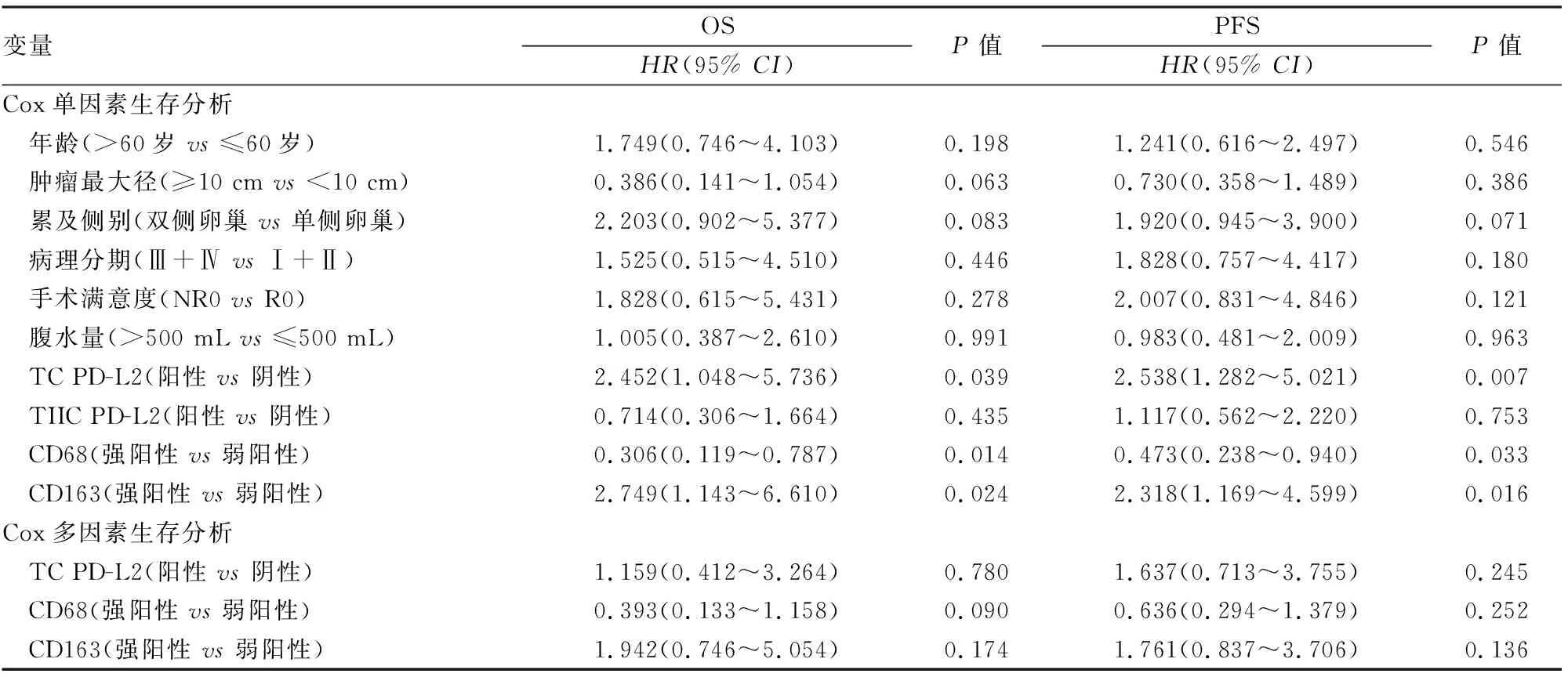
表2 Cox单因素和多因素回归模型分析HGSOC患者OS和PFS
目前,根据PD-1/PD-L1的免疫疗法在治疗黑色素瘤、非小细胞肺癌、膀胱癌等晚期肿瘤中取得了令人满意的临床效果[9]。有研究报道,PD-1、PD-L1在卵巢上皮性癌肿瘤组织中的表达比癌旁组织高,浆液性癌尤为明显,且PD-1、PD-L1在病理分期晚的患者中阳性率高,患者的预后较差[4]。Webb等[12]报道HGSOC中PD-L1主要表达于肿瘤相关CD68+巨噬细胞,而TC通常不表达PD-L1。PD-L1+细胞常与CD8、CD4以及PD-1+肿瘤浸润性淋巴细胞(tumor infiltrating lymphocytes, TIL)、CD25+FoxP3+调节性T细胞以及其它TIL亚群共定位,且PD-L1+患者常预后良好。近期文献报道[13]HGSOC中的PD-L1主要在巨噬细胞(而非TC)中表达,PD-1主要由淋巴细胞表达;CD3、PD-L1以及PD-1高表达患者常预后较好。目前,PD-L2在卵巢癌组织中的表达及其与患者预后关系的研究尚少。有研究报道,PD-L2在正常卵巢组织表达较低,而在卵巢癌中表达较高,在疾病进展过程中卵巢癌微环境可诱导PD-L2表达[14]。Xue等[15]报道PD-L2在卵巢癌组织中的阳性率为22.08%(17/77)。本实验显示,TC、TIIC中PD-L2在HGSOC中的阳性率分别为27.9%(17/61)、60.7%(37/61)。Xue等[15]的研究显示,PD-L2的表达状态与卵巢癌患者的临床病理特征无关,本组TC PD-L2的表达与一线含铂化疗反应性相关,其在铂耐药患者中的阳性率(58.3%,7/12)高于铂敏感患者中的阳性率(20.4%,10/49)(P=0.026),但TC PD-L2的表达与患者年龄、术前血清CA125水平、肿瘤最大径、累及侧别、病理分期、手术满意度及腹水量均无关(P均>0.05)。TIIC PD-L2表达与患者年龄、术前血清CA125水平、肿瘤最大径、累及侧别、病理分期、手术满意度、腹水量及一线含铂化疗反应性均无关(P均>0.05)。此外,Xue等[15]报道PD-L2高表达卵巢癌患者的OS显著缩短,PD-L2高表达是卵巢癌患者的独立预后因素。本实验结果显示TC PD-L2阳性患者的OS和PFS比阴性患者低(P均<0.05),但TIIC PD-L2的表达与OS和PFS均无关(P均>0.05)。Cox单因素和多因素分析显示:TC PD-L2表达是影响OS和PFS的相关因素,但不是独立的预后因素(P均>0.05)。
研究表明,TAM常表达PD-L1和PD-L2。通常M1型巨噬细胞主要发挥抗肿瘤功能,M2型则通过产生免疫抑制因子促进肿瘤进展。有研究认为,M1型巨噬细胞的作用是同时具有抗肿瘤和促肿瘤功能:(1)M1型巨噬细胞在免疫监视过程中发挥重要作用,M1型巨噬细胞浸润与一些肿瘤患者预后良好有关,可抑制TC增殖、诱导TC凋亡,如在肝细胞癌中,M1型巨噬细胞低浸润、M2型巨噬细胞高浸润与肝细胞癌患者预后不良有关。(2)M1型巨噬细胞还可促进肿瘤的进展,如在胰腺癌中M1型巨噬细胞可通过诱导TC上皮-间质转化促进转移[16-17]。Sumitomo等[18]报道非小细胞肺癌中M2型巨噬细胞的浸润,与较差的DFS和OS相关。本实验结果显示,CD68在TC PD-L2阴性组中的表达高于TC PD-L2阳性组(P<0.000 1);与此相反,CD163在TC PD-L2阳性组中的表达高于TC PD-L2阴性组(P=0.001 1)。CD68、CD163在TIIC PD-L2阴性组与阳性组中的表达差异无统计学意义(P均>0.05)。Kaplan-Meier生存曲线显示:TC PD-L2阳性、CD68弱阳性及TC PD-L2阳性、CD163强阳性患者的预后更差(P均<0.05)。
综上所述,HGSOC中PD-L2、CD68、CD163的表达影响患者的OS和PFS。联合检测PD-L2、CD68以及CD163表达可为HGSOC患者的预后判断提供依据,同时为免疫治疗提供实验数据。