长链非编码RNA NRSN2-AS1通过miR-129-5p/Wnt5a轴靶向调控Wnt/β-catenin信号通路对食管鳞状细胞癌发生、发展的影响
2022-12-21徐同欣颜朝阳路军涛李晓旭董稚明
徐同欣,颜朝阳,路军涛,李晓旭,董稚明,郭 炜
食管癌是全球病死率较高的恶性肿瘤,根据病理类型可分为食管鳞状细胞癌(esophageal squamous cell carcinoma, ESCC)和食管腺癌(esophageal adenocarcinoma, EAC)[1]。ESCC是我国食管癌的主要类型,约占食管癌的90%以上[2]。虽然ESCC的多学科治疗取得了一定进展,但与其他恶性肿瘤相比,ESCC患者的预后仍较差,5年总生存率不足30%[3-5]。长链非编码RNA(long non-coding RNA,lncRNA)是长度介于200~100 000 nt的无编码能力RNA。研究表明,lncRNA在ESCC等多种肿瘤发生、发展中起重要作用[6-8]。lncRNA NRSN2-AS1最早在卵巢癌中发现,可通过竞争性结合微小RNA(microRNA, miRNA)促进卵巢癌的进展,但其在ESCC中的作用和机制尚未完全阐明[9]。本文通过检测NRSN2-AS1在ESCC组织及细胞中的表达,探讨NRSN2-AS1过表达对Eca109细胞增殖、迁移及侵袭能力的影响,旨在为ESCC的靶向治疗提供潜的分子靶点。
1 材料与方法
1.1 临床资料收集2012年1月~2015年12月我院存档的96例ESCC手术切除标本,其中男性患者55例,女性患者41例。患者术前均未接受任何放、化疗,每例患者组织标本包括ESCC组织和癌旁正常组织(距原发灶边缘3~5 cm)。组织标本均经两位病理医师证实。本实验经我院伦理委员会批准,患者均签署知情同意书。
1.2 细胞及主要试剂人类ESCC细胞系Eca109、TE1、TE13和KYSE150,由我院肿瘤研究所病理研究室保留并传代。TRIzol试剂购自美国Invitrogen公司;胎牛血清的RPMI 1640培养液购自美国Gibco公司;Lipofectamine 2000购自美国Thermo公司;反转录试剂盒、MTS试剂盒和双荧光素酶报告基因检测试剂盒,购自美国Promega公司;SYBR PCR Master Mix试剂,购自北京索莱宝公司;Transwell小室购自美国Corning公司;TOP-FLASH和FOP-FLASH质粒购自美国Millipore Corporation公司。本实验引物、NRSN2-AS1过表达质粒和miR-129-5p mimic,均购自于上海生工公司。
1.3 细胞培养及转染细胞系Eca109、TE1、TE13和KYSE150,均常规培养于含10%胎牛血清的RPMI 1640培养液中,细胞培养条件为恒温37 ℃,CO2体积浓度为5%。将状态良好且处于对数生长期的Eca109细胞接种于6孔板中继续培养,当细胞生长融合70%~80%时可进行转染。参照Lipofectamine 2000转染试剂说明书,分别或同时转染阴性对照(pcDNA3.1-negative control,pcDNA3.1-NC)、pcDNA3.1-NRSN2-AS1或阴性对照(miR-NC)、miR-129-5p mimic。
1.4 qRT-PCR法使用TRIzol试剂提取组织或细胞总RNA,RNA提取后使用酶标仪检测RNA样品260/280 nm吸光度值,其数值位于1.8~2.0的样品为合格。RNA完整性的检测通过RNA琼脂糖电泳进行测定,电泳结果:28、18、5 S,且28 S条带亮度约为18 S条带2倍则认定提取的RNA样品合格。参照反转录试剂盒说明书将RNA反转录为cDNA,用于检测NRSN2-AS1、miR-129-5p及Wnt5a mRNA的表达,以GAPDH作为内参照。qRT-PCR运行参数:95 ℃ 50 s、95 ℃ 30 s、55 ℃ 30 s、72 ℃30 s,合计35个循环。基因的相对表达量用2-△△Ct方法计算,所用引物序列详见表1。

表1 引物序列
1.5 MTS实验将转染24 h后的Eca109细胞接种于96孔板中,每孔1×103个细胞,每组设6个副孔。待细胞贴壁后分别于0、24、48、72、96 h,每孔加入20 μL的MTS试剂(500 μg/mL)。震荡混匀后,细胞于培养箱中孵育2 h,随后将96孔板置于多功能酶标仪中测定490 nm处的吸光度值,实验重复3次。
1.6 划痕愈合实验实验开始前在6孔板背面均匀绘制水平横线,将转染24 h后的Eca109细胞重新接种于6孔板中,每孔1×106个细胞,每孔加入无血清RPMI 1640培养基至2 mL。待细胞长至完全融合时,用200 μL移液枪头垂直于横线轻轻划痕;分别于划痕后0、24 h在倒置显微镜下(100×)观察细胞,计算划痕愈合率;实验重复3次。
1.7 Transwell侵袭实验将50 μL稀释好的Matrigel基质胶,均匀涂于Transwell小室的上室表面,37 ℃孵育过夜。细胞转染24 h,向小室的上室内加入1×105个细胞,再加入无血清RPMI 1640培养基,总量为200 μL;下室内加入含10%胎牛血清的RPMI 1640培养基600 μL。常规培养24 h,取出小室,PBS冲洗3次,使用棉签轻柔地擦去上室内未能穿透膜的细胞,结晶紫染色、固定在倒置显微镜下观察,并计算穿膜细胞数,实验重复3次。
1.8 双荧光素酶报告基因实验采用生物信息学分析预测NRSN2-AS1序列中可与miR-129-5p相结合的片段,并将该片段插入至双荧光素酶报告基因载体pmir GLO中,构建NRSN2-AS1野生型和突变型质粒。将NRSN2-AS1野生型和突变型质粒,分别与miR-129-5p-mimic共转染至Eca109细胞,常规培养48 h,使用双荧光素酶报告基因试剂盒测定各组的相对荧光强度;实验重复3次。
为测定Wnt/β-catenin信号通路激活情况,将TOP-FLASH、FOP-FLASH、空白对照质粒,分别与pcDNA3.1-NRSN2-AS1质粒、miR-129-5p-mimic共转染至Eca109细胞。常规培养48 h,使用双荧光素酶报告基因试剂盒测定TOP/FOP比值;实验重复3次。

2 结果
2.1 ESCC中NRSN2-AS1的表达qRT-PCR结果显示,NRSN2-AS1在ESCC组织(2.48±0.90)中的表达水平显著高于癌旁组织(1.02±0.73,t=4.480,P<0.01,图1)。

图1 ESCC组织及癌旁组织中NRSN2-AS1的表达
2.2 ESCC细胞系中NRSN2-AS1的表达随机选取10例ESCC癌旁组织的cDNA,混合后作为对照组(Pool)。qRT-PCR检测显示:NRSN2-AS1在ESCC细胞系Eca109(1.99±0.04)、TE1(2.43±0.09)、TE13(3.68±0.21)和KYSE150(4.44±0.26)中的表达水平显著高于对照组(1.00±0.08)(P均<0.01,图2)。由于NRSN2-AS1在Eca109细胞中表达相对较低,故选择其用于后续过表达实验。

图2 ESCC细胞系中NRSN2-AS1的表达
2.3 NRSN2-AS1过表达的效率本实验在Eca109细胞中转染pcDNA3.1-NRSN2-AS1,采用qRT-PCR法检测过表达效率。与转染pcDNA3.1-NC组中NRSN2-AS1(1.01±0.13)相比,转染pcDNA3.1-NRSN2-AS1组中NRSN2-AS1(44.98±3.30)的表达水平显著提高(t=18.826,P<0.01)。
2.4 NRSN2-AS1过表达对Eca109细胞增殖的影响MTS结果显示,与pcDNA3.1-NC组相比,pcDNA3.1-NRSN2-AS1组中NRSN2-AS1过表达可促进Eca109细胞的增殖能力(P<0.01,图3)。

图3 MTS检测NRSN2-AS1过表达对Eca109细胞增殖的影响
2.5 NRSN2-AS1过表达对Eca109细胞迁移及侵袭的影响划痕愈合实验结果显示,转染pcDNA3.1-NRSN2-AS1组Eca109细胞的划痕愈合率(69.03%±4.11%)显著高于pcDNA3.1-NC(82.12%±3.08%)(t=12.651,P<0.01,图4A)。Transwell侵袭实验结果显示,转染pcDNA3.1-NRSN2-AS1组Eca109细胞的穿膜细胞数(618.52±7.78)显著高于pcDNA3.1-NC(467.51±3.54)(t=22.667,P<0.01,图4B)。实验结果表明,NRSN2-AS1可显著提高Eca109细胞的迁移及侵袭能力。

图4 Eca109细胞迁移、侵袭能力检测:A.划痕愈合实验检测NRSN2-AS1过表达对Eca109细胞迁移能力的影响;B.Transwell侵袭实验检测NRSN2-AS1过表达对Eca109细胞侵袭能力的影响:1.pcDNA3.1-NC组;2.pcDNA3.1-NRSN2-AS1组
2.6 生物信息学预测NRSN2-AS1的靶基因及实验验证使用RNA22数据库预测发现, NRSN2-AS1的3’UTR区存在miR-129-5p的结合位点,并将3’UTR区的结合位点进行点突变(图5)。qRT-PCR结果显示,pcDNA3.1-NC组和pcDNA3.1-NRSN2-AS1组中miR-129-5p的表达量分别为1.02±0.03和0.62±0.06,NRSN2-AS1过表达可显著下调miR-129-5p的表达(t=9.812,P<0.01,图6A)。双荧光素酶报告基因实验结果显示,miR-129-5p-mimic可显著降低NRSN2-AS1野生质粒的荧光活性(t=23.273,P<0.01,图6B),但对NRSN2-AS1突变质粒的荧光活性无明显影响(P>0.05);提示NRSN2-AS1可靶向调控miR-129-5p的表达。

图5 生物信息学预测NRSN2-AS1的靶基因

图6 NRSN2-AS1的靶基因:A.qRT-PCR检测Eca109细胞中NRSN2-AS1过表达对miR-129-5p表达的影响;B.双荧光素酶报告基因实验验证NRSN2-AS1与miR-129-5p的靶向调控关系
2.7 生物信息学预测NRSN2-AS1/miR-129-5p轴下游机制及实验验证采用StarbaseⅤ3.0数据库对miR-129-5p的下游靶基因进行KEGG富集分析,结果显示:Wnt/β-catenin信号通路可能是miR-129-5p的下游作用靶点(图7)。TOP/FOP双荧光素酶报告基因结果显示,miR-129-5p-mimic转染后可降低TOP/FOP荧光素酶活性(t=16.053,P<0.01,图8A),而NRSN2-AS1过表达可显著增强TOP/FOP荧光素酶活性(t=10.473,P<0.01,图8B)。TargetScan数据库预测结果表明,miR-129-5p与Wnt5a的3’UTR区存在结合位点(图9)。qRT-PCR结果显示,miR-NC组和miR-129-5p-mimic组中Wnt5a的表达量分别为1.01±0.04和0.66±0.02,miR-129-5p过表达可降低Wnt5a的表达水平(t=10.291,P<0.01,图10A);而pcDNA3.1-NC组和pcDNA3.1-NRSN2-AS1组中Wnt5a表达量分别为1.00±0.05和1.48±0.06,NRSN2-AS1过表达可上调Wnt5a的表达水平(t=7.882,P<0.01,图10B)。结果表明:NRSN2-AS1可通过靶向调控miR-129-5p/Wnt5a轴激活Wnt/β-catenin信号通路。

图7 miR-129-5p的下游靶基因的KEGG富集分析

图8 miR-129-5p过表达(A)和NRSN2-AS1过表达(B)对Wnt/β-catenin信号通路的影响

图9 生物信息学预测miR-129-5p的靶基因
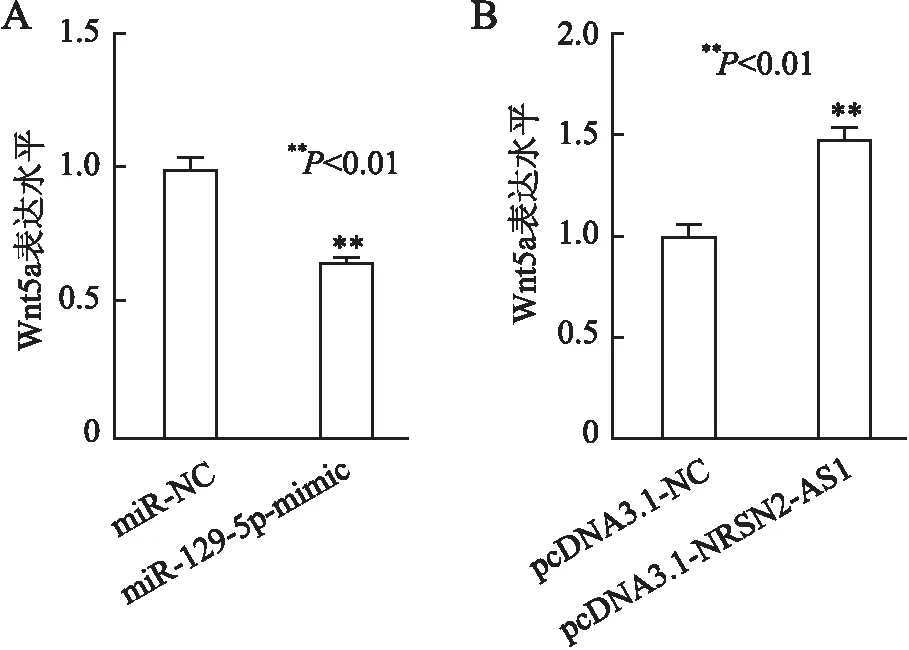
图10 miR-129-5p过表达(A)和NRSN2-AS1过表达(B)对Wnt5a表达的影响
3 讨论
ESCC属于侵袭性和病死率均较高的恶性肿瘤,由于其早期症状不明显,多数患者发现时已为中晚期[10]。因此,探索ESCC的发病机制并寻找新的潜在治疗靶点,有助于提高ESCC患者的生存率。近年随着对lncRNA的相关研究不断深入,发现其异常表达与恶性肿瘤的形成及进展密切相关[11]。例如lncRNA MALAT1在肺癌、胰腺癌、直肠癌等多种肿瘤中表达上调,并可促进肿瘤细胞的增殖、迁移及侵袭[12-13]。lncRNA NRSN2-AS1作为新近发现的长链非编码RNA,位于人类染色体20p13。目前,NRSN2-AS1在ESCC中的表达及相关分子机制尚未见报道。
本组发现NRSN2-AS1在ESCC组织和细胞系中均呈高表达,为进一步了解NRSN2-AS1在ESCC中的生物学作用,本组构建了NRSN2-AS1过表达的ESCC细胞。体外功能实验表明,NRSN2-AS1可促进ESCC细胞的增殖、迁移及侵袭。以上结果提示,NRSN2-AS1可能在ESCC的发生、发展中发挥促癌基因的作用。
在作用机制上,lncRNA可作为竞争性内源RNA与相应miRNA结合发挥调控作用[14-15]。本实验证明,NRSN2-AS1可靶向调控miR-129-5p的表达。大量研究结果表明,miR-129-5p在多种肿瘤中呈低表达,发挥抑癌基因的作用。在ESCC中miR-129-5p可通过下调Cyclin D1的表达抑制肿瘤进展[16-18]。本组通过实验进一步验证了Wnt5a是miR-129-5p的下游靶基因。Wnt5a是Wnt蛋白家族的成员,Wnt5a的表达上调可激活Wnt/β-catenin信号通路。本组应用TOP/FOP双荧光素酶报告基因发现,NRSN2-AS1通过靶向调控miR-129-5p/Wnt5a轴激活Wnt/β-catenin信号通路。本组结果与NRSN2-AS1在卵巢癌中的作用机制一致[9]。Wnt/β-catenin信号通路在人类多种恶性肿瘤中被激活,在肿瘤细胞的迁移侵袭、抗凋亡及化疗耐药等方面的调控发挥重要作用[19-20]。在ESCC中Wnt/β-catenin信号通路激活后可刺激β-catenin的核移位,促进下游靶基因Cyclin D1和C-myc的表达,进而导致肿瘤细胞的恶性增殖,从而促进肿瘤发生、发展[21]。
综上所述,NRSN2-AS1在ESCC组织及细胞中呈高表达,NRSN2-AS1可通过靶向调控miR-129-5p激活Wnt/β-catenin信号通路促进ESCC细胞的增殖、迁移及侵袭,提示NRSN2-AS1在ESCC的发生、发展中起重要作用,有望成为潜在的治疗靶点。