沉默lncRNA DNAH8-AS1靶向miR-186-5p/YY1调控前列腺癌细胞的增殖和侵袭
2022-12-21程汉波刘加元邓思文姚俊波高瑞辉
程汉波,刘加元,贾 波,张 鹏,邓思文,姚俊波,高瑞辉
前列腺癌是严重威胁男性生殖健康的恶性肿瘤,其发病率和病死率呈逐年上升趋势[1]。前列腺癌的临床治疗主要包括手术、化疗和激素等治疗,由于前列腺癌的早期临床诊断较困难,且发现多已为中晚期,患者的预后较差[2-3]。长链非编码RNA(long-chain non-coding RNA, lncRNA)是在人体细胞内高度保守的非编码RNA,可能在前列腺癌的发生、发展中发挥癌基因或抑癌基因的功能[4-5]。lncRNA在前列腺癌组织中异常表达,下调或上调其表达可显著影响前列腺癌细胞的生长和侵袭[6-7]。lncRNA DNAH8-AS1由830个核苷酸连接构成,其在细胞中的功能尚未见报道。miR-186-5p在前列腺癌、膀胱癌、胃癌等组织中呈低表达,可显著抑制肿瘤细胞的增殖、化疗抵抗、侵袭等行为[8-10]。本文探讨lncRNA DNAH8-AS1在前列腺癌中的表达,分析其对前列腺癌细胞生物学行为的影响及对miR-186-5p的靶向调控作用,为前列腺癌的诊疗提供新的靶点。
1 材料与方法
1.1 材料前列腺癌细胞系PC-3、LNCaP、DU-145、C4-2B与正常前列腺上皮细胞RWPE-1组均购自中科院上海生科院细胞库。lncRNA DNAH8-AS1 siRNA(si-DNAH8-AS1组)、阴性对照siRNA(Control组)、miR-186-5p mimic、NC mimic、荧光素酶报告载体(Wt-DNAH8-AS1、Mut-DNAH8-AS1、Wt-YY1、Mut-YY1),均购自上海吉玛制药公司。qRT-PCR试剂盒和TRIzol试剂盒,均购自美国Sigma公司。RPMI 1640培养基、胎牛血清、KSFM培养基,均购自美国Hyclone公司。MTT试剂盒购自上海生工生物公司;生物素标记的杂交探针购自广州锐博生物公司。转染试剂Lipofectamine 3000和Matrigel基质胶,均购自美国Invitrogen公司。双荧光素酶报告基因检测试剂盒和Transwell小室购自美国Promega公司。一抗MARK4、YAP、TAZ、α-Tubulin、YY1均购自美国BD公司。
1.2 细胞培养及转染用含10%胎牛血清的KSFM培养基培养RWPE-1细胞,用含10%胎牛血清的RPMI 1640培养基培养PC-3、LNCaP、DU-145、C4-2B,置于37 ℃、5%CO2培养箱中培养。转染前收集LNCaP细胞接种于12孔板,待细胞融合至60%,以无血清RPMI 1640培养基稀释si-DNAH8-AS1、Control组为100 nmol/L,以Lipofectamine 3000脂质体进行转染,分别为si-DNAH8-AS1组和Control组。收集各组对数生长期LNCaP细胞进行后续研究。
1.3 生物信息学技术分析lncRNA DNAH8-AS1表达及靶向基因采用GEPIA数据库分析lncRNA DNAH8-AS1在前列腺癌和癌旁组织中的表达及与前列腺癌临床分期的关系;采用LncBase Predicted v.2软件预测lncRNA DNAH8-AS1存在结合位点的miRNA。
1.4 原位杂交实验检测lncRNA DNAH8-AS1在前列腺癌和癌旁组织中表达采用石蜡包埋组织,连续3 μm厚切片,脱蜡。采用4%过氧化氢对内源性过氧化物酶进行灭活,经2%多聚甲醛溶液在室温下固定20 min。加入30 μL生物素标记的杂交探针,42 ℃孵育过夜。滴加辣根过氧化氢酶标记的链霉亲和素,在37 ℃湿盒中孵育4 h。滴加DAB试剂进行DAB显色,采用苏木精试剂进行复染,乙醇脱水后采用中性树脂封固。
1.5 qRT-PCR检测细胞中miR-186-5p、DNAH8-AS1和YY1 mRNA的表达TRIzol试剂盒提取前列腺癌细胞、正常前列腺上皮细胞和转染后LNCaP细胞总RNA,通过超微量分光光度计测定RNA浓度,通过反转录试剂盒合成cDNA。配制PCR反应体系,以GAPDH为内参检测lncRNA DNAH8-AS1和YY1 mRNA的表达,以U6为内参检测miR-186-5p的表达。lncRNA DNAH8-AS1上游引物:5′-ACACCAACAGACACCAGCAG-3′,下游引物:5′-GGTTCAGCACTGTGGGTTTT-3′;GAPDH上游引物:5′-ACAACTTTGGTATCGTGGAAGG-3′,下游引物:5′-GCCATCACGCCACAGTTTC-3′;YY1上游引物:5′-ACGGCTTCGAGGATCAGATTC-3′,下游引物:5′-TGACCAGCGTTTGTTCAATGT-3′;miR-186-5p上游引物:5′-GCGGCGGCAAAGAATTCTCC-3′,下游引物:5′-ATCCAGTGCAGGGTCCGAGG-3′。采用2-ΔΔCt方法计算miR-186-5p、DNAH8-AS1和YY1 mRNA相对表达。
1.6 MTT法检测敲减DNAH8-AS1对LNCaP细胞增殖的影响收集Control组和si-DNAH8-AS1组对数生长期LNCaP细胞,以每孔150 μL接种于96孔板。实验分别在培养1、2、3、4、5天弃去培养基,加入15 μL质量浓度为5 g/L的MTT溶液,充分混匀,避光培养3.5 h,弃去上清;每孔加入130 μL的二甲基亚砜,充分混匀。通过酶标仪上检测各孔在波长450 nm处的光密度值,代表LNCaP细胞增殖水平。
1.7 Transwell实验检测敲减DNAH8-AS1对LNCaP细胞侵袭的影响通过RPMI 1640培养基稀释Matrigel胶,在Transwell上室加入200 μL稀释后的Matrigel胶。收集Control组和si-DNAH8-AS1组对数生长期LNCaP细胞,制备无血清单细胞悬液,分别加入200 μL细胞悬液至Transwell上室,在下室加入500 μL含胎牛血清的RPMI 1640。恒温培养箱培养24 h后,棉签除去未穿过Matrigel胶的细胞,经5%多聚甲醛固定,0.3%结晶紫染液染色。洗去多余染液,晾干后于100倍显微镜下拍照,选取6个视野计数穿胶细胞数。
1.8 荧光素酶报告基因实验检测lncRNA DNAH8-AS1与miR-186-5p/YY1的靶向关系采用Lipofectamine 3000脂质体分别将Wt-DNAH8-AS1、Mut-DNAH8-AS1与miR-186-5p mimic、NC mimic共转染到LNCaP细胞;采用Lipofectamine 3000脂质体分别将Wt-YY1、Mut-YY1与miR-186-5p mimic、NC mimic共转染到LNCaP细胞。检测NC组和miR-186-5p组LNCaP细胞中的相对荧光素酶活性,具体操作按双荧光素酶报告基因实验试剂盒说明书进行。
1.9 Western blot实验检测YY1蛋白和Hippo信号通路相关蛋白的表达收集Control组和si-DNAH8-AS1组对数生长期LNCaP细胞,加入细胞裂解液提取总蛋白,BCA法测定蛋白浓度,通过SDS-PAGE胶电泳目的蛋白,以半干膜转膜法转移至硝酸纤维素膜,加入10%脱脂牛奶封闭。加入一抗YY1(1 ∶2 000)、MARK4(1 ∶2 000)、YAP(1 ∶1 000)、TAZ(1 ∶1 000)、α-Tubulin(1 ∶3 000),置于冰箱内保存。加入二抗(1 ∶10 000),在室温下保存3 h。加入ECL显影液,在凝胶成像分析系统中曝光,通过Quantity One软件分析蛋白条带的灰度值。

2 结果
2.1 前列腺癌组织中lncRNA DNAH8-AS1的表达GEPIA数据库显示,与癌旁组织相比,lncRNA DNAH8-AS1在前列腺癌组织中呈高表达(P<0.01,图1);lncRNA DNAH8-AS1表达水平与前列腺癌临床分期呈正相关(P<0.05,图2)。原位杂交检测显示,前列腺癌组织中lncRNA DNAH8-AS1的表达明显高于癌旁组织(图3)。

图1 GEPIA数据库显示lncRNA DNAH8-AS1在前列腺癌和癌旁组织中的表达

图2 GEPIA数据库显示前列腺癌中lncRNA DNAH8-AS1表达与临床分期的关系
2.2 lncRNA DNAH8-AS1在前列腺癌细胞系中的表达qRT-PCR检测结果显示,与正常前列腺上皮细胞RWPE-1相比,lncRNA DNAH8-AS1在前列腺癌细胞PC-3、LNCaP、DU-145、C4-2B中呈高表达(P<0.05);其中lncRNA DNAH8-AS1在LNCaP细胞中的表达水平最高(P<0.01,图4)。因此,用LNCaP细胞进行进一步研究。

AB

图4 前列腺癌和正常前列腺上皮细胞中lncRNA DNAH8-AS1的表达
2.3 si-DNAH8-AS1敲减LNCaP细胞中lncRNA DNAH8-AS1的表达qRT-PCR检测结果显示,Control组和si-DNAH8-AS1组LNCaP细胞中lncRNA DNAH8-AS1表达分别为6.44±0.56和1.08±0.37。与Control组比较,si-DNAH8-AS1组LNCaP细胞中lncRNA DNAH8-AS1表达水平显著降低(P<0.01)。
2.4 敲减lncRNA DNAH8-AS1表达与LNCaP细胞增殖的关系MTT法检测结果显示,与Control组相比,si-DNAH8-AS1组LNCaP细胞在转染后第2、3、4、5天时增殖活力均显著降低(P<0.05,图5),表明敲减lncRNA DNAH8-AS1可抑制LNCaP细胞的增殖。
2.5 敲减lncRNA DNAH8-AS1表达与LNCaP细胞侵袭的关系Transwell实验结果显示,Control组和si-DNAH8-AS1组LNCaP细胞穿过Matrigel基质胶的细胞数分别是(63.39 ± 8.03)个和(23.94 ± 3.86)个。与Control组比较,si-DNAH8-AS1组侵袭细胞数明显减少(P<0.01,图6),表明敲减lncRNA DNAH8-AS1可抑制LNCaP细胞的侵袭。
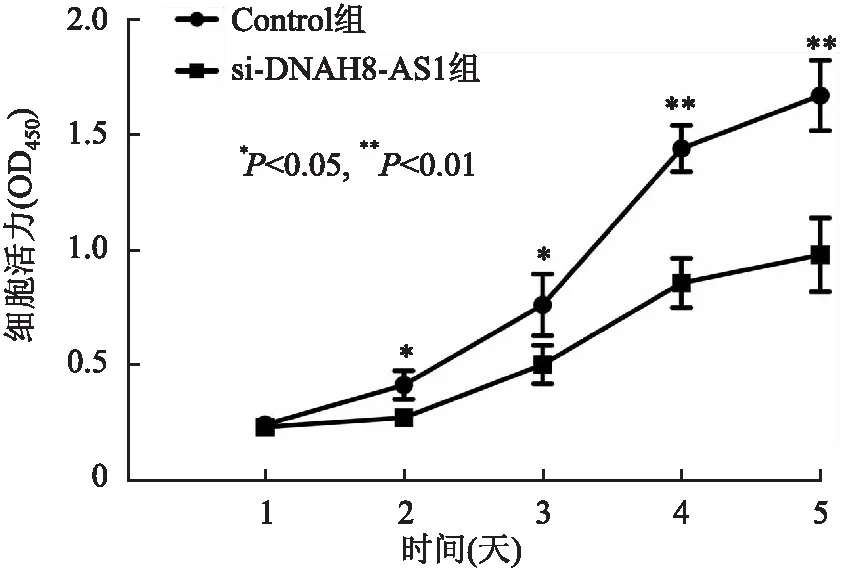
图5 敲减lncRNA DNAH8-AS1对LNCaP细胞增殖的影响
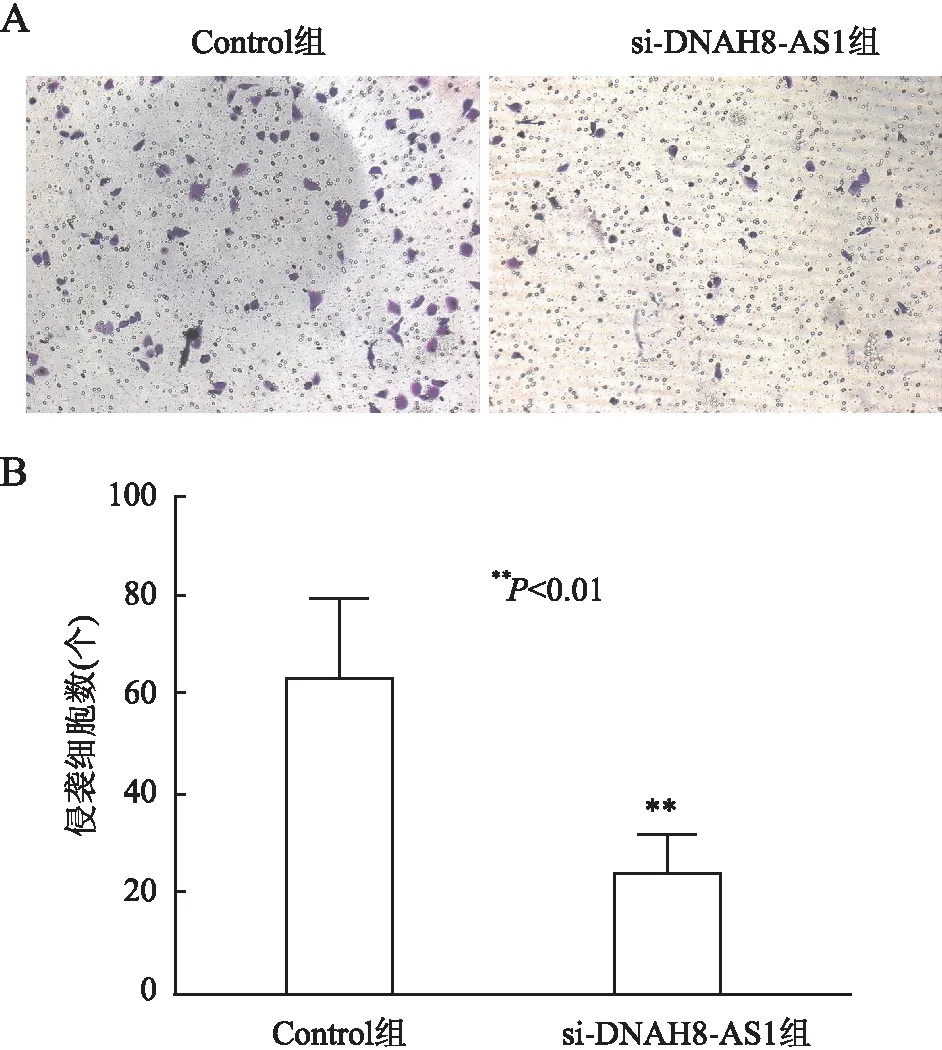
图6 敲减lncRNA DNAH8-AS1对LNCaP细胞侵袭的影响:A.Transwell检测侵袭细胞数;B.侵袭细胞数直方图
2.6 lncRNA DNAH8-AS1靶向结合miR-186-5p/YY1用生物信息学软件LncBase Predicted v.2软件预测显示:lncRNA DNAH8-AS1与miR-186-5p存在结合位点,miR-186-5p与YY1 mRNA存在结合位点(图7)。双荧光素酶报告基因实验结果显示:与NC组相比,miR-186-5p mimic显著抑制Wt-DNAH8-AS1的荧光素酶活性(P<0.01),对Mut-DNAH8-AS1荧光素酶活性无明显抑制作用(P>0.05,图8A)。与NC组相比,miR-186-5p mimic显著抑制Wt-YY1的荧光素酶活性(P<0.01),对Mut-YY1荧光素酶活性无明显抑制作用(P>0.05,图8B)。

图7 lncRNA DNAH8-AS1、YY1 mRNA的结合位点:均含有与miR-186-5p互补的核苷酸序列
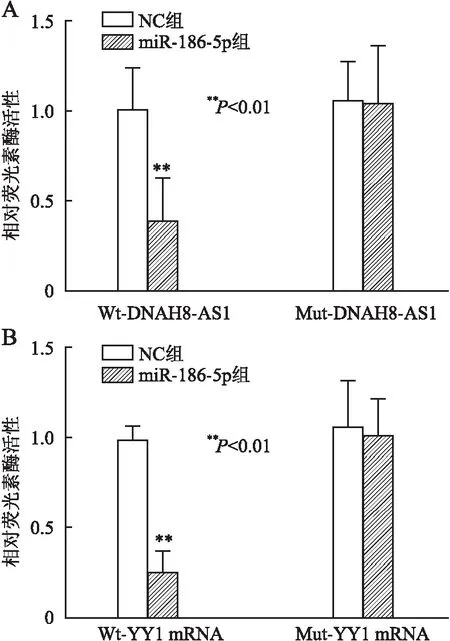
图8 双荧光素酶报告基因实验:A.lncRNA DNAH8-AS1可互补结合miR-186-5p;B.YY1 mRNA可互补结合miR-186-5p
2.7 敲减lncRNA DNAH8-AS1对LNCaP细胞中miR-186-5p和YY1 mRNA表达的影响qRT-PCR检测结果显示,Control组和si-DNAH8-AS1组LNCaP细胞中miR-186-5p的表达分别为1.02±0.22和5.62±0.98,si-DNAH8-AS1组明显高于Control组(P<0.01);Control组和si-DNAH8-AS1组LNCaP细胞中YY1 mRNA的表达分别为5.24±1.21和1.09±0.27,si-DNAH8-AS1组明显低于Control组(P<0.01)。
2.8 miR-186-5p对LNCaP细胞中YY1 mRNA表达的影响qRT-PCR检测结果显示,NC组和miR-186-5p组LNCaP细胞中miR-186-5p的表达分别为1.04±0.37和8.91±1.27,miR-186-5p组明显高于NC组(P<0.01)。NC组和miR-186-5p组LNCaP细胞中YY1 mRNA的表达分别为7.82±1.38和1.07±0.36,miR-186-5p组明显低于NC组(P<0.01)。
2.9 敲减lncRNA DNAH8-AS1对YY1蛋白和Hippo信号通路相关蛋白表达的影响Western blot检测结果显示,敲减lncRNA DNAH8-AS1后,YY1蛋白表达下调,MARK4、YAP、TAZ等Hippo信号通路相关蛋白表达下调(图9)。
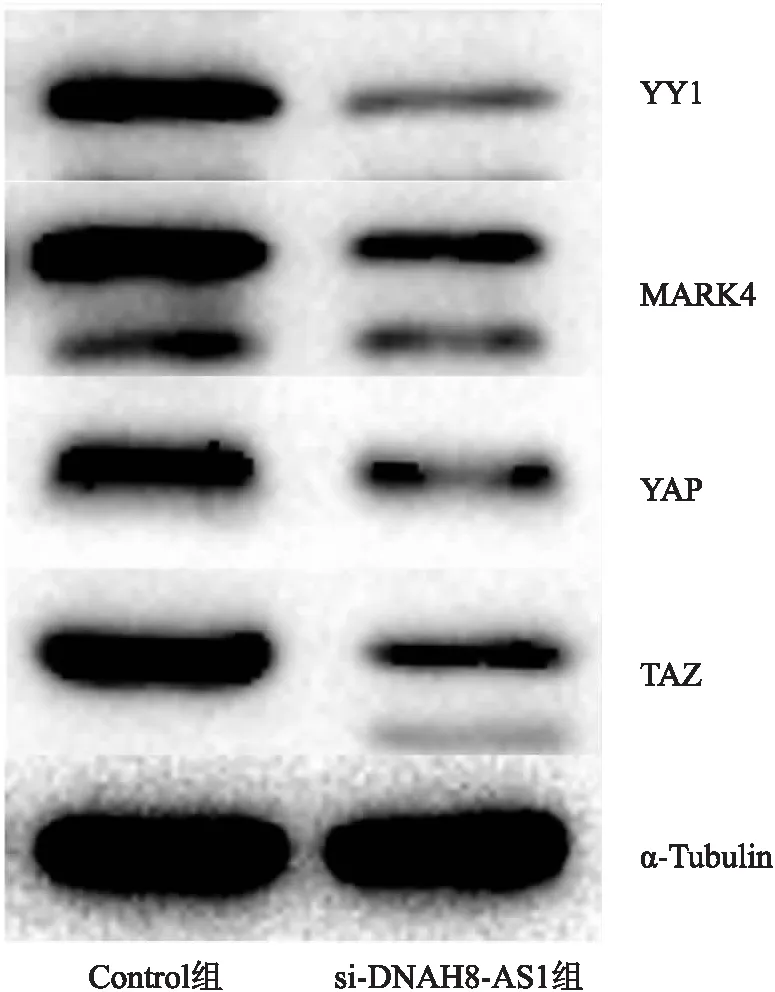
图9 敲减lncRNA DNAH8-AS1对LNCaP细胞中YY1和Hippo信号通路相关蛋白表达的影响
3 讨论
大量lncRNA芯片研究显示,lncRNA是前列腺癌早期诊断、预后评估的独立分子标志物,广泛参与组织细胞的再生和恶性转化[11-12]。lncRNA表达失调影响前列腺癌的血管生成、激素抵抗、化疗耐药等生物学过程[13]。Cui等[14]研究表明,lncRNA AC245100.4在前列腺癌中表达上调,其主要定位于细胞质中,敲低lncRNA AC245100.4有效抑制前列腺癌细胞的增殖。Li等[15]研究表明,lncRNA BLACAT1在前列腺癌组织样本和细胞系中表达下调,与其启动子的甲基化程度相关,lncRNA BLACAT1可通过靶向吸附并降低miR-361的表达,抑制前列腺癌细胞的增殖。lncRNA可能作为前列腺癌的分子标志物和治疗靶点,具有广泛的临床应用价值[16]。
lncRNA DNAH8-AS1在前列腺癌中的表达及对前列腺癌发生的调节机制并未阐明。本实验发现lncRNA DNAH8-AS1在前列腺癌组织和细胞中均呈高表达,lncRNA DNAH8-AS1表达水平越高,患者的临床分期越差,提示lncRNA DNAH8-AS1高表达可能与前列腺癌癌变过程有关。本组进一步研究显示,敲降lncRNA DNAH8-AS1表达后,LNCaP细胞的增殖和侵袭能力均明显下降,证实lncRNA DNAH8-AS1在前列腺癌发生过程中起癌基因的作用。
lncRNA能够与miRNA互补配对结合,通过抑制miRNA表达,正向调控miRNA靶基因的表达,影响细胞的生命活动[17-18]。本组通过生物信息学网站预测lncRNA DNAH8-AS1可能竞争性吸附miR-186-5p,双荧光素酶报告基因实验验证两者的靶向结合。Liu等[19]研究表明,miR-186-5p在顺铂抗性的非小细胞肺癌组织和细胞(A549和H1299)中表达下调,miR-186-5p过表达可以抑制A549和H1299细胞的增殖、迁移和侵袭,促进凋亡率。Jin等[8]研究表明,miR-186-5p在前列腺癌组织和细胞中低表达,上调miR-186-5p能够抑制前列腺癌细胞的增殖、迁移和侵袭。进一步研究显示,抑制lncRNA DNAH8-AS1表达后,可逆转miR-186-5p在前列腺癌细胞中的低表达;提示敲减lncRNA DNAH8-AS1可通过促进miR-186-5p表达,抑制前列腺癌LNCaP的细胞增殖和侵袭。本实验通过生物信息学网站预测miR-186-5p可能竞争性吸附YY1 mRNA,双荧光素酶报告基因实验验证两者的靶向结合。本组miR-186-5p表达上调后,YY1基因表达显著降低,进一步证实miR-186-5p靶向抑制YY1基因表达。YY1蛋白是一种包含锌指结构的内源性转录因子,影响细胞的分化、增殖、转移等行为[20]。近年研究显示,YY1蛋白在前列腺癌等肿瘤中高表达,促进肿瘤细胞的增殖和侵袭,发挥癌基因的功能[21]。文献报道YY1蛋白通过激活Hippo信号通路,促进肿瘤细胞的恶性生物学过程[22]。本组YY1蛋白表达下调后,MARK4、YAP、TAZ等Hippo信号通路相关蛋白表达下调,表明Hippo信号通路活化程度降低。
综上所述,lncRNA DNAH8-AS1在前列腺癌中呈高表达,与临床分期呈正相关。敲减lncRNA DNAH8-AS1通过靶向调控miR-186-5p/YY1基因表达,影响Hippo信号通路活化,抑制前列腺癌LNCaP细胞的增殖和侵袭。因此,lncRNA DNAH8-AS1有望成为前列腺癌潜在的早期诊断标志物和治疗靶点。